名校
1 . 已知反应CO(g)+H2O(g)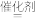 CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
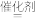 CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是| A.升高温度,K减小 |
| B.减小压强,n(CO2)增加 |
| C.更换高效催化剂,α(CO)增大 |
| D.充入一定量的氮气,n(H2)变大 |
您最近一年使用:0次
2019-11-22更新
|
267次组卷
|
14卷引用:山东省潍坊市临朐县实验中学2020-2021学年高二9月月考化学试题
山东省潍坊市临朐县实验中学2020-2021学年高二9月月考化学试题广东省蕉岭县蕉岭中学2019-2020学年高二上学期第一次段考化学试题河南省洛阳市新安县第一高级中学2020-2021学年高二10月月考化学试题甘肃省武威第十八中学2020-2021学年高二上学期期中考试化学试题广西防城港市实验高级中学2020-2021学年高二上学期期中考试化学试题贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题湖南省宁乡市第七高级中学2021-2022学年高二上学期期中考试化学试题浙江省舟山市舟山中学2021-2022学年高一下学期阶段性检测化学试题四川省广安第二中学校2021-2022学年高二上学期第一次月考化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题天津市第八中学2021-2022学年高二上学期12月月考化学试题湖南省怀化市第三中学2022-2023学年高二上学期期中考试化学试题云南省楚雄第一中学2022-2023学年高二下学期期末考试化学试题黑龙江省哈尔滨市第七十三中学校2022-2023学年高二上学期11月期中考试化学试题
2008·全国·高考真题
2 . 已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. |
B.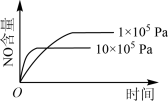 |
C.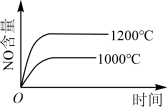 |
D.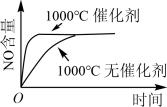 |
您最近一年使用:0次
2019-01-30更新
|
2094次组卷
|
76卷引用:2011-2012学年山东省潍坊市高二寒假作业化学(二)试卷
(已下线)2011-2012学年山东省潍坊市高二寒假作业化学(二)试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷2008年理综全国卷Ⅰ高考试题化学试题(已下线)2010年江苏省清江中学高二第二学期期末考试化学试卷(已下线)2011-2012学年高二上学期单元测试期中考试化学试卷(已下线)2011-2012年广东省汕头市金山中学高二上学期期中考试化学试卷(理科)(已下线)2011-2012年广东省广雅中学高二上学期期中考试化学(理)试卷(已下线)2011-2012学年云南省蒙自县文澜高级中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东省鄄城县第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年四川省南山中学高二上学期期末模拟考试化学试卷(已下线)2011-2012学年山东省临沂市高二上学期期末模块质量调研化学试卷(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2012年沪科版高中化学6.1提示化学反应速率和平衡之谜练习卷(已下线)2011-2012学年江苏省涟水中学高二下学期期中考试化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2012-2013学年山东省临沂市重点高中高二上学期期末考试化学试卷(已下线)2013-2014学年湖南省常德市一中高二上学期第二次检测理科化学试卷(已下线)2013-2014四川省雅安中学下学期期中考试高二化学试卷(已下线)2013-2014广东省佛山市佛山一中10月段考高二化学试卷(已下线)2013-2014湖北省沙市中学高二上学期第七次周练化学试卷(已下线)2013-2014四川省雅安中学下学期期中考试高二化学试卷(已下线)2014-2015学年湖南省娄底市高二上学期期中联考化学试卷(已下线)2014-2015河北省石家庄第二实验中学高二上学期期中化学(理)试卷2015-2016学年辽宁省大连二十中学高二上学期期中测试化学试卷2015-2016学年甘肃省会宁一中高二上期中(理)化学试卷2015-2016学年河南省安阳三十六中高二上学期期中考试化学试卷2015-2016学年山东省青岛市华侨中学高二上学期10月月考化学试卷2015-2016学年吉林省长春外国语学校高二上学期期末化学试卷2015-2016学年湖南省常德一中高二下第一次月考化学试卷2015-2016学年河北省邯郸市曲周一中高一下期中化学试卷2016-2017学年河北省冀州中学高二上第二次月考化学试卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷2016-2017学年河北省沧州一中高二上10月检测化学卷2016-2017学年河北省卓越联盟高二上第一次月考化学试卷2016-2017学年广东省湛江一中高二上第一次大考化学卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2016-2017学年甘肃省民乐一中高二上10月月考化学试卷2017届宁夏石嘴山三中高三上期中化学试卷青海省平安县第一高级中学2016-2017学年高二下学期期中考试化学试题苏教版2017届高三单元精练检测七化学试题辽宁省实验中学分校2016-2017学年高一6月月考化学试题云南省姚安县第一中学2017-2018学年高二10月月考化学试题甘肃省临夏中学2018届高三上学期期中考试化学试题青海省西宁市第四高级中学2017-2018学年高二上学期第一次月考化学试题山西省大同市第一中学2017-2018学年高二上学期期中考试化学试题黑龙江省大庆市东风中学2017-2018学年高二上学期期中考试化学试题四川省邻水实验学校2017-2018学年高二上学期第三次月考化学试题新疆昌吉市2017-2018学年高二上学期期末考试化学试题湖北省随州市第二高级中学2018-2019学年高二9月起点考试(B+C班)化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题甘肃省靖远四中2018-2019学年高二第二学期开学检测化学试题内蒙古自治区北京八中乌兰察布分校2018-2019学年高二下学期第一次月考化学试题步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡福建省晋江市南侨中学2018-2019学年高二下学期第二次月考化学试题河南省林州市第一中学2019-2020学年高二9月月考化学试题河南林州一中2019-2020学年高二上9月化学测试题甘肃省甘谷第一中学2019-2020学年高二上学期第一次月考化学试题河南省南阳市南阳一中2019-2020学年高二上期第三次月考化学试题湖南省株洲市茶陵县第三中学2019-2020学年高二上学期期中考试化学(选考)试题新疆维吾尔自治区昌吉玛纳斯县第一中学2018-2019学年高二上学期期中考试化学试题北京市昌平区新学道临川学校2019-2020学年高二上学期期中考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高二上学期第二次月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二上学期期中考试化学试题吉林省大安一中2019-2020学年高三上学期第四次月考化学试题云南省屏边县第一中学2019-2020学年高二上学期12月月考化学试题安徽省滁州市定远县育才学校2019-2020学年高二上学期期末考试(普通班)化学试题河南省周口市扶沟县包屯高中2019---2020学年高二上期期末考试化学试题吉林省白城市第十四中学2020届高三上学期期末考试化学试题(已下线)第02章 化学反应速率与化学平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)四川省广安市武胜烈面中学校2020-2021学年高二上学期10月月考化学试题辽宁省铁岭市开原市第二高级中学2020-2021学年高二上学期期初考试化学试题西藏自治区拉萨那曲高级中学2021-2022学年高二下学期入学检测化学试题广西防城港市防城中学2021-2022学年高二上学期期中考试化学试题贵州省六盘水市外国语学校2021-2022学年高二上学期期中考试化学试题广东省兴宁市下堡中学2021-2022学年高二上学期期末质量检测化学试题河南省商丘市柘城县德盛高级中学2023-2024学年高二上学期11月月考化学试卷
3 . 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式________ 。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L·min),则平衡后n(CO)=________ mol,关于该平衡的下列说法正确的是________ 。
a.增大压强,平衡一定向右移动
b.其它条件不变,升高温度,化学反应速率一定增大
c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.向平衡后的容器中再充人0. 2mol NO和0.1mol CO,化学平衡常数增大
e.达到平衡后v正(NO)=2v逆(N2)
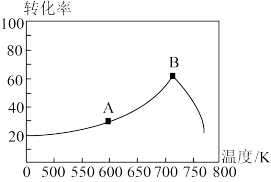
(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示。A点的反应速率v正________ v逆(填><或=),A、B两点反应的平衡常数较大的是_________ (填A或B)。
(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH )较小,试分析原因:
)较小,试分析原因:________ .0.1mol·L-1NH4NO3溶液中离子浓度由大到小的顺序是________ ,常温下NO 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=________ mol·L-1(保留两位有效数字)。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1)
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO2(g)+N2(g) △H=-748kJ·mol-12CO(g)+O2(g)=2CO2(g) △H2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L·min),则平衡后n(CO)=
a.增大压强,平衡一定向右移动
b.其它条件不变,升高温度,化学反应速率一定增大
c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.向平衡后的容器中再充人0. 2mol NO和0.1mol CO,化学平衡常数增大
e.达到平衡后v正(NO)=2v逆(N2)
(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示。A点的反应速率v正

(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH
 )较小,试分析原因:
)较小,试分析原因: 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=
您最近一年使用:0次
名校
4 . 据《读卖新闻》报道,日本海洋研究开发机构正在开发一项使用镍催化剂将二氧化碳转化成甲烷的新技术。实验室模拟该过程的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g),向一个固定容积为 2L 的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:c(CO2)=0.2 mol•L-1,c(H2)=0.8 mol·L-1,c(CH4)=0.8 mol•L-1。下列说法不正确的是
CH4(g)+2H2O(g),向一个固定容积为 2L 的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:c(CO2)=0.2 mol•L-1,c(H2)=0.8 mol·L-1,c(CH4)=0.8 mol•L-1。下列说法不正确的是
 CH4(g)+2H2O(g),向一个固定容积为 2L 的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:c(CO2)=0.2 mol•L-1,c(H2)=0.8 mol·L-1,c(CH4)=0.8 mol•L-1。下列说法不正确的是
CH4(g)+2H2O(g),向一个固定容积为 2L 的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:c(CO2)=0.2 mol•L-1,c(H2)=0.8 mol·L-1,c(CH4)=0.8 mol•L-1。下列说法不正确的是| A.反应速率υ(H2)=0.16mol•L-1•min-1 |
| B.容器体积扩大为4L,平衡向逆反应方向移动 |
| C.向体系中再充入1mol H2,CO2的转化率增大 |
| D.此条件下该可逆反应的平衡常数K=25 |
您最近一年使用:0次
2016-12-09更新
|
226次组卷
|
3卷引用:2016届山东省潍坊市临朐县高三上学期12月统考化学试卷
2013·山东潍坊·一模
5 . 碳元素的单质及其化合物与人类的生产、生活、科研息息相关。请回答下列问题:
(1)绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s)=4(C3H6O3)+(s)+O2(g)+4e- △H=+1360kJ·mol-1
12(C3H6O3)+(s)+12e-=C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:_______ ,
(2)工业上利用水煤气合成甲醇的主要反应可表示为:H2(g)+1/2CO(g)⇌1/2CH3OH(g)△H=-45.4kJ·mol-1。
向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①该温度条件下,上述反应的化学平衡常数K=_______ 。
②若容器容积不变,下列措施可增加CH3OH产率的是_______ (填写序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入O210molH2和0.05molCO
③若该反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,则平衡向_______ (填“逆向”、“正向”或“不”)移动,化学平衡常数K_______ (填“增大”、“减小”或“不变”)。
(3)已知反应:2CO(g)+O2(g)=2CO2(g) △H<0,根据原电池原理该反应能否设计成燃料电池。若能,请写出当电解质溶液为KOH溶液时的负极反应式(若不能,该空可不作答):_______ 。
(1)绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s)=4(C3H6O3)+(s)+O2(g)+4e- △H=+1360kJ·mol-1
12(C3H6O3)+(s)+12e-=C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:
(2)工业上利用水煤气合成甲醇的主要反应可表示为:H2(g)+1/2CO(g)⇌1/2CH3OH(g)△H=-45.4kJ·mol-1。
向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①该温度条件下,上述反应的化学平衡常数K=
②若容器容积不变,下列措施可增加CH3OH产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入O210molH2和0.05molCO
③若该反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,则平衡向
(3)已知反应:2CO(g)+O2(g)=2CO2(g) △H<0,根据原电池原理该反应能否设计成燃料电池。若能,请写出当电解质溶液为KOH溶液时的负极反应式(若不能,该空可不作答):
您最近一年使用:0次
11-12高二上·辽宁沈阳·阶段练习
6 . 对于平衡体系mA(g)+nB(g)=pC(g)+qD(g) ΔH<0。下列结论中错误的是
| A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n |
| C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a |
| D.若改变条件使平衡体系中物质的浓度发生变化,则平衡一定发生移动 |
您最近一年使用:0次
10-11高三上·山东潍坊·阶段练习
7 . 一定温度下,在体积为2L的密闭容器中加入1molX和1molY进行如下反应:
X(g)+Y(g) 2Z(g)+W(s) △H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol·L-1。下列判断正确的是
2Z(g)+W(s) △H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol·L-1。下列判断正确的是
X(g)+Y(g)
 2Z(g)+W(s) △H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol·L-1。下列判断正确的是
2Z(g)+W(s) △H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol·L-1。下列判断正确的是| A.若向平衡混合物中加入少量W,正、逆反应速率均增大 |
| B.平衡后再加入X,上述反应的△H增大 |
C.温度不变,将容器的体积扩大一倍,Z的平衡浓度变为原来的 |
| D.2min时,用Y表示的反应速率为0.2mol·L-1·min-1 |
您最近一年使用:0次
11-12高二·山东潍坊·假期作业
8 . (1)现有一透明的注射器针筒,充满NO2气体(如图甲),当推动活塞时,气体的颜色将_______ (填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲的一半时(如图乙),NO2的浓度_______ (填“大于”、“等于”或“小于”)推压活塞前NO2浓度的2倍。当观察到_______ 时,可确定针筒内已经达到了化学平衡状态。当活塞后拉时,通过针筒又吸进少量NO2气体,再前推活塞固定在图乙位置,NO2的转化率将_______ (填“增大”、“减小”、或“不变”)。

(2)另有一透明的注射器针筒,充满H2、I2、HI气体(如图甲),当推动活塞时,气体的颜色将_______ (填“变浅”、“变深”、“先变深后变浅”或“先变浅后变深”),当气体体积变为图甲的一半时(如图乙,此时I2仍为气体),HI的浓度_______ (填“大于”、“等于”或“小于”)推压活塞前HI浓度的2倍。

(2)另有一透明的注射器针筒,充满H2、I2、HI气体(如图甲),当推动活塞时,气体的颜色将
您最近一年使用:0次



