2023高三·全国·专题练习
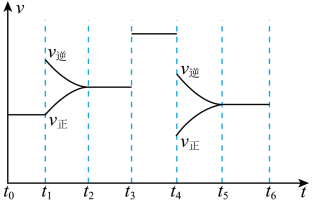
1 . 某温度时,在一个容积为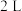 的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为___________ 。
(2)反应开始至 ,气体Y的平均反应速率为
,气体Y的平均反应速率为___________ 。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的___________ 倍;
②若此时将容器的体积缩小为原来的一半,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为___________ 反应(填“放热”或“吸热”)。
(4)若上述反应在 后的
后的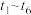 内反应速率与反应时间图象如下,在每一时刻均改变一个影响反应速率的因素,则______。
内反应速率与反应时间图象如下,在每一时刻均改变一个影响反应速率的因素,则______。
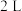 的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)反应开始至
 ,气体Y的平均反应速率为
,气体Y的平均反应速率为(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的
②若此时将容器的体积缩小为原来的一半,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为
(4)若上述反应在
 后的
后的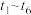 内反应速率与反应时间图象如下,在每一时刻均改变一个影响反应速率的因素,则______。
内反应速率与反应时间图象如下,在每一时刻均改变一个影响反应速率的因素,则______。
A.在 时增大了压强 时增大了压强 | B.在 时加入了催化剂 时加入了催化剂 |
C.在 时降低了温度 时降低了温度 | D. 时X的转化率最高 时X的转化率最高 |
您最近一年使用:0次
名校
解题方法
2 . 氮的氧化物是大气污染物之一,研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)碘蒸气的存在能大幅度提高 的分解速率,反应历程为:
的分解速率,反应历程为:
第一步: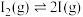 (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: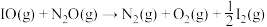 (快反应)
(快反应)
实验表明,含碘时 分解速率方程
分解速率方程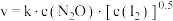 (
( 为速率常数)。下列表述正确的是___________
为速率常数)。下列表述正确的是___________
(2)对反应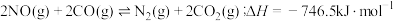 ,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
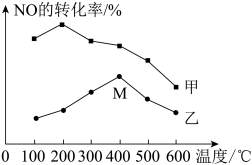
图中M点对应的速率(对应温度 )
)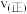
___________ 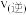 (填“>”、“<”或“=”),温度高于
(填“>”、“<”或“=”),温度高于 ,NO转化率降低的原因可能是
,NO转化率降低的原因可能是___________ 。
(3)在密闭容器中充入 和
和 ,发生反应:
,发生反应: 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。

①下列物理量中,图中d点大于b点的是___________ (填字母)。
A.正反应速率 B.逆反应速率
C. 的浓度 D.对应温度的平衡常数
的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为___________ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的___________ 点。
(4) 时,向容积为2L的恒容容器中充入
时,向容积为2L的恒容容器中充入 、
、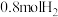 ,发生反应:
,发生反应: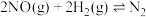
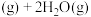 ,体系的总压强P随时间t的变化如下表所示:
,体系的总压强P随时间t的变化如下表所示:
①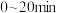 内该反应的平均反应速率
内该反应的平均反应速率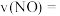
___________  。
。
②该温度下反应的平衡常数
___________  (用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(1)碘蒸气的存在能大幅度提高
 的分解速率,反应历程为:
的分解速率,反应历程为:第一步:
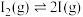 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
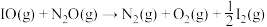 (快反应)
(快反应)实验表明,含碘时
 分解速率方程
分解速率方程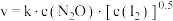 (
( 为速率常数)。下列表述正确的是___________
为速率常数)。下列表述正确的是___________| A.升高温度,第一步向右进行的程度变大 |
| B.第二步的活化能比第三步小 |
C. 为反应的催化剂 为反应的催化剂 |
D. 分解反应的速率与是否含碘蒸气有关 分解反应的速率与是否含碘蒸气有关 |
(2)对反应
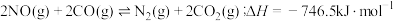 ,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
图中M点对应的速率(对应温度
 )
)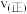
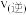 (填“>”、“<”或“=”),温度高于
(填“>”、“<”或“=”),温度高于 ,NO转化率降低的原因可能是
,NO转化率降低的原因可能是(3)在密闭容器中充入
 和
和 ,发生反应:
,发生反应: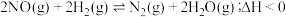 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.逆反应速率
C.
 的浓度 D.对应温度的平衡常数
的浓度 D.对应温度的平衡常数②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的
(4)
 时,向容积为2L的恒容容器中充入
时,向容积为2L的恒容容器中充入 、
、 ,发生反应:
,发生反应: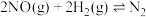
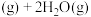 ,体系的总压强P随时间t的变化如下表所示:
,体系的总压强P随时间t的变化如下表所示: | 0 | 10 | 20 | 30 | 40 |
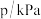 | 240 | 226 | 216 | 210 | 210 |
 内该反应的平均反应速率
内该反应的平均反应速率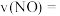
 。
。②该温度下反应的平衡常数

 (用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
您最近一年使用:0次
2023-12-18更新
|
166次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
3 . Ⅰ.25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如下表。
(1)则该温度下,
___________  ;K3=
;K3=___________ (用 和
和 表示)。
表示)。
Ⅱ.完成下列问题
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04mol 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
___________ (填“>”“<”或“=”)0;
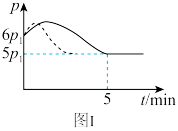
(3)若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是___________ ;
(4)5min时,再充入0.08molNO和0.04mol ,则达平衡后NO的体积分数将
,则达平衡后NO的体积分数将___________ (填“增大”“减小”或“不变”)。
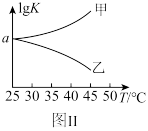
(5)图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(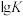 )与温度的变化关系图,其中正确的曲线是
)与温度的变化关系图,其中正确的曲线是___________ (填“甲”或“乙”)。
Ⅲ.在300℃下,将 和
和 按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应
按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应 ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,
的平衡转化率为50%,
(6)该反应条件下的平衡常数为
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
| 热化学方程式 | 平衡常数 | |
| ① | 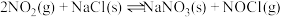 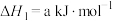 |  |
| ② | 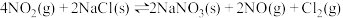 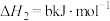 |  |
| ③ |  |  |
(1)则该温度下,

 ;K3=
;K3= 和
和 表示)。
表示)。Ⅱ.完成下列问题
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04mol
 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则

(3)若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是
(4)5min时,再充入0.08molNO和0.04mol
 ,则达平衡后NO的体积分数将
,则达平衡后NO的体积分数将(5)图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(
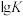 )与温度的变化关系图,其中正确的曲线是
)与温度的变化关系图,其中正确的曲线是
Ⅲ.在300℃下,将
 和
和 按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应
按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应 ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,
的平衡转化率为50%,(6)该反应条件下的平衡常数为

您最近一年使用:0次
名校
4 . 氢能是一种极具发展潜力的清洁能源,以下反应是目前大规模制取氢气的重要方法之一:
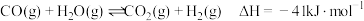
(1)为提高该反应中 的平衡转化率,理论上可以采取的措施为
的平衡转化率,理论上可以采取的措施为___________ 。
a.增大压强 b.升高温度 c.通入过量水蒸气
(2) 时,该反应的平衡常数
时,该反应的平衡常数 。该温度下,在容积为
。该温度下,在容积为 的密闭容器中进行反应,测得某一时刻反应混合物中
的密闭容器中进行反应,测得某一时刻反应混合物中 、
、 、
、 、
、 的物质的量分别为
的物质的量分别为 、
、 、
、 、
、 。
。
①该时刻反应的浓度商
___________ (填计算结果)。
②该时刻反应___________ (填“正向进行”或“逆向进行”或“已达平衡”)。
(3) 时,该反应的平衡常数
时,该反应的平衡常数 ,该温度下,在容积为
,该温度下,在容积为 的密闭容器中投入
的密闭容器中投入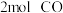 与
与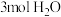 。反应达平衡时
。反应达平衡时 的转化率为
的转化率为___________ 。
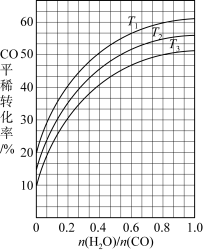
(4)下图表示不同温度下, 平衡转化率随
平衡转化率随 的变化趋势。
的变化趋势。 、
、 和
和 的三个温度中最大的是
的三个温度中最大的是___________ (填“ ”或“
”或“ ”或“
”或“ ”),原因是
”),原因是___________ 。
已知: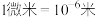 ,
,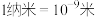
(5)实验发现,其它条件不变,一定反应时间内,向反应体系中投入一定量的 可以增大
可以增大 的物质的量分数,实验结果如图所示。相比使用微米
的物质的量分数,实验结果如图所示。相比使用微米 ,使用纳米
,使用纳米 时
时 的物质的量分数更大的可能原因是
的物质的量分数更大的可能原因是___________ 。

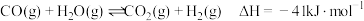
(1)为提高该反应中
 的平衡转化率,理论上可以采取的措施为
的平衡转化率,理论上可以采取的措施为a.增大压强 b.升高温度 c.通入过量水蒸气
(2)
 时,该反应的平衡常数
时,该反应的平衡常数 。该温度下,在容积为
。该温度下,在容积为 的密闭容器中进行反应,测得某一时刻反应混合物中
的密闭容器中进行反应,测得某一时刻反应混合物中 、
、 、
、 、
、 的物质的量分别为
的物质的量分别为 、
、 、
、 、
、 。
。①该时刻反应的浓度商

②该时刻反应
(3)
 时,该反应的平衡常数
时,该反应的平衡常数 ,该温度下,在容积为
,该温度下,在容积为 的密闭容器中投入
的密闭容器中投入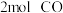 与
与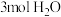 。反应达平衡时
。反应达平衡时 的转化率为
的转化率为(4)下图表示不同温度下,
 平衡转化率随
平衡转化率随 的变化趋势。
的变化趋势。 、
、 和
和 的三个温度中最大的是
的三个温度中最大的是 ”或“
”或“ ”或“
”或“ ”),原因是
”),原因是
已知:
 ,
,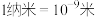
(5)实验发现,其它条件不变,一定反应时间内,向反应体系中投入一定量的
 可以增大
可以增大 的物质的量分数,实验结果如图所示。相比使用微米
的物质的量分数,实验结果如图所示。相比使用微米 ,使用纳米
,使用纳米 时
时 的物质的量分数更大的可能原因是
的物质的量分数更大的可能原因是
您最近一年使用:0次
名校
解题方法
5 . 将 清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。
清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。
I.利用 合成甲醇
合成甲醇
在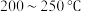 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:
反应i: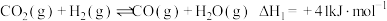
反应ii:
反应iii: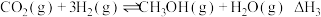
(1)反应ⅲ的焓变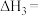
___________  ;反应iii能自发进行的温度条件是
;反应iii能自发进行的温度条件是___________ (填“高温”或“低温”或“任何温度”)。
(2)该反应条件下,同时存在副反应ⅳ: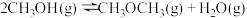 。已知:
。已知: 的沸点为
的沸点为 ,
, 的沸点为
的沸点为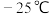 。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因
。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因___________ 。
II.利用 和甲醇合成碳酸二甲酯
和甲醇合成碳酸二甲酯
反应v: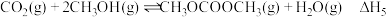
(3)在不同的温度、压强下,一定反应时间内,测定反应ⅴ中甲醇的转化率。甲醇转化率与温度的关系为图a,与压强的关系为图b(曲线未画出)。
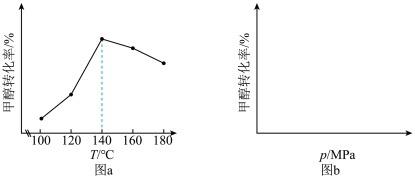
①根据图a判断,反应ⅴ的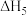
___________ 0(填“>”或“<”)。
②在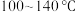 之间,随着温度升高,甲醇转化率增大的原因可能是
之间,随着温度升高,甲醇转化率增大的原因可能是___________ 。
③在图b中绘制出甲醇转化率与压强的关系曲线___________ (表示出变化趋势即可)。
 清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。
清洁转化为高附加值化学品以实现资源利用是“碳中和”研究的热点。I.利用
 合成甲醇
合成甲醇
在
 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:反应i:
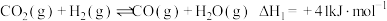
反应ii:

反应iii:
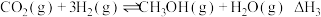
(1)反应ⅲ的焓变
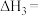
 ;反应iii能自发进行的温度条件是
;反应iii能自发进行的温度条件是(2)该反应条件下,同时存在副反应ⅳ:
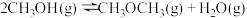 。已知:
。已知: 的沸点为
的沸点为 ,
, 的沸点为
的沸点为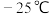 。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因
。反应进行一段时间后间歇降到室温,可提高甲醇的产率,结合反应iii、iv,解释可能的原因II.利用
 和甲醇合成碳酸二甲酯
和甲醇合成碳酸二甲酯
反应v:
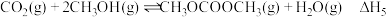
(3)在不同的温度、压强下,一定反应时间内,测定反应ⅴ中甲醇的转化率。甲醇转化率与温度的关系为图a,与压强的关系为图b(曲线未画出)。

①根据图a判断,反应ⅴ的
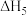
②在
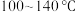 之间,随着温度升高,甲醇转化率增大的原因可能是
之间,随着温度升高,甲醇转化率增大的原因可能是③在图b中绘制出甲醇转化率与压强的关系曲线
您最近一年使用:0次
名校
解题方法
6 . 研究 之间的转化具有重要意义。
之间的转化具有重要意义。
(1)已知:
 ,将一定量
,将一定量 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。
①下列可以作为反应达到平衡的判据是___________ 。
A.气体的压强不变 B.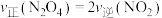 C.K不变
C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
②在恒温恒容容器中加入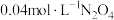 ,经过
,经过 反应达到平衡,
反应达到平衡, 气体的平衡转化率为75%,则用
气体的平衡转化率为75%,则用 表示的平均反应速率为
表示的平均反应速率为___________  (用t表示)。
(用t表示)。
③在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。

由状态B到状态A,可以选择方法是___________ (填“升高”或“降低”)温度。A、C两点气体的颜色是___________ (填“A比C深”、“C比A深”或“A与C一样深”)。
(2)NO氧化反应: 分两步进行,其反应过程能量变化示意图如左图。
分两步进行,其反应过程能量变化示意图如左图。
I.


II.




①决定NO氧化反应速率的步骤是___________ (填“I”或“II”)。
②在恒容的密闭容器中充入一定量的NO和 气体,保持其它条件不变,控制反应温度分别为
气体,保持其它条件不变,控制反应温度分别为 和
和
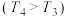 ,测得
,测得 随t(时间)的变化曲线如右图。转化相同量的NO,在温度
随t(时间)的变化曲线如右图。转化相同量的NO,在温度___________ (填“ ”或“
”或“ ”)下消耗的时间较长,试结合反应过程能量图分析其原因
”)下消耗的时间较长,试结合反应过程能量图分析其原因___________ 。
 之间的转化具有重要意义。
之间的转化具有重要意义。(1)已知:

 ,将一定量
,将一定量 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。①下列可以作为反应达到平衡的判据是
A.气体的压强不变 B.
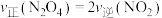 C.K不变
C.K不变D.容器内气体的密度不变 E.容器内颜色不变
②在恒温恒容容器中加入
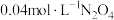 ,经过
,经过 反应达到平衡,
反应达到平衡, 气体的平衡转化率为75%,则用
气体的平衡转化率为75%,则用 表示的平均反应速率为
表示的平均反应速率为 (用t表示)。
(用t表示)。③在温度为
 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
由状态B到状态A,可以选择方法是
(2)NO氧化反应:
 分两步进行,其反应过程能量变化示意图如左图。
分两步进行,其反应过程能量变化示意图如左图。I.



II.





①决定NO氧化反应速率的步骤是
②在恒容的密闭容器中充入一定量的NO和
 气体,保持其它条件不变,控制反应温度分别为
气体,保持其它条件不变,控制反应温度分别为 和
和
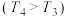 ,测得
,测得 随t(时间)的变化曲线如右图。转化相同量的NO,在温度
随t(时间)的变化曲线如右图。转化相同量的NO,在温度 ”或“
”或“ ”)下消耗的时间较长,试结合反应过程能量图分析其原因
”)下消耗的时间较长,试结合反应过程能量图分析其原因
您最近一年使用:0次
2023-12-13更新
|
106次组卷
|
2卷引用:浙江省杭州第二中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 以CO2和NH3为原料合成尿素有利于实现“碳达峰、碳中和”,该体系中同时存在以下反应:
Ⅰ.2NH3(g)+CO2(g) NH2COONH4(s) ΔH1=-159kJ·mol-1
NH2COONH4(s) ΔH1=-159kJ·mol-1
Ⅱ.2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH2
CO(NH2)2(s)+H2O(g) ΔH2
Ⅲ.NH2COONH4(s) CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
回答下列问题:
(1)反应Ⅱ的ΔH2=___________ kJ·mol-1,ΔS___________ 0(填“>”或“<”)。
(2)一定温度下,按物质的量之比为2:1通入NH3和CO2至密闭容器中,假设仅发生反应Ⅰ。达到平衡后,CO2的平衡浓度为c1mol·L-1,其他条件不变,缩小容器容积,重新达到平衡后,CO2的平衡浓度为c2mol·L-1,则c1___________ c2(填“>”、“<”或“=”)。
(3)为研究上述三个反应的平衡关系,通入3mol的NH3、CO2混合气体至10L恒容密闭容器中,NH3的平衡分压随初始充入NH3与CO2的物质的量之比、温度的变化关系如图所示。
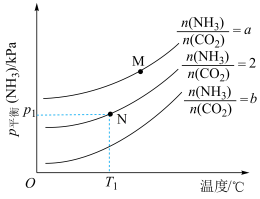
①a___________ b(填“>”或“<”)。
②M点的p平衡(NH3)大于N点的p平衡(NH3),原因为___________ (答一点)。
③T1℃时,反应前容器内气体压强为p0kPa,达到N点对应平衡状态的时间为tmin,则0~tmin时段反应的平均速率v(CO2)=___________ mol·L-1·min-1(用代数式表示)。保持温度不变,平衡后再向容器中通入一定量的水蒸气,NH2COONH4的平衡产率___________ (填“增大”、“减小”或“不变”)。
Ⅰ.2NH3(g)+CO2(g)
 NH2COONH4(s) ΔH1=-159kJ·mol-1
NH2COONH4(s) ΔH1=-159kJ·mol-1Ⅱ.2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH2
CO(NH2)2(s)+H2O(g) ΔH2Ⅲ.NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH3=+72kJ·mol-1回答下列问题:
(1)反应Ⅱ的ΔH2=
(2)一定温度下,按物质的量之比为2:1通入NH3和CO2至密闭容器中,假设仅发生反应Ⅰ。达到平衡后,CO2的平衡浓度为c1mol·L-1,其他条件不变,缩小容器容积,重新达到平衡后,CO2的平衡浓度为c2mol·L-1,则c1
(3)为研究上述三个反应的平衡关系,通入3mol的NH3、CO2混合气体至10L恒容密闭容器中,NH3的平衡分压随初始充入NH3与CO2的物质的量之比、温度的变化关系如图所示。

①a
②M点的p平衡(NH3)大于N点的p平衡(NH3),原因为
③T1℃时,反应前容器内气体压强为p0kPa,达到N点对应平衡状态的时间为tmin,则0~tmin时段反应的平均速率v(CO2)=
您最近一年使用:0次
2023-12-11更新
|
144次组卷
|
2卷引用:河南省顶级名校2023-2024学年高三上学期12月教学质量测评理科综合试题
名校
8 . 尿素和氨气对于提高农作物产量和品质有重要作用。
合成尿素的反应为: 。合成中氨碳比[
。合成中氨碳比[ ]分别为3和4时,反应相同时间测得CO2的转化率随温度的变化曲线如图所示。
]分别为3和4时,反应相同时间测得CO2的转化率随温度的变化曲线如图所示。

(1)该反应的化学平衡常数表达式
__________ 。
(2)图中曲线Ⅰ对应的氨碳比为__________ 。a、b、c三点对应的平衡常数大小关系为:__________ (用 、
、 、
、 表示),理由是
表示),理由是__________ 。
(3)工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:

反应Ⅱ:
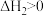
下列示意图中[a表示 ,b表示
,b表示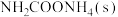 ,c表示
,c表示 ],能正确表示尿素合成过程中能量变化曲线是__________。
],能正确表示尿素合成过程中能量变化曲线是__________。
(4)实验室模拟工业合成尿素的反应: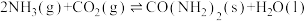 。在恒定温度下,将
。在恒定温度下,将 和CO2按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的
和CO2按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的 和
和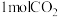 ,在40min时重新达到平衡,请在图中画出25~50min内
,在40min时重新达到平衡,请在图中画出25~50min内 的浓度变化曲线
的浓度变化曲线________ 。

合成尿素的反应为:
 。合成中氨碳比[
。合成中氨碳比[ ]分别为3和4时,反应相同时间测得CO2的转化率随温度的变化曲线如图所示。
]分别为3和4时,反应相同时间测得CO2的转化率随温度的变化曲线如图所示。
(1)该反应的化学平衡常数表达式

(2)图中曲线Ⅰ对应的氨碳比为
 、
、 、
、 表示),理由是
表示),理由是(3)工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:


反应Ⅱ:

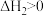
下列示意图中[a表示
 ,b表示
,b表示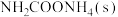 ,c表示
,c表示 ],能正确表示尿素合成过程中能量变化曲线是__________。
],能正确表示尿素合成过程中能量变化曲线是__________。A. | B. |
C. | D. |
(4)实验室模拟工业合成尿素的反应:
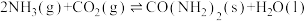 。在恒定温度下,将
。在恒定温度下,将 和CO2按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的
和CO2按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的 和
和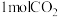 ,在40min时重新达到平衡,请在图中画出25~50min内
,在40min时重新达到平衡,请在图中画出25~50min内 的浓度变化曲线
的浓度变化曲线
您最近一年使用:0次
9 . 填空。
(1)下列事实不能用勒夏特列原理来解释的是___________ 。
A.高压有利于氢气与氮气合成氨
B.实验室中常用排饱和食盐水的方法收集Cl2
C.工业上生产硫酸时,充入过量的空气以提高SO2的转化率
D.H2、I2、HI平衡混合气体加压后颜色加深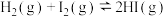
E.压缩NO2与N2O4混合气,气体颜色变深
F.500℃左右比常况下更有利于合成氨
G.开启啤酒后,瓶中马上泛起大量泡沫
(2)某化学科研小组研究在其他条件不变时,改变某一条件对反应 的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)
的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)

根据图像得出的结论,若正反应吸热,则T1___________ T2(填“>”“<”或“=”)。对于a、b、c三点:AB3的物质的量由大到小为___________ ,A2的平衡转化率由大到小为___________ ,B2的平衡转化率由大到小为___________ 。
(3)根据以下3个热化学方程式:
 △H1
△H1
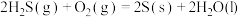 △H2
△H2
 △H3
△H3
△H1、△H2、△H3三者由大到小的顺序是___________ 。
(4)已知(NH4)2CO3捕碳的反应: 。将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图。
。将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图。

I.c点的逆反应速率和d点的正反应速率的大小关系为
___________  。(填“>”“=”或“<”)。
。(填“>”“=”或“<”)。
Ⅱ.b、c、d三点的平衡常数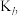 、
、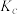 、
、 从大到小的顺序为
从大到小的顺序为___________ (填“>”、“=”或“<”)。
(1)下列事实不能用勒夏特列原理来解释的是
A.高压有利于氢气与氮气合成氨
B.实验室中常用排饱和食盐水的方法收集Cl2
C.工业上生产硫酸时,充入过量的空气以提高SO2的转化率
D.H2、I2、HI平衡混合气体加压后颜色加深
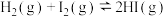
E.压缩NO2与N2O4混合气,气体颜色变深
F.500℃左右比常况下更有利于合成氨
G.开启啤酒后,瓶中马上泛起大量泡沫
(2)某化学科研小组研究在其他条件不变时,改变某一条件对反应
 的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)
的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)
根据图像得出的结论,若正反应吸热,则T1
(3)根据以下3个热化学方程式:
 △H1
△H1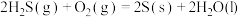 △H2
△H2 △H3
△H3△H1、△H2、△H3三者由大到小的顺序是
(4)已知(NH4)2CO3捕碳的反应:
 。将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图。
。将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图。
I.c点的逆反应速率和d点的正反应速率的大小关系为

 。(填“>”“=”或“<”)。
。(填“>”“=”或“<”)。Ⅱ.b、c、d三点的平衡常数
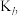 、
、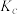 、
、 从大到小的顺序为
从大到小的顺序为
您最近一年使用:0次
名校
10 . 甲醇是重要的化工原料之一,也可用作燃料,利用合成气(主要成分为CO、 和
和 )可以合成甲醇,涉及的反应如下:
)可以合成甲醇,涉及的反应如下:
反应ⅰ:

反应ⅱ:
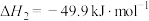
反应ⅲ:
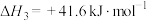
请回答下列问题:
(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
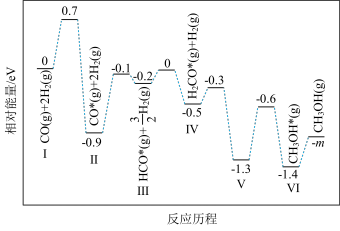
①反应ⅰ在___________ (填“较低”或“较高”)温度下才能自发进行。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式:___________ 。
③1个 (g)分子的相对能量m=
(g)分子的相对能量m=___________ eV(计算结果保留两位有效数字,已知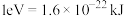 )。
)。
(2)反应ⅰ的Arrhenius经验公式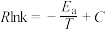 (
( 为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时实验数据如图中曲线N所示,则实验可能改变的外界条件是
为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时实验数据如图中曲线N所示,则实验可能改变的外界条件是___________ 。

(3)将一定量的 (g)和
(g)和 (g)充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ。相同温度下,在不同压强下测得
(g)充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ。相同温度下,在不同压强下测得 的平衡转化率、
的平衡转化率、 (g)的选择性[
(g)的选择性[ ]和CO的选择性[
]和CO的选择性[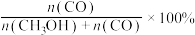 ]随压强的变化曲线如图所示。
]随压强的变化曲线如图所示。

图中表示 的平衡转化率的曲线是
的平衡转化率的曲线是___________ (填“m”“n”或“p”)。
(4)有研究认为,在某催化剂作用下反应ⅱ先后通过反应ⅲ、ⅰ来实现。保持温度T不变,向一恒容密闭容器中充入4mol 和8mol
和8mol  ,在该催化剂作用下发生反应,经5min达到平衡,测得
,在该催化剂作用下发生反应,经5min达到平衡,测得 (g)的物质的量为3mol,起始及达平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用
(g)的物质的量为3mol,起始及达平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用 分压表示的平均反应速率为
分压表示的平均反应速率为___________  (用含a的式子表示,下同,分压=总压×物质的量分数);反应ⅱ的压强平衡常数
(用含a的式子表示,下同,分压=总压×物质的量分数);反应ⅱ的压强平衡常数
___________  (
(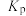 为用分压代替浓度计算的平衡常数)。
为用分压代替浓度计算的平衡常数)。
(5)光催化 制甲醇技术也是研究热点。铜基纳米光催化材料还原
制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理如图所示,光照时,低能价带失去电子并产生空穴(
的机理如图所示,光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。在低能价带上,
,具有强氧化性)。在低能价带上, 直接转化为
直接转化为 的电极反应式为
的电极反应式为______________________ 。

 和
和 )可以合成甲醇,涉及的反应如下:
)可以合成甲醇,涉及的反应如下:反应ⅰ:


反应ⅱ:

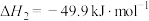
反应ⅲ:

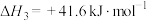
请回答下列问题:
(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
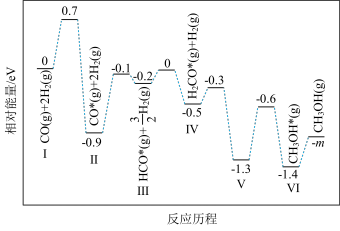
①反应ⅰ在
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式:
③1个
 (g)分子的相对能量m=
(g)分子的相对能量m=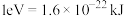 )。
)。(2)反应ⅰ的Arrhenius经验公式
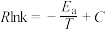 (
( 为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时实验数据如图中曲线N所示,则实验可能改变的外界条件是
为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时实验数据如图中曲线N所示,则实验可能改变的外界条件是
(3)将一定量的
 (g)和
(g)和 (g)充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ。相同温度下,在不同压强下测得
(g)充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ。相同温度下,在不同压强下测得 的平衡转化率、
的平衡转化率、 (g)的选择性[
(g)的选择性[ ]和CO的选择性[
]和CO的选择性[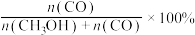 ]随压强的变化曲线如图所示。
]随压强的变化曲线如图所示。
图中表示
 的平衡转化率的曲线是
的平衡转化率的曲线是(4)有研究认为,在某催化剂作用下反应ⅱ先后通过反应ⅲ、ⅰ来实现。保持温度T不变,向一恒容密闭容器中充入4mol
 和8mol
和8mol  ,在该催化剂作用下发生反应,经5min达到平衡,测得
,在该催化剂作用下发生反应,经5min达到平衡,测得 (g)的物质的量为3mol,起始及达平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用
(g)的物质的量为3mol,起始及达平衡时容器的总压强分别为1.5akPa、akPa,则从开始到平衡用 分压表示的平均反应速率为
分压表示的平均反应速率为 (用含a的式子表示,下同,分压=总压×物质的量分数);反应ⅱ的压强平衡常数
(用含a的式子表示,下同,分压=总压×物质的量分数);反应ⅱ的压强平衡常数
 (
(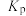 为用分压代替浓度计算的平衡常数)。
为用分压代替浓度计算的平衡常数)。(5)光催化
 制甲醇技术也是研究热点。铜基纳米光催化材料还原
制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理如图所示,光照时,低能价带失去电子并产生空穴(
的机理如图所示,光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。在低能价带上,
,具有强氧化性)。在低能价带上, 直接转化为
直接转化为 的电极反应式为
的电极反应式为
您最近一年使用:0次



