1 . 下列事实与水解反应无关 的是
| A.纯碱溶液去除油污的能力强弱:热纯碱液>冷纯碱液 |
B.配制 溶液:将 溶液:将 固体溶于浓盐酸,再稀释至所需浓度 固体溶于浓盐酸,再稀释至所需浓度 |
C.泡沫灭火器的工作原理: 溶液与 溶液与 溶液反应 溶液反应 |
D.除去工业废水中的 :向废水中加入 :向废水中加入 固体 固体 |
您最近一年使用:0次
2 . 下列装置及设计能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 |  | 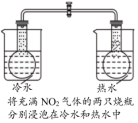 | 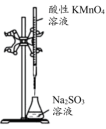 | 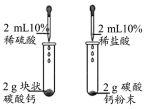 |
| 目的 | 证明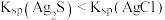 | 探究温度对化学平衡的影响 | 用酸性 溶液滴定 溶液滴定 溶液 溶液 | 探究反应物接触面积对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1)已知 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为___________ 。
(2)常温下,用 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡___________ (填“向左”、“向右”或“不”)移动。试计算该溶液中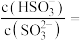
___________ (常温下 的电离平衡常数
的电离平衡常数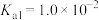 ,
, )。
)。
(3)保险粉样品中 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为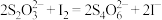 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
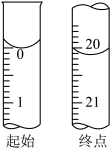
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是___________ 。滴定起始和终点的液面位置如图所示。则样品的纯度为___________ 。(设 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为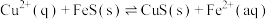 。下列有关叙述正确的是
。下列有关叙述正确的是___________ 。
a、
b、达到平衡时
c、该反应平衡常数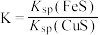
(1)已知
 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为(2)常温下,用
 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡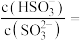
 的电离平衡常数
的电离平衡常数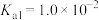 ,
, )。
)。(3)保险粉样品中
 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为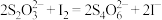 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为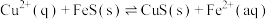 。下列有关叙述正确的是
。下列有关叙述正确的是a、

b、达到平衡时

c、该反应平衡常数
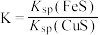
您最近一年使用:0次
解题方法
4 . 水溶液广泛存在于生命体及其赖以生存的环境中。弱电解质的电离平衡、盐类的水解平衡和难溶电解质的沉淀溶解平衡都与日常生活、工农业生产等息息相关。回答下列问题:
(1)25℃时,将 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液等体积混合,反应后溶液中
的氢氧化钠溶液等体积混合,反应后溶液中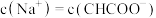 ,则a
,则a___________ 0.01(填“>”、“<”或“=”)。
(2)25℃时,某 溶液的
溶液的 。关于此溶液中的微粒浓度,下列说法正确的是
。关于此溶液中的微粒浓度,下列说法正确的是_______ 。
A.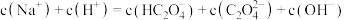
B.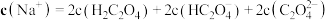
C.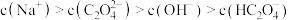
(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙 ,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为
,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为___________ 。
(4)25℃时,已知 的
的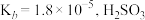 的
的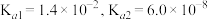 ,则
,则 被氨水捕获所得的
被氨水捕获所得的 溶液呈
溶液呈___________ (填“酸”、“碱”或“中”)性; 也可以被
也可以被 溶液捕获,所得溶液中
溶液捕获,所得溶液中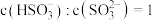 时,该溶液的
时,该溶液的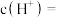
___________ 。
(5) 是水垢成分之一,室温下
是水垢成分之一,室温下 的
的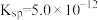 ,向
,向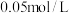 的
的 溶液中通入
溶液中通入 至刚好出现沉淀时,溶液的
至刚好出现沉淀时,溶液的 为
为___________ 。
(6)向 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中
___________ (填“增大”、“减小”或“不变”)。
(1)25℃时,将
 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液等体积混合,反应后溶液中
的氢氧化钠溶液等体积混合,反应后溶液中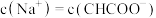 ,则a
,则a(2)25℃时,某
 溶液的
溶液的 。关于此溶液中的微粒浓度,下列说法正确的是
。关于此溶液中的微粒浓度,下列说法正确的是A.
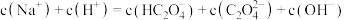
B.
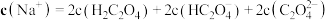
C.
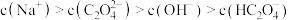
(3)人体内草酸累积过多容易导致结石,其主要成分是草酸钙
 ,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为
,草酸钻在水中的沉淀溶解平衡可用离子方程式表示为(4)25℃时,已知
 的
的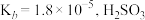 的
的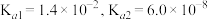 ,则
,则 被氨水捕获所得的
被氨水捕获所得的 溶液呈
溶液呈 也可以被
也可以被 溶液捕获,所得溶液中
溶液捕获,所得溶液中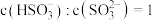 时,该溶液的
时,该溶液的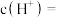
(5)
 是水垢成分之一,室温下
是水垢成分之一,室温下 的
的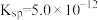 ,向
,向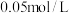 的
的 溶液中通入
溶液中通入 至刚好出现沉淀时,溶液的
至刚好出现沉淀时,溶液的 为
为(6)向
 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中
您最近一年使用:0次
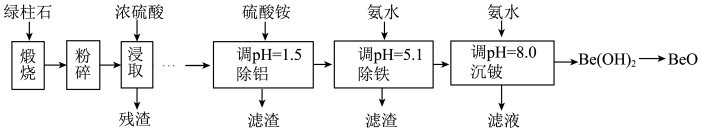
5 . 铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为(Be3Al2Si6O18,还含有一定量的FeO和Fe2O3)生产BeO的一种工艺流程如下。
回答问题:
(1)Be3Al2Si6O18中Be的化合价为______ 。Si原子价层电子排布式为_______ 。元素Al与Si中,第一电离能较大的是_______ ,氮原子和氧原子电负性较大的是______ 。
(2)浓硫酸浸取后残渣主要成分是_______ (填化学式)。
(3)该流程中能循环使用的物质是______ (填化学式)。
(4)无水BeCl2可用作聚合反应的催化剂。BeO、Cl2与足量C在600~800℃制备BeCl2的化学方程式为______ 。
(5)沉铍时,将pH从8.0提高到9.0,则铍的损失降低至原来的______ %。

回答问题:
(1)Be3Al2Si6O18中Be的化合价为
(2)浓硫酸浸取后残渣主要成分是
(3)该流程中能循环使用的物质是
(4)无水BeCl2可用作聚合反应的催化剂。BeO、Cl2与足量C在600~800℃制备BeCl2的化学方程式为
(5)沉铍时,将pH从8.0提高到9.0,则铍的损失降低至原来的
您最近一年使用:0次
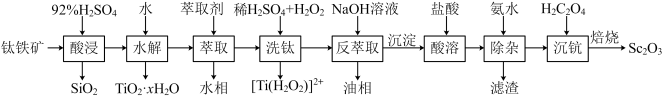
6 . 钪(Sc)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),还含有少量SiO2、Sc2O3等氧化物,从钛铁矿中提取Sc2O3的流程如下:
已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
③lg2=0.3,Ksp[Sc(OH)3]=1.25×10-33。回答下列问题:
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是___________ 。
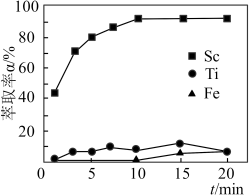
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________ min。
(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是___________ 。
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。

已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
| 离子 | Fe3+ | Fe2+ | TiO2+ |
| 沉淀完全的pH | 3.2 | 9.0 | 1.05 |
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为

(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
7 . 从某废液(含有Fe3+、Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得的纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如图:
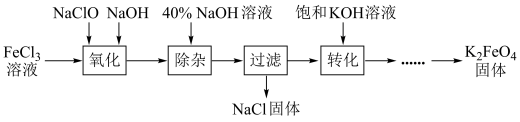
已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是_________ 和_________ 。
(2)检验废液中含有Fe2+选用的试剂是__________ (填化学式)。
(3)“氧化”过程反应的离子方程式为__________ 。
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用______ 溶解,然后______ ,过滤。
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
已知溶液中的某离子浓度小于1×10-5 mol/L时就认为该离子沉淀完全。加双氧水的目的是_________ ;若溶液中CuSO4的浓度为3.0mol/L,通过计算说明此方法可除去粗CuSO4·5H2O晶体中FeSO4·7H2O的理由:___________ 。

已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是
(2)检验废液中含有Fe2+选用的试剂是
(3)“氧化”过程反应的离子方程式为
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 3×10-20 |
您最近一年使用:0次
名校
解题方法
8 . 化学与生产、生活息息相关。下列说法正确的是
| A.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
| B.在铁制品上镀铜时,铁制品所在电极发生氧化反应 |
C.在去除锅炉水垢中的 时,通常先用碳酸钠溶液浸泡,再用酸去除 时,通常先用碳酸钠溶液浸泡,再用酸去除 |
| D.用氯气和氢氧化钠制取消毒液,运用了盐类水解的原理 |
您最近一年使用:0次
2024-01-26更新
|
88次组卷
|
2卷引用:湖南省衡阳市第八中学2023-2024学年高二上学期1月期末化学试题
名校
9 . 运用化学反应原理,研究硫、磷化合物的反应具有重要意义。
(1)已知H3PO2(次磷酸)的水溶液中存在H3PO2分子。H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为_____ ,该盐属于_____ (填“正盐”或“酸式盐”)。H3PO2易被氧化为H3PO4,已知常温下,H3PO4的电离常数为Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13,请利用以上数据计算推测Na2HPO4溶液呈_____ 性。
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_____ (填“向左”“向右”或“不”)移动。试计算该溶液中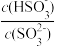 =
=_____ (常温下,H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(3)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq)。下列有关叙述正确的是
CuS(s)+Fe2+(aq)。下列有关叙述正确的是_____ 。
a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数K= 。
。
(1)已知H3PO2(次磷酸)的水溶液中存在H3PO2分子。H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡
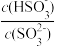 =
=(3)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为Cu2+(aq)+FeS(s)
 CuS(s)+Fe2+(aq)。下列有关叙述正确的是
CuS(s)+Fe2+(aq)。下列有关叙述正确的是a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数K=
 。
。
您最近一年使用:0次
2024-01-21更新
|
104次组卷
|
2卷引用:湖南省邵阳市新邵县2023-2024学年高二上学期期末考试化学试题
名校
解题方法
10 . 类比和推理是重要的学习方法。下列类比或推理合理的是
| 选项 | 已知 | 方法 | 结论 |
| A | 常温下,Kb(NH3·H2O)=1.8×10-5、Ka(HF)=6.3×10-4 | 推理 | NH4F溶液显酸性 |
| B | Ksp:Ag2CrO4<AgCl | 推理 | 溶解度:Ag2CrO4<AgCl |
| C | Fe+CuSO4(aq)=FeSO4+Cu | 类比 | 2Na+CuSO4(aq)=Na2SO4+Cu |
| D | 工业电解熔融氯化镁制镁 | 类比 | 工业电解熔融氯化铝制铝 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-18更新
|
74次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高二上学期1月期末化学试题



