名校
1 . 298k时,向20.0mL0.10mol/LH2A溶液中滴加0.10mol/LNaOH溶液,滴定曲线如图所示。下列说法正确的是( )
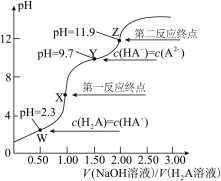
| A.该滴定过程应该选择石蕊试液作指示剂 |
| B.W点到X点发生的主要反应的离子方程式为H2A+2OH-=A2-+2H2O |
| C.Y点对应的溶液中c(Na+)+(H+)=c(OH—)+2c(A2-) |
D.反应H2A+A2- 2HA—的平衡常数K=1.0×107.4 2HA—的平衡常数K=1.0×107.4 |
您最近一年使用:0次
2019-09-03更新
|
386次组卷
|
5卷引用:湖南省长沙市周南教育集团2023-2024学年高二下学期入学考试化学试题
12-13高二上·吉林长春·期末
名校
解题方法
2 . 如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )


| A | B | C | D | |
| X/(mol/L) | 0.12 | 0.04 | 0.03 | 0.09 |
| Y/(mol/L) | 0.04 | 0.12 | 0.09 | 0.03 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-08-14更新
|
141次组卷
|
8卷引用:湖南省双峰县第一中学2018-2019学年高二上学期第一次月考化学试题
湖南省双峰县第一中学2018-2019学年高二上学期第一次月考化学试题(已下线)2011-2012学年吉林省长春二中高二上学期期末考试化学试卷(已下线)2010--2011学年四川省成都二十中高二上学期期中考试化学试卷2016届安徽省巢湖市无为一中高三上学期第一次月考化学试卷新疆巴州种畜场学校2019届高三下学期第二次模拟考试理科综合化学试题(已下线)上海市控江中学2015-2016学年高二上学期期末考试化学试题(已下线)10.3 酸碱中和滴定-2020-2021学年秋季班高二上学期化学教材知识点精讲练(沪科版)吉林省白山市抚松县第六中学2021-2022学年高三考前模拟化学试题
3 . NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
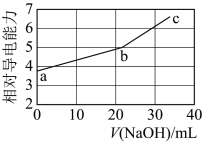

| A.混合溶液的导电能力与离子浓度和种类有关 |
| B.Na+与A2−的导电能力之和大于HA−的 |
| C.b点的混合溶液pH=7 |
| D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−) |
您最近一年使用:0次
2019-06-09更新
|
21039次组卷
|
67卷引用:湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题
湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题湖南省长沙市天心区雅礼中学2018-2019学年高二下学期期末考试化学试题湖南省长沙市雅礼中学2019-2020学年高二上学期期末考试化学试题湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题(已下线)专题8.1 弱电解质的电离平衡(讲)-《2020年高考一轮复习讲练测》2020届高考化学小题狂练(全国通用版)专练15 弱电解质的电离平衡和溶液酸碱性云南师范大学附属中学2019-2020学年高二上学期期中考试化学试题江苏省海安高级中学2019-2020学年高二12月月考化学试题福建省莆田第二十五中学2020届高三上学期期末考试化学试题专题2.3 水溶液中的离子平衡(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训辽宁省本溪市2019-2020学年高二下学期寒假验收考试化学试题江苏省南通市2020届高三第二次模拟考试(5月) 化学 试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题北京市海淀区育英学校2020届高三三模化学试题天津市第一中学2020届高三下学期第五次月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)3.3.2+影响盐类水解的主要因素和盐类水解的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 高考帮(已下线)第03章 水溶液中的离子反应与平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关第25讲 弱电解质的电离平衡(精讲)-2021年高考化学一轮复习讲练测(已下线)【浙江新东方】【2020】【高三上】【一模】【HD-LP416】【化学】(已下线)【浙江新东方】112(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷30 水的电离与溶液的酸碱性——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷33 粒子浓度大小比较——2021年高考化学一轮复习小题必刷(通用版本)福建省连城县第一中学2021届高三上学期第二次月考化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题重庆市育才中学2021届高三下学期入学考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)天津市南开中学2021届高三上学期第五次月考化学试卷(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)选择性必修1(SJ)专题3专题培优专练(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第6讲 离子平衡坐标图像-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)重庆育才中学2021-2022学年高二上学期第四次定时练习化学试题山西省太原市第五中学2021-2022学年高二上学期12月月考化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习湖北省沙市中学2021-2022学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)浙江省绍兴市柯桥区2022届高考及选考科目5月适应性考试化学试题(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)河北省秦皇岛市第一中学2021-2022学年高二下学期期末考试化学试题天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第46讲 弱电解质的电离平衡(已下线)题型134 导电能力与酸碱中和滴定图像广东省汕头市金山中学2022-2023学年高二下学期期中考试化学试题(已下线)专题16 水溶液中的离子平衡(已下线)T11-电解质溶液(已下线)第31讲盐类的水解2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷
名校
4 . 化学兴趣小组用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
①称量1.0 g样品溶于水,配成250mL溶液;
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2~3滴酚酞溶液;
③用0.1000 mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
(1)称量时,样品应放在________ 称量(选填字母序号)。
a.小烧杯中 b.洁净纸片上 c.托盘上
(2)如图是某次滴定时的滴定管中的液面,其读数为________ mL。

(3)判断滴定终点到达时的现象为_______________________________ 。
(4)若出现下列情况,测定结果偏高的是________ (选填字母序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)通过计算可知该烧碱样品的纯度为________ 。(杂质不与酸反应)。
①称量1.0 g样品溶于水,配成250mL溶液;
②用碱式滴定管准确量取25.00mL所配溶液于锥形瓶中,滴加2~3滴酚酞溶液;
③用0.1000 mol·L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
| 滴定次数 | 待测液体积/mL | 所消耗盐酸标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 1.50 | 21.40 |
| 2 | 25.00 | 2.50 | 22.60 |
| 3 | 25.00 | 0.60 | 23.20 |
a.小烧杯中 b.洁净纸片上 c.托盘上
(2)如图是某次滴定时的滴定管中的液面,其读数为

(3)判断滴定终点到达时的现象为
(4)若出现下列情况,测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)通过计算可知该烧碱样品的纯度为
您最近一年使用:0次
2019-02-02更新
|
225次组卷
|
2卷引用:湖南省湘潭市第一中学2020-2021学年高二下学期期中考试(水平测试)化学试卷
11-12高二上·湖南·期中
名校
解题方法
5 . 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视___________________ 。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______________ 为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为_________ mL,终点读数为_____________ mL;所用盐酸溶液的体积为______________ mL。

(4)某学生根据三次实验分别记录有关数据如下表:
请用上述数据列式计算该氢氧化钠溶液的物质的量浓度____________ 。
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为

(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请用上述数据列式计算该氢氧化钠溶液的物质的量浓度
您最近一年使用:0次
2019-01-30更新
|
505次组卷
|
10卷引用:2011-2012年湖南省师大附中高二上学期期中考试化学试卷
(已下线)2011-2012年湖南省师大附中高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市鱼台二中高二上学期期中考试化学试卷(已下线)同步君 选修4 第3章 第2节 中和滴定高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第一课时(中和滴定)贵州省荔波高级中学2019-2020学年高二上学期期末考试化学试题黑龙江省鹤岗市第一中学2021届高三上学期第三次模拟(12月)化学试题河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题福建省莆田第七中学2020-2021学年高二下学期期中考试化学(B卷)试题(已下线)3.2.4 酸碱中和滴定(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题
2019高二上·全国·专题练习
名校
解题方法
6 . 常温下,用0.100 0 mol·L−1的 NaOH溶液滴定20.00 mL 0.1000 mol·L−1的某酸HA溶液所得滴定曲线如图所示。
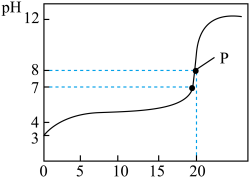
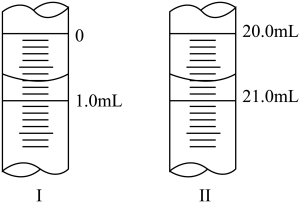
回答下列问题:
(1)该酸为_______ 酸(填“强”或者“弱”),你的判断理由是_________________ 。
(2)点P时溶液中的 c(HA)=________ mol·L−1。
(3)①该中和滴定应选择________ 做指示剂,滴定终点时的现象是________________________ 。
②滴定起始和终点的液面位置如图2所示,则消耗NaOH溶液的体积为_____ mL。
③下列操作使滴定结果偏高的是________ 。
a.滴定前,碱式滴定管未用NaOH溶液润洗
b.锥形瓶的待测液中加少量水稀释
c.碱式滴定管滴定前有气泡,滴定后无气泡
d.读数时,滴定前仰视,滴定后俯视


回答下列问题:
(1)该酸为
(2)点P时溶液中的 c(HA)=
(3)①该中和滴定应选择
| 指示剂变色范围(pH) | 甲基橙(3.1~4.4) | 石蕊(5~8) | 酚酞(8.2~10.0) | ||||||
| 颜色 | <3.1 | 3.1~4.4 | >4.4 | <5 | 5~8 | >8 | <8.2 | 8.2~10.0 | >10.0 |
| 红 | 橙 | 黄 | 红 | 紫 | 蓝 | 无色 | 粉红 | 红 | |
③下列操作使滴定结果偏高的是
a.滴定前,碱式滴定管未用NaOH溶液润洗
b.锥形瓶的待测液中加少量水稀释
c.碱式滴定管滴定前有气泡,滴定后无气泡
d.读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
名校
7 . 常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如下图所示。下列叙述正确的是
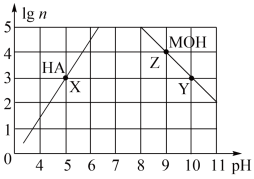

| A.MOH为弱碱,HA为强酸 |
| B.水的电离程度:X=Z>Y |
| C.若升高温度,Y、Z点对应溶液的pH均不变 |
| D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性 |
您最近一年使用:0次
2018-04-14更新
|
1514次组卷
|
15卷引用:湖南省怀化市沅陵县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省怀化市沅陵县第一中学2021-2022学年高三下学期期中考试化学试题宁夏银川市2018届高三4月高中教学质量检测理科综合化学试题【百强校】天津市静海区第一中学2020届高三下学期第七周周末训练化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题广东省佛山市第一中学2021-2022学年高二上学期期中考试化学(选考) 试题新疆乌鲁木齐市第八中学2021-2022学年高二上学期第三次月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(讲)广东省广州市第二中学2023-2024学年高二上学期期中考试化学试题云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题
名校
8 . 25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误 的是


| A.a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.b点处:c(CH3COOH)+c(H+ )=c(OH-) |
| C.c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+) |
| D.NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-) |
您最近一年使用:0次
2018-03-12更新
|
326次组卷
|
5卷引用:湖南省长沙市长郡中学2017-2018学年高二下学期开学考试化学试题
湖南省长沙市长郡中学2017-2018学年高二下学期开学考试化学试题河南省安阳市第二中学2018-2019学年高二上学期期中考试化学试题上海市金山中学2016届高三上学期开学化学试题(已下线)上海市十二校2012-2013学年高三上学期联考化学试题(已下线)上海市十校2012-2013学年高三上学期联考化学试题
9 . 用0.1 mol·L−1的盐酸滴定20 mL约0.1 mol·L−1氨水,滴定曲线如图所示,下列说法正确的是


| A.a点溶液中:c(H+)=c(OH−)+c(NH3·H2O) |
| B.滴定过程中,当溶液的pH=7时,两者恰好中和 |
| C.用酚酞作指示剂比用甲基橙作指示剂,滴定误差更小 |
| D.当滴入盐酸为30 mL时,溶液中:c(NH4+)+c(H+)<c(OH−)+c(Cl−) |
您最近一年使用:0次
2018-01-27更新
|
547次组卷
|
3卷引用:湖南省怀化市2018届高三上学期期末教育质量监测化学试题
名校
10 . 某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用0.14mol•L-1NaOH标准溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下
滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ( )→( )→D→( ) →A→( ) →( )__________
②配制准确浓度的稀H2SO4溶液,必须使用的主要容器是______
③观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值______ (选填“偏高”“偏低”或“无影响”)
④计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)_____
⑤已知:含CH3COOH 1mol的醋酸溶液与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;含HCl1mol 的盐酸与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则CH3COOH在水溶液中电离的ΔH等于______
(1)该学生用0.14mol•L-1NaOH标准溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下
滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ( )→( )→D→( ) →A→( ) →( )
②配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
③观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值
④计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)
⑤已知:含CH3COOH 1mol的醋酸溶液与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;含HCl1mol 的盐酸与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则CH3COOH在水溶液中电离的ΔH等于
您最近一年使用:0次
2017-12-13更新
|
410次组卷
|
2卷引用:湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题



