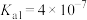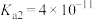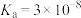1 . 基于虚拟软件可测定 盐酸与
盐酸与 碳酸钠溶液相互滴定的图像,下图为反应过程中
碳酸钠溶液相互滴定的图像,下图为反应过程中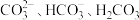 微粒浓度以及
微粒浓度以及 随溶液总体积变化曲线(已知草酸酸性大于碳酸)。下列说法正确的是
随溶液总体积变化曲线(已知草酸酸性大于碳酸)。下列说法正确的是
 盐酸与
盐酸与 碳酸钠溶液相互滴定的图像,下图为反应过程中
碳酸钠溶液相互滴定的图像,下图为反应过程中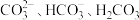 微粒浓度以及
微粒浓度以及 随溶液总体积变化曲线(已知草酸酸性大于碳酸)。下列说法正确的是
随溶液总体积变化曲线(已知草酸酸性大于碳酸)。下列说法正确的是
| A.上图是碳酸钠溶液滴定盐酸的曲线变化图 |
B.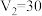 |
C.碳酸的电离平衡常数 数量级是 数量级是 |
D.若用同浓度 溶液代替 溶液代替 溶液,A点上移 溶液,A点上移 |
您最近一年使用:0次
名校
2 . 下列方案设计、现象和结论都正确的是
| 编号 | 实验目的 | 方案设计 | 现象与结论 |
| A | 比较 与 与 的酸性强弱 的酸性强弱 | 分别测 、 、 两饱和溶液的 两饱和溶液的 |  溶液 溶液 小,则酸性 小,则酸性 |
| B | 验证 溶液中存在水解平衡 溶液中存在水解平衡 | 往含有酚酞 溶液中加入少量 溶液中加入少量 晶体 晶体 | 溶液红色变浅,则 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 比较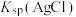 与 与 的大小 的大小 | 向足量 溶液中先加入少量 溶液中先加入少量 溶液,再加入 溶液,再加入 溶液 溶液 | 先生成白色沉淀,再生成淡黄色沉淀,则 |
| D | 探究压强对化学平衡的影响 | 快速压缩装有 、 、 平衡混合气体的针筒活塞 平衡混合气体的针筒活塞 | 平衡后气体颜色变深,则增大压强,平衡向生成 的方向移动 的方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 常温下,等浓度的氨水和醋酸溶液互相滴定过程中,溶液中pH与pX[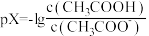 或
或 ]的关系如图所示。下列说法错误的是
]的关系如图所示。下列说法错误的是
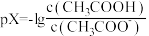 或
或 ]的关系如图所示。下列说法错误的是
]的关系如图所示。下列说法错误的是
A.常温下, |
B.水的电离程度: |
| C.曲线Ⅱ代表NH3•H2O溶液滴定CH3COOH溶液 |
D.g点 |
您最近一年使用:0次
2024-04-11更新
|
448次组卷
|
6卷引用:四川省雅安市2023-2024学年高三下学期4月月考理综试题-高中化学
名校
4 . 电离平衡常数和电离度(电离度是指已电离的电解质分子数占原来总分子数的百分比)均可衡量弱电解质的电离,下表是常温下几种弱酸的电离平衡常数( )和弱碱的电离平衡常数(
)和弱碱的电离平衡常数( ),回答下列问题∶
),回答下列问题∶
(1) 的水溶液呈
的水溶液呈______ (填“酸性”、“中性”或“碱性”),理由是______ 。
(2)现测得溶解了 的某盐酸的pH=4,则该溶液中
的某盐酸的pH=4,则该溶液中 的电离度约为
的电离度约为______ 。
(3)常温下,浓度相同的三种溶液NaF、 、
、 ,pH由大到小的顺序是
,pH由大到小的顺序是______ 。
(4)将过量 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为______ 。
 )和弱碱的电离平衡常数(
)和弱碱的电离平衡常数( ),回答下列问题∶
),回答下列问题∶| 弱酸或弱碱 | HF |  |  |  |  |
| 电离平衡常数 | 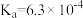 |  | 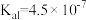 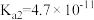 |  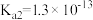 | 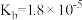 |
 的水溶液呈
的水溶液呈(2)现测得溶解了
 的某盐酸的pH=4,则该溶液中
的某盐酸的pH=4,则该溶液中 的电离度约为
的电离度约为(3)常温下,浓度相同的三种溶液NaF、
 、
、 ,pH由大到小的顺序是
,pH由大到小的顺序是(4)将过量
 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 羟胺(NH2OH)易溶于水,可看成是NH3中的H被—OH取代的产物,其水溶液是比肼还弱的碱性溶液。下列有关说法不正确的是
| A.羟胺(NH2OH)易溶于水,是因为H2O与NH2OH可形成分子间氢键 |
| B.NH2OH的水溶液显碱性是因为NH2OH溶于水时可电离产生OH- |
C.NH2OH与NH 中 中 的键角不相同 的键角不相同 |
D.NH 与NH2OH的中心 与NH2OH的中心 原子的价层电子对数相同 原子的价层电子对数相同 |
您最近一年使用:0次
名校
6 . 已知常温下部分弱电解质的电离平衡常数如下表所示:
(1)25℃时,pH=10的NaClO溶液中各离子浓度的大小关系为_______ (离子浓度如Na+的浓度以c(Na+)表示,下同)。向NaClO溶液中通入少量CO2,反应的离子方程式为_______ 。
(2)NH4Cl溶液中的电荷守恒关系式为_______ 。
(3)NH4F溶液显_______ (填酸性、碱性或中性)。
(4)物质的量浓度相同的NaNO2、NaClO两种溶液,pH较大的是_______ 。
(5)泡沫灭火器利用了硫酸铝溶液和碳酸氢钠溶液的反应,用离子方程式表示原理_______ 。
(6)常温下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中 和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。_______ (填“A”或“B”)。
②当加入盐酸体积为50mL时,溶液中c( )∶c(NH3·H2O)=
)∶c(NH3·H2O)=_______ 。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O | HNO2 |
| 电离常数 | 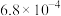 | 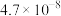 |  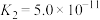 |  |  |
(1)25℃时,pH=10的NaClO溶液中各离子浓度的大小关系为
(2)NH4Cl溶液中的电荷守恒关系式为
(3)NH4F溶液显
(4)物质的量浓度相同的NaNO2、NaClO两种溶液,pH较大的是
(5)泡沫灭火器利用了硫酸铝溶液和碳酸氢钠溶液的反应,用离子方程式表示原理
(6)常温下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中
 和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。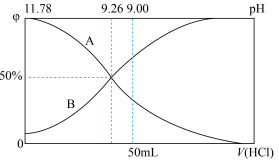
②当加入盐酸体积为50mL时,溶液中c(
 )∶c(NH3·H2O)=
)∶c(NH3·H2O)=
您最近一年使用:0次
名校
7 . 电解质水溶液广泛存在于生命体及其赖以生存的环境中,电离平衡、水解平衡和沉淀溶解平衡都与生活、生产等息息相关。回答下问题。
(1)室温,体积均为10mL且等pH的CH3COOH溶液与一元酸HX,分别加水稀释至100mL,溶液pH变化如图,则Ka(HX)______ Ka(CH3COOH) (填“>”、“<”或“=”)。溶液稀释后,HX溶液中水电离的c(H+)_____ CH3COOH溶液水电离的c(H+) (填“>”、“<”或“=”)。 _____ 0.01mol/L (填“>”、“<”或“=”)。
(3)在氨水和碳酸氢钠溶液中分别滴入酚酞,溶液均呈现红色,请用相关理论及离子程式解释其原因。______________ 。
(4)浓度均为0.5mol/L的Na2CO3溶液和NaHCO3溶液,以下关系式中,Na2CO3 溶液和NaHCO3溶液均满足的是______。
(5)在Na2CO3和NaHCO3的混合溶液中,一定可以大量共存的离子是______。
(6)等浓度的NH4Cl、(NH4)2CO3和NH4HCO3溶液中,c( )最大的溶液是
)最大的溶液是____ (填化学式)。
(7)含两种等物质的量的溶质的溶液,溶液中只存在OH-、H+、 、Cl-四种离子,且c(
、Cl-四种离子,且c( )>c(Cl-)>c(OH-)>c(H+),则这两种溶质分别是
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质分别是________ 。
(8)我国饮用水卫生标准规定:生活用水中镉(Cd2+)的排放量不超过0.005mg/L。工业上处理含镉(Cd2+)废水常用化学沉淀法。常温下Ksp(Cd(OH)2)=3.2×10-14,若使用生石灰调节溶液pH值,以Cd(OH)2沉淀析出达到Cd2+可排放标准,则溶液pH值至少控制在_____ (保留小数点后一位) (已知:Cd相对原子质量为112.4)
(1)室温,体积均为10mL且等pH的CH3COOH溶液与一元酸HX,分别加水稀释至100mL,溶液pH变化如图,则Ka(HX)

(3)在氨水和碳酸氢钠溶液中分别滴入酚酞,溶液均呈现红色,请用相关理论及离子程式解释其原因。
(4)浓度均为0.5mol/L的Na2CO3溶液和NaHCO3溶液,以下关系式中,Na2CO3 溶液和NaHCO3溶液均满足的是______。
A.c(Na+)+c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
B.c( )+ 2c(H2CO3)+ c(H+)=c(OH-) )+ 2c(H2CO3)+ c(H+)=c(OH-) |
C.c( )+c( )+c( )+c(H2CO3)=0.5 mol/L )+c(H2CO3)=0.5 mol/L |
D.c(Na+)>c( )>c(OH-)> c( )>c(OH-)> c( )>c(H+) )>c(H+) |
(5)在Na2CO3和NaHCO3的混合溶液中,一定可以大量共存的离子是______。
| A.OH- | B. | C.H+ | D.Al3+ |
(6)等浓度的NH4Cl、(NH4)2CO3和NH4HCO3溶液中,c(
 )最大的溶液是
)最大的溶液是(7)含两种等物质的量的溶质的溶液,溶液中只存在OH-、H+、
 、Cl-四种离子,且c(
、Cl-四种离子,且c( )>c(Cl-)>c(OH-)>c(H+),则这两种溶质分别是
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质分别是(8)我国饮用水卫生标准规定:生活用水中镉(Cd2+)的排放量不超过0.005mg/L。工业上处理含镉(Cd2+)废水常用化学沉淀法。常温下Ksp(Cd(OH)2)=3.2×10-14,若使用生石灰调节溶液pH值,以Cd(OH)2沉淀析出达到Cd2+可排放标准,则溶液pH值至少控制在
您最近一年使用:0次
名校
8 . 常温下,在 ,
, 和氨水的浊液中滴加醋酸,混合物中pX[
和氨水的浊液中滴加醋酸,混合物中pX[ ,
,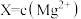 、
、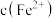 、
、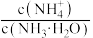 或
或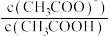 ]或与pH的关系如图所示。下列叙述正确的是
]或与pH的关系如图所示。下列叙述正确的是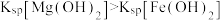 。
。
 ,
, 和氨水的浊液中滴加醋酸,混合物中pX[
和氨水的浊液中滴加醋酸,混合物中pX[ ,
,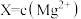 、
、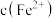 、
、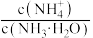 或
或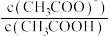 ]或与pH的关系如图所示。下列叙述正确的是
]或与pH的关系如图所示。下列叙述正确的是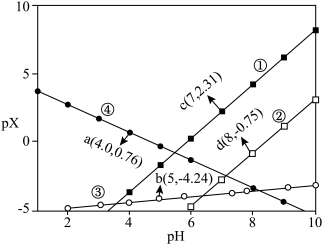
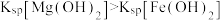 。
。A.①代表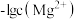 与pH的关系 与pH的关系 |
B.0.1 mol⋅L  中性溶液中 中性溶液中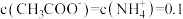 mol⋅L mol⋅L |
C.在 和 和 共同的浊液中: 共同的浊液中: |
D. 的平衡常数K为 的平衡常数K为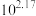 |
您最近一年使用:0次
2024-04-10更新
|
632次组卷
|
6卷引用:河北省部分学校2023-2024学年高三下学期4月联考化学试题
9 . 回答下列问题
(1)现有a. b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
①相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a_________ b。
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_________ b。
将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a_________ b。
(2)常温下,根据表中的几种物质的电离平衡常数回答下列问题:
①下列反应不能发生的是_________ (填序号)。
a.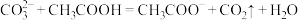
b.
c.
d.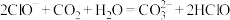
②反应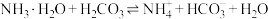 的平衡常数K=
的平衡常数K=_________ 。
(3)常温下,浓度均为0.1 的下列五种钠盐溶液的pH如下表:
的下列五种钠盐溶液的pH如下表:
①上述盐溶液中的阴离子,结合 能力最强的是
能力最强的是 _________ 。
②根据表中数据,浓度均为0.01 的下列四种酸的溶液分别稀释100倍,pH变化最大的是
的下列四种酸的溶液分别稀释100倍,pH变化最大的是_________ (填编号)。
A.HCN B.HClO C. D.
D.
(4)①已知t℃时,0.01 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中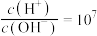 。该温度下,0.1
。该温度下,0.1 HA溶液中水电离出的
HA溶液中水电离出的
_________ 。
②25℃时,将体积 、pH=a的某一元强碱与体积为
、pH=a的某一元强碱与体积为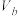 、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
_________ 。
③25℃时,pH=5的醋酸和pH=5的 溶液中由水电离出的
溶液中由水电离出的 浓度之比为
浓度之比为_________ 。
(1)现有a.
 b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。①相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a
将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a
(2)常温下,根据表中的几种物质的电离平衡常数回答下列问题:
弱酸 |
|
|
| HClO |
电离平衡常数 |
|
|
|
|
a.
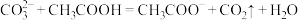
b.

c.

d.
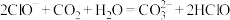
②反应
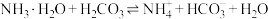 的平衡常数K=
的平衡常数K=(3)常温下,浓度均为0.1
 的下列五种钠盐溶液的pH如下表:
的下列五种钠盐溶液的pH如下表:溶质 |
|
|
| NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
 能力最强的是
能力最强的是 ②根据表中数据,浓度均为0.01
 的下列四种酸的溶液分别稀释100倍,pH变化最大的是
的下列四种酸的溶液分别稀释100倍,pH变化最大的是A.HCN B.HClO C.
 D.
D.
(4)①已知t℃时,0.01
 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中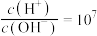 。该温度下,0.1
。该温度下,0.1 HA溶液中水电离出的
HA溶液中水电离出的
②25℃时,将体积
 、pH=a的某一元强碱与体积为
、pH=a的某一元强碱与体积为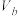 、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
③25℃时,pH=5的醋酸和pH=5的
 溶液中由水电离出的
溶液中由水电离出的 浓度之比为
浓度之比为
您最近一年使用:0次
名校
10 . 下列关于电解质溶液归纳总结正确的是
①将等浓度的硫酸和醋酸均升高相同温度(不考虑醋酸的挥发)二者pH均增大
②t℃时,pH=6的溶液中,
③将KCl溶液从常温加热到80℃,溶液的pH变小,但仍然呈中性
④常温下,甲、乙都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙溶液等体积混合,混合液的pH可能等于7
⑤常温下,由水电离出的 ,则该溶液可能是稀盐酸
,则该溶液可能是稀盐酸
⑥用湿润的pH试纸分别测量 和
和 的pH值,
的pH值, 的误差大
的误差大
⑦用pH试纸测量NaClO溶液的pH值为11
⑧常温下pH=10的某碱溶液,取1mL稀释到100mL,稀释后pH为a,则a≥12
⑨某温度下纯水中 ,则该温度下0.1mol/L的盐酸的pH=1
,则该温度下0.1mol/L的盐酸的pH=1
①将等浓度的硫酸和醋酸均升高相同温度(不考虑醋酸的挥发)二者pH均增大
②t℃时,pH=6的溶液中,

③将KCl溶液从常温加热到80℃,溶液的pH变小,但仍然呈中性
④常温下,甲、乙都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙溶液等体积混合,混合液的pH可能等于7
⑤常温下,由水电离出的
 ,则该溶液可能是稀盐酸
,则该溶液可能是稀盐酸⑥用湿润的pH试纸分别测量
 和
和 的pH值,
的pH值, 的误差大
的误差大⑦用pH试纸测量NaClO溶液的pH值为11
⑧常温下pH=10的某碱溶液,取1mL稀释到100mL,稀释后pH为a,则a≥12
⑨某温度下纯水中
 ,则该温度下0.1mol/L的盐酸的pH=1
,则该温度下0.1mol/L的盐酸的pH=1| A.③④⑤⑨ | B.①②④⑧ | C.③⑤⑥⑦ | D.④⑥⑧⑨ |
您最近一年使用:0次