名校
1 . 乙二胺四乙酸(通常用 表示)简称EDTA,因能与众多金属离子络合而在化学分析与测定中有广泛应用,其结构简式为
表示)简称EDTA,因能与众多金属离子络合而在化学分析与测定中有广泛应用,其结构简式为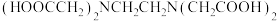 ,EDTA在水溶液中总是以
,EDTA在水溶液中总是以 七种形式存在,常温下其分布系数
七种形式存在,常温下其分布系数 与溶液
与溶液 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 表示)简称EDTA,因能与众多金属离子络合而在化学分析与测定中有广泛应用,其结构简式为
表示)简称EDTA,因能与众多金属离子络合而在化学分析与测定中有广泛应用,其结构简式为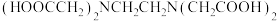 ,EDTA在水溶液中总是以
,EDTA在水溶液中总是以 七种形式存在,常温下其分布系数
七种形式存在,常温下其分布系数 与溶液
与溶液 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.EDTA既能与酸反应又能与碱反应,曲线a代表 |
B.常温下,电离常数 |
C. 时,溶液中 时,溶液中 |
D.常温下,溶液中 |
您最近一年使用:0次
名校
解题方法
2 . 回收利用含硫烟气有利于节约资源、保护环境。
I.含H2S的烟气回收
(1)将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(S8)。该工艺中涉及反应如下:
反应1: ;
;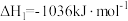
反应2: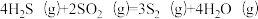 ;
;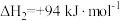
反应3: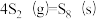 ;
;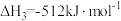
①反应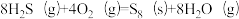 的△H=
的△H=_______ kJ∙mol-1。
②相同条件下需控制反应1与反应2中的烟气体积比为1:2的原因是_______ 。
Ⅱ.含SO2的烟气回收
(2)以FeS2/Al2O3为催化剂,用H2还原SO2制S。
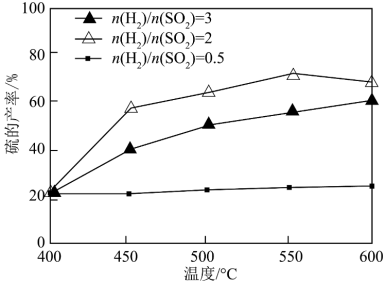
其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,n(H2)/n(SO2)=3时硫的产率比n(H2)/n(SO2)=2时小的原因可能是_______ 。
(3)以V2O5/炭基材料为催化剂,SO2在炭表面被氧气催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫涉及反应: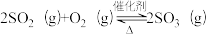 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是_______ (填字母序号)。
a.通入过量空气,可提高SO2的平衡转化率
b.当n(SO2):n(SO3)=l:1时,可判断反应达到平衡
c.使SO3液化从平衡体系中分离,能加快正反应速率,增大SO2转化率
②450℃、在V2O5催化下,SO2和O2的反应过程是按照如下两步完成的:
反应I:_______(快反应)
反应Ⅱ: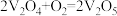 (慢反应)
(慢反应)
请补充上述反应的化学方程式_______ ,决定总反应速率快慢的是反应_______ (填“I”或“Ⅱ”)。
Ⅲ.工业上可采取多种方法减少SO2的排放,回答下列方法中的问题。
(4)方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液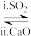 Na2SO3溶液
Na2SO3溶液
①写出过程i的离子方程式:_______ 。
②CaO在水中存在如下转化: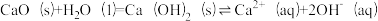
从平衡移动的角度,简述过程i中NaOH再生的原理:_______ 。
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的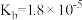 ,H2SO3的
,H2SO3的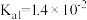 ,
,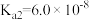 。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=
。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=_______ mol∙L-1。将SO2通入该氨水中,当c(OH-)降至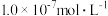 时,溶液中的
时,溶液中的
_______ 。
I.含H2S的烟气回收
(1)将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(S8)。该工艺中涉及反应如下:
反应1:
 ;
;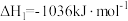
反应2:
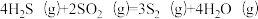 ;
;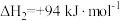
反应3:
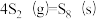 ;
;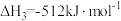
①反应
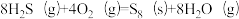 的△H=
的△H=②相同条件下需控制反应1与反应2中的烟气体积比为1:2的原因是
Ⅱ.含SO2的烟气回收
(2)以FeS2/Al2O3为催化剂,用H2还原SO2制S。
其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,n(H2)/n(SO2)=3时硫的产率比n(H2)/n(SO2)=2时小的原因可能是

(3)以V2O5/炭基材料为催化剂,SO2在炭表面被氧气催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫涉及反应:
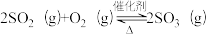 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是a.通入过量空气,可提高SO2的平衡转化率
b.当n(SO2):n(SO3)=l:1时,可判断反应达到平衡
c.使SO3液化从平衡体系中分离,能加快正反应速率,增大SO2转化率
②450℃、在V2O5催化下,SO2和O2的反应过程是按照如下两步完成的:
反应I:_______(快反应)
反应Ⅱ:
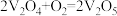 (慢反应)
(慢反应)请补充上述反应的化学方程式
Ⅲ.工业上可采取多种方法减少SO2的排放,回答下列方法中的问题。
(4)方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生NaOH溶液
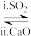 Na2SO3溶液
Na2SO3溶液①写出过程i的离子方程式:
②CaO在水中存在如下转化:
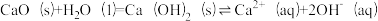
从平衡移动的角度,简述过程i中NaOH再生的原理:
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的
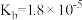 ,H2SO3的
,H2SO3的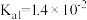 ,
,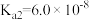 。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=
。若氨水的浓度为2.0mol∙L-1,溶液中的c(OH-)=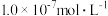 时,溶液中的
时,溶液中的
您最近一年使用:0次
3 . 已知:室温下, 、
、 ,通过下列实验探究含硫化合物的性质。
,通过下列实验探究含硫化合物的性质。
下列有关说法正确的是
 、
、 ,通过下列实验探究含硫化合物的性质。
,通过下列实验探究含硫化合物的性质。| 实验 | 实验操作和现象 |
| 1 | 测得0.1mol/L NaHS溶液的pH>7 |
| 2 | 将H2S通入新制的氯水中,氯水褪色 |
| 3 | 向0.1mol/L NaHS溶液中滴入0.1mol/L AgNO3溶液,有黑色沉淀生成 |
| 4 | 将过量的H2S通入0.1mol/L NaOH溶液中 |
A.实验1可得出: |
B.实验2说明 具有漂白性 具有漂白性 |
C.实验3发生反应的离子方程式为: |
D.实验4的溶液中存在: |
您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的是
A.25℃时,0.1 的醋酸溶液加水稀释,所有离子的浓度均减小 的醋酸溶液加水稀释,所有离子的浓度均减小 |
B.保持温度不变,向稀氨水中缓慢通入 ,溶液中 ,溶液中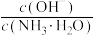 的值减少 的值减少 |
C.反应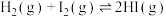 达平衡时,将容积缩小一半,混合气体颜色不变 达平衡时,将容积缩小一半,混合气体颜色不变 |
D.反应 在一定条件下能自发进行,该反应一定为放热反应 在一定条件下能自发进行,该反应一定为放热反应 |
您最近一年使用:0次
名校
解题方法
5 . 已知如下四种物质① ②
② ③NaOH④
③NaOH④
1.写出①的电离方程式_____ 。
2.向②的溶液中滴加几滴浓盐酸,平衡_____ 移动(填“正向”、“逆向”或“不移动”),平衡时溶液中
_____ (填“增大”、“减小”或者“不变”),
_____ (填“增大”、“减小”或者“不变”)。
3.将 的①溶液和
的①溶液和 的③溶液等体积混合后得到的溶液中主要溶质是
的③溶液等体积混合后得到的溶液中主要溶质是_____ (填化学式),该溶液显酸性,原因是_____ (请用文字结合该溶液中两个相关平衡方程式加以说明)。
4.将标准状况下2.24L④缓慢通入 的③的溶液中,气体被充分吸收,得到碳酸钠与碳酸氢钠物质的量之比为
的③的溶液中,气体被充分吸收,得到碳酸钠与碳酸氢钠物质的量之比为_____ ,该溶液中各离子浓度大小关系_____ 。
5.将足量④缓慢通入 的③的溶液中,充分反应后所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,充分反应后所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度_____ 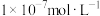 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH_____ (填“增大”、“减小”、或“不变”)。
 ②
② ③NaOH④
③NaOH④
1.写出①的电离方程式
2.向②的溶液中滴加几滴浓盐酸,平衡


3.将
 的①溶液和
的①溶液和 的③溶液等体积混合后得到的溶液中主要溶质是
的③溶液等体积混合后得到的溶液中主要溶质是4.将标准状况下2.24L④缓慢通入
 的③的溶液中,气体被充分吸收,得到碳酸钠与碳酸氢钠物质的量之比为
的③的溶液中,气体被充分吸收,得到碳酸钠与碳酸氢钠物质的量之比为5.将足量④缓慢通入
 的③的溶液中,充分反应后所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,充分反应后所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度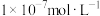 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH
您最近一年使用:0次
名校
6 . 25℃时部分弱酸的电离平衡常数如下表:
1.室温下① ②
② ③
③ ④
④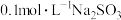 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)_____ 。
2.下列离子方程式书写正确的是
| 弱酸 |  |  |  |  |
| 电离平衡常数 |  | 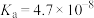 |   | 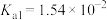  |
 ②
② ③
③ ④
④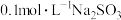 ,溶液的pH由大到小的关系为(填序号)
,溶液的pH由大到小的关系为(填序号)2.下列离子方程式书写正确的是
A.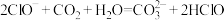 |
B. |
C. |
D. |
您最近一年使用:0次
名校
7 . 下列溶液导电能力最强的是
A.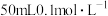 的硫酸钠溶液 的硫酸钠溶液 |
B. 的氯化钠溶液 的氯化钠溶液 |
C.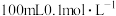 的醋酸溶液 的醋酸溶液 |
D.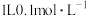 的盐酸溶液 的盐酸溶液 |
您最近一年使用:0次
名校
8 . 醋酸的下列性质中,可以证明它是弱电解质的是
①醋酸可以使紫色石蕊溶液变红色
② 的醋酸溶液中:pH=2
的醋酸溶液中:pH=2
③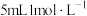 的醋酸溶液恰好与
的醋酸溶液恰好与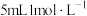 的NaOH溶液完全反应
的NaOH溶液完全反应
④在相同条件下,同物质的量浓度的醋酸溶液的导电性比盐酸弱
①醋酸可以使紫色石蕊溶液变红色
②
 的醋酸溶液中:pH=2
的醋酸溶液中:pH=2③
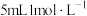 的醋酸溶液恰好与
的醋酸溶液恰好与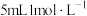 的NaOH溶液完全反应
的NaOH溶液完全反应④在相同条件下,同物质的量浓度的醋酸溶液的导电性比盐酸弱
| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
名校
解题方法
9 . 组氨酸( )能溶于水,在医药上用于治疗胃溃疡、贫血、过敏症等。将组氨酸简写成
)能溶于水,在医药上用于治疗胃溃疡、贫血、过敏症等。将组氨酸简写成 ,向组氨酸盐(H3ACl2)溶液中逐滴加入等浓度
,向组氨酸盐(H3ACl2)溶液中逐滴加入等浓度 溶液,溶液的
溶液,溶液的 随碱液量有如图所示变化,已知pK=-lgK(K为
随碱液量有如图所示变化,已知pK=-lgK(K为 的电离平衡常数)。下列说法
的电离平衡常数)。下列说法

A. 时, 时, |
B. 时, 时, |
C. |
D.组氨酸盐水溶液中: |
您最近一年使用:0次
2024-04-08更新
|
228次组卷
|
2卷引用:河北省沧州市沧县中学2023-2024学年高三下学期3月月考化学试题
10 . 联氨(又称肼,N2H4无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子是___________ 分子(填“极性”或“非极性”),其中氮的杂化方式为___________ 。
(2)①2O2(g)+N2(g)=N2O4(1) H1
H1
②N2(g)+2H2(g)=N2H4(1) H2
H2
③O2(g)+2H2(g)=2H2O(g) H3
H3
④2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mo1
上述反应热效应之间的关系式为△H4=___________ ,联氨和N2O4可作为火箭推进剂的主要原因为___________ 。
(3)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________ (已知:N2H4+H+
 的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为___________ 。
(4)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生﹐发生的化学方程式为___________ 。联氨可用于处理高压锅炉水中的氧。防止锅炉被腐蚀。理论上2kg的联氨可除去水中溶解的O2___________ kg。
(1)联氨分子是
(2)①2O2(g)+N2(g)=N2O4(1)
 H1
H1②N2(g)+2H2(g)=N2H4(1)
 H2
H2③O2(g)+2H2(g)=2H2O(g)
 H3
H3④2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mo1
上述反应热效应之间的关系式为△H4=
(3)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为

 的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为(4)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生﹐发生的化学方程式为
您最近一年使用:0次



