9-10高一下·广东佛山·期末
解题方法
1 . 填写下列空白:
(1)表示含有17个质子、20个中子的原子的化学符号是___________________ 。
(2)第三周期0族元素的原子结构示意图为_______________ 。
(3)周期表中被称为第Ⅷ族的元素位于第_____________________ 纵行。
(4)周期表中最活泼的非金属元素位于第__________ 周期、第_________ 族。
(5)所含元素超过18种的周期是第__________ 、_________ 周期。
(1)表示含有17个质子、20个中子的原子的化学符号是
(2)第三周期0族元素的原子结构示意图为
(3)周期表中被称为第Ⅷ族的元素位于第
(4)周期表中最活泼的非金属元素位于第
(5)所含元素超过18种的周期是第
您最近一年使用:0次
9-10高一下·广东·期末
2 . 元素在周期表中的位置,反映了元素的原子结构和元素性质。下图是元素周期表的一部分。
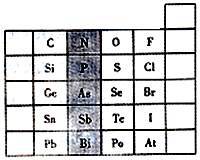
(1)阴影部分中元素N在元素周期表中的位置为第___________ 周期________ 族,其单质分子中含有的共用电子对数目为__________ 对。
(2)根据元素周期律,请你预测H3AsO4、H3PO4的酸性强弱:H3AsO4_______ H3PO4(填“>”、“<”或“=”)。
(3)在一定条件下,S、Se都能与H2反应,根据元素周期律判断,Se与H2反应比S与H2的反应_____ 。(填“更难”或“更易”)

(1)阴影部分中元素N在元素周期表中的位置为第
(2)根据元素周期律,请你预测H3AsO4、H3PO4的酸性强弱:H3AsO4
(3)在一定条件下,S、Se都能与H2反应,根据元素周期律判断,Se与H2反应比S与H2的反应
您最近一年使用:0次
9-10高一下·广东·期末
3 . 下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:

(1)元素③形成的单质的电子式为_______ ;元素②形成的最高价氧化物的结构式为_______ 。
(2)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为___________ 。
(3)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是_______ (填化学式),沸点最高的是________ (填化学式)。
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较_____________ (填化学式)。
(5)用电子式表示⑥、⑧两元素结合成化合物的形成过程_____________ 。
(6)元素⑩在周期表中的位置_____________ ;该元素的单质主要用途_________ (填一种)。

(1)元素③形成的单质的电子式为
(2)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为
(3)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较
(5)用电子式表示⑥、⑧两元素结合成化合物的形成过程
(6)元素⑩在周期表中的位置
您最近一年使用:0次
4 . (8分)下表是元素周期表的一部分, 针对表中的①~⑥元素,填写下列空白:
(1)在这些元素中,化学性质最活泼的金属元素是:_______ (填具体元素符号)。
(2)元素②与⑥形成的BA型化合物所含的化学键类型为:______ 键。
(3)元素④的单质制造的器具不能盛装碱性溶液也不能盛装酸性溶液,请写出元素④的单质与氢氧化钠溶液反应的离子方程式:__________ 。
(4)设计实验证明:元素①比元素⑤的非金属性强:______ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
(1)在这些元素中,化学性质最活泼的金属元素是:
(2)元素②与⑥形成的BA型化合物所含的化学键类型为:
(3)元素④的单质制造的器具不能盛装碱性溶液也不能盛装酸性溶液,请写出元素④的单质与氢氧化钠溶液反应的离子方程式:
(4)设计实验证明:元素①比元素⑤的非金属性强:
您最近一年使用:0次
5 . 下表为元素周期表的一部分。
(1)表中元素________ 的非金属性最强;元素________ 的金属性最强;元素________ 的单质在室温下呈液态;(写元素符号)。
(2)表中半径最大的元素是_______ ;(写元素符号)
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是_______ ;(写化学式,下同)
(4)表中元素⑥、⑦氢化物的稳定性顺序为________ >________ ;
(5)表中元素最高价氧化物对应水化物酸性最强的酸是_________________ 。
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ⑤ | |||||
| 三 | ③ | ⑥ | |||||
| 四 | ④ | ⑦ | |||||
(1)表中元素
(2)表中半径最大的元素是
(3)表中元素⑤、⑥、⑦对应的单质氧化性最强的是
(4)表中元素⑥、⑦氢化物的稳定性顺序为
(5)表中元素最高价氧化物对应水化物酸性最强的酸是
您最近一年使用:0次
6 . 短周期元素X、Y、Z在周期表中位置关系如图所示
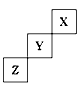
(1)X元素的名称是___________ 。
(2)Y在元素周期表中的位置是__________ ,它形成单质的化学式是_________ 。
(3)Z元素的原子结构示意图为__________ 。写出Z单质与铁反应的化学反应方程式:___________ 。
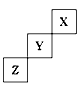
(1)X元素的名称是
(2)Y在元素周期表中的位置是
(3)Z元素的原子结构示意图为
您最近一年使用:0次
2015-05-12更新
|
566次组卷
|
3卷引用:2014-2015广东省佛山市黄岐高中高一下学期第一次月考理化学试卷
10-11高一下·广东潮州·期中
解题方法
7 . 下表是元素周期表的一部分,请回答有关问题:
(1)最活泼的非金属元素是________ (用元素符号或化学式表示,下同);碱性最强的是________ ,该物质存在的化学键类型是_________
(2)⑤元素与⑧元素形成化合物的电子式是_______________________
(3)③⑦⑧三种元素原子半径由小到大的顺序是____________________
(4)将⑤⑥两种单质用导线相连后,同时浸入稀硫酸中,⑥这一极发生________ (填“氧化”或“还原”)反应
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)最活泼的非金属元素是
(2)⑤元素与⑧元素形成化合物的电子式是
(3)③⑦⑧三种元素原子半径由小到大的顺序是
(4)将⑤⑥两种单质用导线相连后,同时浸入稀硫酸中,⑥这一极发生
您最近一年使用:0次
10-11高一下·广东·期中
8 . 下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是_________ ,氧化性最强的单质是_________ ,还原性最强的单质是_________ ;
(2)最高价氧化物的水化物碱性最强的是__________ ,酸性最强的是_________ ,呈两性的是___________ ;
(3)E单质的结构式为_________ , D元素最高价氧化物的电子式为___________ ;
(4)写出B与C两元素最高价氧化物的水化物之间反应的离子方程式___________ 。
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是
(2)最高价氧化物的水化物碱性最强的是
(3)E单质的结构式为
(4)写出B与C两元素最高价氧化物的水化物之间反应的离子方程式
您最近一年使用:0次
9-10高一下·广东佛山·期末
解题方法
9 . W、X、Y、Z是原子序数依次增大的同一短同期的四种元素。W、X是金属元素,Y、Z是非金属元素。Y的氧化物是现代光学及光纤制品的基本原料。请回答:
(1)Y元素原子结构示意图________________________ 。
(2)将Z单质通入水中,可得到具有漂白作用的溶液,请写出反应的化学方程式:
___________________________________________________________________ 。
(3)0.5 mol X单质与足量W的最高价氧化物对应水化物的溶液发生反应,生成
气体的体积(标准状况)为_________________ 。
(4)WZ是生活中常见的盐,实验室检验该盐中阴离子的操作方法和现象为:取
少量WZ固体溶于水,滴加稀硝酸和硝酸银溶液,若产生白色沉淀,则证明WZ中
有该阴离子。请写出反应的离子方程式:__________________________________
(1)Y元素原子结构示意图
(2)将Z单质通入水中,可得到具有漂白作用的溶液,请写出反应的化学方程式:
(3)0.5 mol X单质与足量W的最高价氧化物对应水化物的溶液发生反应,生成
气体的体积(标准状况)为
(4)WZ是生活中常见的盐,实验室检验该盐中阴离子的操作方法和现象为:取
少量WZ固体溶于水,滴加稀硝酸和硝酸银溶液,若产生白色沉淀,则证明WZ中
有该阴离子。请写出反应的离子方程式:
您最近一年使用:0次



