名校
解题方法
1 . 随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
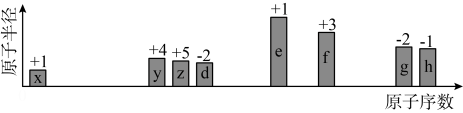
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_______ 。
(2)比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______ 。(用化学式表示)
(3)化合物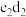 中化学键的类型为
中化学键的类型为_______ 。
(4)选取上述非金属元素组成一种四原子共价化合物,写出其电子式_______ 。
(5)e、f的最高价氧化物对应水化物相互反应的离子方程式为_______ 。
(6)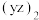 称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为
称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为_______ 。
(7)比较g、h元素的非金属性除了比较其单质与氢气化合难易、气态氢化物的稳定性、最高价氧化物水化物酸性之外,请你再设计一个简单的实验证明:_______ 。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是
(2)比较g、h的最高价氧化物对应的水化物的酸性强弱是:
(3)化合物
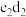 中化学键的类型为
中化学键的类型为(4)选取上述非金属元素组成一种四原子共价化合物,写出其电子式
(5)e、f的最高价氧化物对应水化物相互反应的离子方程式为
(6)
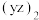 称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为
称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为(7)比较g、h元素的非金属性除了比较其单质与氢气化合难易、气态氢化物的稳定性、最高价氧化物水化物酸性之外,请你再设计一个简单的实验证明:
您最近一年使用:0次
名校
解题方法
2 . 2021年2月22日,嫦娥五号采样返回器带回的月壤公开亮相。对月壤中化学元素的分析有助于认识月球表面环境。元素周期表揭示了化学元素间的内在联系,部分元素在周期表中的位置如下:
(1)经分析,月壤中含有大量的h元素,h在周期表中的位置为______________________ 。
(2)e和f的单质都是化学家戴维通过电解的方法首次制得。这两种元素化的金属性强弱顺序为:e_______ f(填“>”或“<”),用电子式表示f与i形成离子化合物的过程________________ 。
(3)d和i两种元素的简单氢化物中,熔沸点较高的氢化物为_______ ,导致该氢化物熔沸点偏高的原因是________________________________ 。
(4)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”,由c、d、j三种元素组成的化合物是硝石的主要成分,化学式为_______ 。
(5)i是海水中含量丰富的元素,其单质及其化合物在生产、生活领域应用广泛。在图中相应位置写出2种含i元素物质的化学式______ (要求物质类别各不相同;参照c元素形成的NO的定位及写法)。

a | |||||||||||||||||
b | c | d | |||||||||||||||
e | f | g | h | i | |||||||||||||
j |
(2)e和f的单质都是化学家戴维通过电解的方法首次制得。这两种元素化的金属性强弱顺序为:e
(3)d和i两种元素的简单氢化物中,熔沸点较高的氢化物为
(4)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”,由c、d、j三种元素组成的化合物是硝石的主要成分,化学式为
(5)i是海水中含量丰富的元素,其单质及其化合物在生产、生活领域应用广泛。在图中相应位置写出2种含i元素物质的化学式

您最近一年使用:0次
名校
3 . 几种主族元素在周期表中的位置如下
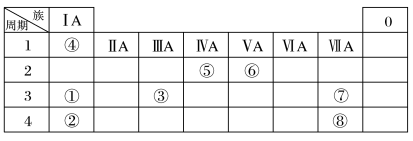
根据上表回答下列问题:
(1)⑦元素的氢化物的电子式是___________ 。
(2)①③⑦三种元素原子半径由大到小的顺序是___________ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为___________ ,该元素在周期表中的位置是___________ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是___________ (填化学式)。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是___________(填字母)。
(6)①和④形成的化合物是___________ (填“离子”或“共价”)化合物。

根据上表回答下列问题:
(1)⑦元素的氢化物的电子式是
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是___________(填字母)。
| A.⑦的氢化物比⑧的氢化物稳定 |
| B.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性 |
| C.⑦的单质能将⑧从其钠盐溶液中置换出来 |
| D.⑦的氢化物酸性比⑧的氢化物酸性弱 |
您最近一年使用:0次
2022-09-30更新
|
558次组卷
|
2卷引用:广东省潮州市湘桥区磷溪中学2021-2022学年高一上学期期末考试化学试题
解题方法
4 . 联合国大会将2019年定为“化学元素周期表国际年”,显示了元素周期表的重要性。表中列出了a~j10种元素在周期表中的位置:
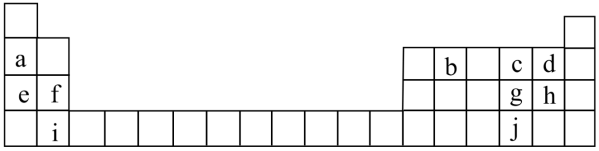
(1)元素a的原子结构示意图为_____ 。
(2)元素b可以形成多种单质,写出其中的两种_____ (填名称)。
(3)元素a~j中非金属性最强的是____ (填元素符号),元素h和i形成的化合物中化学键的类型是_____ 键。
(4)若e单质着火,可用于灭火的物质是____ (填字母)。
(5)3位科学家因在基于a的电池研究方面的成就获得了2019年诺贝尔化学奖。基于e的电池也日益受到重视。下列关于a和e的说法正确的有____ (填字母)。

(1)元素a的原子结构示意图为
(2)元素b可以形成多种单质,写出其中的两种
(3)元素a~j中非金属性最强的是
(4)若e单质着火,可用于灭火的物质是
| A.自来水 | B.CO2 | C.干沙子 | D.湿抹布 |
| A.a的金属性比e弱 | B.自然界中,e的储量比a高 |
| C.a的原子半径比e大 | D.基于a的电池质量轻、易携带 |
您最近一年使用:0次
名校
5 . 如图是元素周期表的一部分。表中所列的字母分别代表一种化学元素:
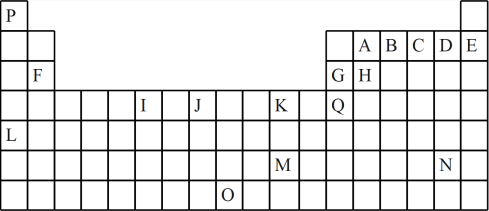
(1)I的最高化合价为___ ,J元素原子的价层电子排布图____ ,Q的元素名称是____ 。元素B、C、D的氢化物热稳定性由大到小是___ (填化学式)。
(2)下列正确的是____ 。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(3)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是___ 。
a.L位于元素周期表中第5周期IA族,属于s区元素
b.O位于元素周期表中第7周期VIIIB族,属于d区元素
c.M的价层电子排布式为6s1,属于ds区元素
d.H所在族的价层电子排布式为ns2np2,属于p区元素
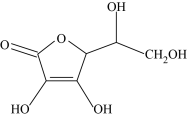
(4)元素P、A、C可以形成人体必需的抗坏血酸,其分子结构如图所示,推测抗坏血酸在水中的溶解性:____ (填“难溶”或“易溶”)于水;坏血酸分子有____ 个手性碳原子。

(1)I的最高化合价为
(2)下列正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(3)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第5周期IA族,属于s区元素
b.O位于元素周期表中第7周期VIIIB族,属于d区元素
c.M的价层电子排布式为6s1,属于ds区元素
d.H所在族的价层电子排布式为ns2np2,属于p区元素
(4)元素P、A、C可以形成人体必需的抗坏血酸,其分子结构如图所示,推测抗坏血酸在水中的溶解性:

您最近一年使用:0次
名校
6 . 1875年,虽然当时未受到门捷列夫预言的启发,法国化学家布瓦博德朗却发现了门捷列夫在他的第一张周期表上留下的空位中的元素“类铝”,并将其命名为镓,同时发表论文提出其密度为4.7g/cm3,门捷列夫在得知这一发现后指出镓和“类铝”是同一种物质,同时认为镓的密度应为5.9—6.0g/cm3,并写信建议布瓦博德重新测定镓的密度,布瓦博德没有固执己见,重新提纯了镓,最后测得的密度果然为5.94g/cm3。
(1)阅读上述材料,你得到什么启示?____ (至少答3条)
(2)已知镓与铝同主族,并位于第四周期,据此可推测氧化镓是一种_____ 氧化物(填“酸性”、“碱性”或“两性”)。
(1)阅读上述材料,你得到什么启示?
(2)已知镓与铝同主族,并位于第四周期,据此可推测氧化镓是一种
您最近一年使用:0次
名校
7 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为___________ ,占据最高能级电子的电子云轮廓图为___________ 形。
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为___________ 。
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是___________ 。
②比较Mg、Ca第一电离能的大小:___________ 。O的第一电离能小于N,原因是___________ 。
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
结合数据说明Mg的常见化合价为+2价的原因:___________ 。
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为___________ ,铁在元素周期表中的位置___________ 。
②比较Li+与H-的半径大小关系:r(Li+)___________ r(H-)(填“>”或“<”)。
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为
②NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、K2O、CaO、MgO、Cr2O3等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②比较Mg、Ca第一电离能的大小:
③下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
| 元素 | Na | Mg | Al |
| 电离能(kJ/mol) | 496 | 738 | 578 |
| 4562 | 1451 | 1817 | |
| 6912 | 7733 | 2745 | |
| 9543 | 10540 | 11575 |
(3)我国科研人员研制出了“Fe—LiH”催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①基态Fe原子的核外电子排布式为
②比较Li+与H-的半径大小关系:r(Li+)
您最近一年使用:0次
2022-03-15更新
|
804次组卷
|
4卷引用:广东省阳山县南阳中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
8 . 已知主族元素,A、B、C、D、E的原子的结构示意图分别为:
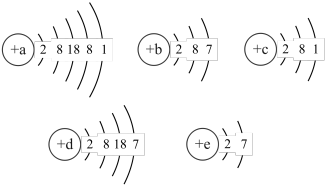
请回答下列问题:
(1)属于同周期的元素是___________ (填元素符号,下同)。
(2)A、B、C、D、E中属于短周期元素的是___________ 。
(3)上述元素形成的单质氧化性最强的是___________ (填化学式)。
(4)aA在周期表中的位置___________ 周期___________ 族。
(5)金属性最强的元素是___________ 。
(6)C、D元素可形成离子化合物,该化合物的电子式为___________ 。
(7)B、C、E形成的简单离子半径最小的是___________ (填离子符号)。

请回答下列问题:
(1)属于同周期的元素是
(2)A、B、C、D、E中属于短周期元素的是
(3)上述元素形成的单质氧化性最强的是
(4)aA在周期表中的位置
(5)金属性最强的元素是
(6)C、D元素可形成离子化合物,该化合物的电子式为
(7)B、C、E形成的简单离子半径最小的是
您最近一年使用:0次
2022-03-05更新
|
275次组卷
|
2卷引用:广东省湛江市第二中学2021-2022学年高二下学期第13周(5.14)周练化学试题
9 . 下面为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
(1)①的元素名称为:___________ ,元素④的原子结构示意图为___________ 。
(2)②的最高价氧化物对应水化物酸性比③的最高价氧化物对应水化物酸性弱的原因是___________(填字母)。
(3)②、④组成的能引起温室效应的化合物的电子式为___________ ,其中含有的化学键为___________ 。
(4)②、⑧的最高价氧化物对应水化物的酸性从强到弱的顺序为___________ (用化学式表示)。
(5)③、⑤、⑦三种元素的离子半径从大到小顺序为___________ (用元素符号表示)。
(6)写出元素⑤⑥对应的最高价氧化物的水化物相互之间发生反应的化学方程式___________ 。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②的最高价氧化物对应水化物酸性比③的最高价氧化物对应水化物酸性弱的原因是___________(填字母)。
| A.②的单质为固体,而③的单质为气体 |
| B.原子半径②比③大 |
| C.②的非金属性比③弱 |
| D.原子序数③比②大 |
(4)②、⑧的最高价氧化物对应水化物的酸性从强到弱的顺序为
(5)③、⑤、⑦三种元素的离子半径从大到小顺序为
(6)写出元素⑤⑥对应的最高价氧化物的水化物相互之间发生反应的化学方程式
您最近一年使用:0次
2022-02-26更新
|
326次组卷
|
2卷引用:广东省潮州市潮安区2021-2022学年高一上学期期末考试化学试题
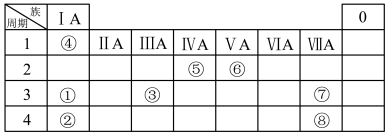
10 . 几种主族元素在周期表中的位置如下
(1)⑥元素的简单氢化物的化学式是_______ 。
(2)①③⑦三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_______ ,该元素在周期表中的位置是_______ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式)①与③最高价氧化物对应水化物反应的离子方程_______ 。
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:_______ 。下列表述中能证明这一事实的是_______ (填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
(1)⑥元素的简单氢化物的化学式是
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
您最近一年使用:0次
2022-01-22更新
|
941次组卷
|
4卷引用:广东省湛江市2021-2022学年高一上学期期末调研考试化学试题
广东省湛江市2021-2022学年高一上学期期末调研考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第四单元02基础练(已下线)专题突破卷05?物质结构 元素周期律?-2024年高考化学一轮复习考点通关卷(新教材新高考)天津市武清区黄花店中学2023-2024学年高三上学期第二次练习化学试题



