名校
解题方法
1 . 下列微粒中,VSEPR模型与空间结构一致的是
A.NO | B.NH | C.ClO | D.SO |
您最近一年使用:0次
2022-02-22更新
|
707次组卷
|
9卷引用:陕西省西安市蓝田县2021~2022学年高二下学期期末质量检测化学试题
陕西省西安市蓝田县2021~2022学年高二下学期期末质量检测化学试题陕西省西安市阎良区2022-2023学年高二下学期期末检测化学试题湖南省百所学校大联考2021-2022学年高二下学期入学考试化学试题湖北省武汉市部分重点中学2021-2022学年高二下学期3月联考化学试题广东省名校联盟2021-2022学年高二下学期4月大联考化学试题甘肃省兰州第一中学2021-2022学年高二下学期4月月考化学试题重庆市好教育联盟2021-2022学年高二下学期期中考试化学试题安徽省六安市晓天中学2021-2022年高二下学期第一次月考化学试题黑龙江省齐齐哈尔市2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
2 . 臭氧( )在
)在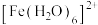 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, ,也可在其他条件下被还原为
,也可在其他条件下被还原为 。
。
(1) 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述)。
(2)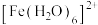 的配位数是
的配位数是___________ 。
(3) 分子中σ键与π键的数目比n(σ):n(π)=
分子中σ键与π键的数目比n(σ):n(π)=___________ 。
(4) 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为___________ (用元素符号表示,下同),电负性从大到小的顺序为___________ 。
(5)与 分子互为等电子体的一种阴离子为
分子互为等电子体的一种阴离子为___________ (填化学式)。
 )在
)在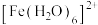 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, ,也可在其他条件下被还原为
,也可在其他条件下被还原为 。
。(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(2)
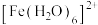 的配位数是
的配位数是(3)
 分子中σ键与π键的数目比n(σ):n(π)=
分子中σ键与π键的数目比n(σ):n(π)=(4)
 中所含三种元素的第一电离能从大到小的顺序为
中所含三种元素的第一电离能从大到小的顺序为(5)与
 分子互为等电子体的一种阴离子为
分子互为等电子体的一种阴离子为
您最近一年使用:0次
名校
解题方法
3 . 下列说法正确的是
| A.离子晶体中不含阴阳离子,只有溶液中才有阴阳离子 |
B. 分子的立体构型:三角锥形 分子的立体构型:三角锥形 |
| C.非金属氧化物都是酸性氧化物 |
D. 、 、 、 、 、 、 的热稳定性依次减弱 的热稳定性依次减弱 |
您最近一年使用:0次
解题方法
4 . 人类使用铜及其合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面具有广泛用途。
(1) 的核外电子排布式为
的核外电子排布式为______ 。
(2) 和
和 是自然界中重要的铜盐,
是自然界中重要的铜盐, 的立体构型是
的立体构型是______ ,S、O、N三种元素的第一电离能由大到小的顺序为______ 。
(3)向盛有 溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子
溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子______ (填离子符号);向反应后的溶液中加入乙醇,析出深蓝色的晶体,该晶体中含有的化学键类型有______ 。
(4)利用 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成红色的
悬浊液检验醛基时,生成红色的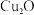 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
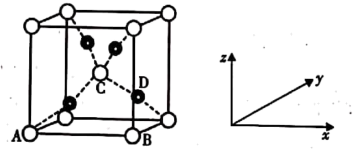
①该晶胞原子坐标参数A为 ;B为
;B为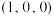 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为______ 。
②若 晶体密度为
晶体密度为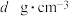 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
______ 。
(1)
 的核外电子排布式为
的核外电子排布式为(2)
 和
和 是自然界中重要的铜盐,
是自然界中重要的铜盐, 的立体构型是
的立体构型是(3)向盛有
 溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子
溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子(4)利用
 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成红色的
悬浊液检验醛基时,生成红色的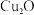 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
①该晶胞原子坐标参数A为
 ;B为
;B为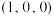 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为②若
 晶体密度为
晶体密度为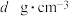 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
您最近一年使用:0次
解题方法
5 . 某元素X基态原子的最外层有3个未成对电子,次外层有2个电子,其价电子排布图为__ ,其原子核外有__ 种不同运动状态的电子;其最低价氢化物电子式为__ ,中心原子采用___ 杂化,分子立体构型为__ 。
您最近一年使用:0次
名校
解题方法
6 . 锂离子电池已破广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯无水溶液作电解液。回答下列问题:
(1)基态锂原子的电子排布图为________ 。基态磷原子子中,电子占据的最高能层符号为_____________ 。
(2)PO 的空间构型为
的空间构型为_______________ 。
(3)[Co(NH3)3Cl3]中Co3+的配位数为6,该配合物中的配位原子为____________ 。
(4)碳酸二乙酯的分子结构如图1所示,分子中所含元素的电负性由小到大的顺序为_____ ,分子中碳原子的杂化轨道类型为____ ,1 mol碳酸二乙酯中含有σ键的数目为_____ NA(NA为阿伏加德罗常数的值)。

(5)在元素周期表中,铁元素位于____ 区(填“s”“p”“d”或“ds”)。γ—Fe 的堆积方式如图2所示,其空间利用率为________ (用含π的式子表示)。
(6)氮化锂是一种新型无机贮氢材料,如图3所示,该晶体的化学式为____________ 。
(1)基态锂原子的电子排布图为
(2)PO
 的空间构型为
的空间构型为(3)[Co(NH3)3Cl3]中Co3+的配位数为6,该配合物中的配位原子为
(4)碳酸二乙酯的分子结构如图1所示,分子中所含元素的电负性由小到大的顺序为

(5)在元素周期表中,铁元素位于
(6)氮化锂是一种新型无机贮氢材料,如图3所示,该晶体的化学式为
您最近一年使用:0次
2020-12-31更新
|
231次组卷
|
3卷引用:陕西省汉中市2021-2022学年高二下学期期末联考化学试题
解题方法
7 . A﹣234是2018年关注度最高的8大分子之一,其结构为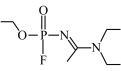 。请根据其结构及其组成元素回答以下问题:
。请根据其结构及其组成元素回答以下问题:
(1)A﹣234分子中N原子的杂化方式为_______ ,该物质所形成的晶体类型为_______ ,基态P原子中核外电子占据的最高能级符号是_______ 。
(2)N、O、F的第一电离能由大到小的顺序为_______ 。
(3)用价层电子对互斥模型预测POF3的立体构型:_______ 。
(4)请比较NH3与NF3的键角大小:NH3_______ (填“>”、“<”或“=”)NF3。
(5)P能够形成PCl3和PCl5,而N只能形成NCl3,其原因是_______ 。
(6)N与Ga所形成的化合物被誉为21世纪引领5G时代的基石材料,其晶胞为六方晶型,如图所示。晶胞参数a=xnm,c=ynm。N原子的配位数为_______ ,该晶胞的密度为_______ g/cm3(用含有x、y的式子表示)。

 。请根据其结构及其组成元素回答以下问题:
。请根据其结构及其组成元素回答以下问题:(1)A﹣234分子中N原子的杂化方式为
(2)N、O、F的第一电离能由大到小的顺序为
(3)用价层电子对互斥模型预测POF3的立体构型:
(4)请比较NH3与NF3的键角大小:NH3
(5)P能够形成PCl3和PCl5,而N只能形成NCl3,其原因是
(6)N与Ga所形成的化合物被誉为21世纪引领5G时代的基石材料,其晶胞为六方晶型,如图所示。晶胞参数a=xnm,c=ynm。N原子的配位数为

您最近一年使用:0次
名校
解题方法
8 . 下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是
| A.CO2 | B.H2O | C. | D.CCl4 |
您最近一年使用:0次
2020-09-07更新
|
795次组卷
|
32卷引用:2014-2015学年陕西西北大学附中高二下期末化学试卷
2014-2015学年陕西西北大学附中高二下期末化学试卷陕西省黄陵中学2017-2018学年高二(重点班)下学期期末考试化学试题2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷2015-2016学年辽宁省葫芦岛市六校协作体联考高二下期中化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测【全国百强校】福建省三明市第一中学2019届高三第二次返校考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期末考试化学试题【全国百强校】福建省厦门第一中学2018-2019学年高二上学期期中考试化学试题湖北省沙市中学2019-2020学年高二上学期期末考试化学试题内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题辽宁省凌源市第二高级中学2019-2020学年高二下学期第二次网测化学试题宁夏银川市长庆高级中学2019-2020学年高二下学期期中考试化学试题山东省泰安市2020届高三第二次模拟考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省福州第一中学2019-2020学年高二下学期期末考试化学试题新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)练习14 分子的空间结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题四川省西昌市2020-2021学年高二下学期期中检测化学试题海南省东方中学2021-2022学年高二下学期第一次月考化学试题新疆莎车县第一中学2021-2022学年高二下学期期中考试化学试题天津市宁河区芦台第一中学2021-2022学年高二下学期线上第一次月考化学试题贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题新疆疏勒县实验学校2021-2022学年高二下学期期中考试化学试题广东省湛江市第二中学2021-2022学年高二下学期第14周(5.21)周练化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题山东省临沂市平邑县第一中学西校区2023-2024学年高二下学期四月份阶段性考试化学试题
名校
解题方法
9 . 按要求填空:
(1)质量数为37的氯原子符号为
(2)NH 的电子式
的电子式
(3)X射线衍射测定等发现,I3AsF6中存在I 离子。I
离子。I 离子的几何构型为
离子的几何构型为
(4)与O3分子互为等电子体的一种阴离子为
(5)F2中F-F键的键能(157kJ/mol)小于Cl2中Cl-C1键的键能(242.7kJ/mol),原因是
您最近一年使用:0次
2020-08-23更新
|
296次组卷
|
2卷引用:陕西省西安市西安高新第一中学2018-2019学年高二下学期期末考试化学试题
名校
解题方法
10 . 按照要求回答下列问题:
(1)基态 Cr 原子的价电子排布式为_______ ,占据最高能层的电子的电子云轮廓图形状为__ 。
(2)在BF3分子中,硼原子的杂化轨道类型为________ ,BF3和过量NaF作用可生成NaBF4,BF 的立体构型为
的立体构型为________ ,写出BF 的一种等电子体
的一种等电子体_______ 。
(3)Fe3+比 Fe2+更稳定的原因是_______________________________ 。
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:
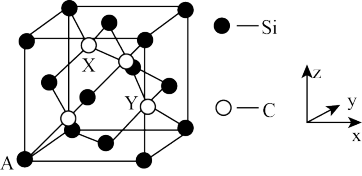
①金刚砂的化学式为_________ 。
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为____________ 。
(1)基态 Cr 原子的价电子排布式为
(2)在BF3分子中,硼原子的杂化轨道类型为
 的立体构型为
的立体构型为 的一种等电子体
的一种等电子体(3)Fe3+比 Fe2+更稳定的原因是
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:

①金刚砂的化学式为
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为
您最近一年使用:0次



