1 . 分铜液净化渣主要含铜、碲( )、锑(
)、锑( )、砷(
)、砷( )等元素的化合物,一种回收工艺流程如图所示:
)等元素的化合物,一种回收工艺流程如图所示:

已知:i.“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有 。
。
ii.“酸浸”时,锑元素反应生成难溶的 浸渣。
浸渣。
回答下列问题:
(1)As位于第四周期VA族,基态 的价层电子排布式为
的价层电子排布式为___________ 。
(2)“碱浸”时, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)向碱浸液加入盐酸调节 ,有
,有 析出,分离出
析出,分离出 的操作是
的操作是___________ 。滤液中 元素最主要的存在形式为
元素最主要的存在形式为___________ (常温下, 的各级电离常数为:
的各级电离常数为: 、
、 、
、 )。
)。
A. B.
B.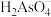 C.
C. D.
D.
(4)“氯盐酸浸”时,通入 的目的是
的目的是___________ 。
(5)“水解”时,生成 的化学方程式为
的化学方程式为___________ 。
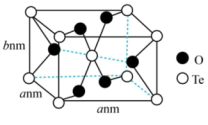
(6) 晶胞是长方体结构(如图所示),Te的配位数为
晶胞是长方体结构(如图所示),Te的配位数为___________ 。已知 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  (列出计算表达式)
(列出计算表达式)
 )、锑(
)、锑( )、砷(
)、砷( )等元素的化合物,一种回收工艺流程如图所示:
)等元素的化合物,一种回收工艺流程如图所示:
已知:i.“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有
 。
。ii.“酸浸”时,锑元素反应生成难溶的
 浸渣。
浸渣。回答下列问题:
(1)As位于第四周期VA族,基态
 的价层电子排布式为
的价层电子排布式为(2)“碱浸”时,
 与
与 反应的离子方程式为
反应的离子方程式为(3)向碱浸液加入盐酸调节
 ,有
,有 析出,分离出
析出,分离出 的操作是
的操作是 元素最主要的存在形式为
元素最主要的存在形式为 的各级电离常数为:
的各级电离常数为: 、
、 、
、 )。
)。A.
 B.
B.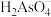 C.
C. D.
D.
(4)“氯盐酸浸”时,通入
 的目的是
的目的是(5)“水解”时,生成
 的化学方程式为
的化学方程式为(6)
 晶胞是长方体结构(如图所示),Te的配位数为
晶胞是长方体结构(如图所示),Te的配位数为 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 (列出计算表达式)
(列出计算表达式)
您最近一年使用:0次
2023-05-30更新
|
370次组卷
|
2卷引用:广东省深圳市福田区福田中学2023-2024学年高三下学期开学考试化学试题
名校
解题方法
2 . 制备 的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
(1)基态 价层电子排布式为
价层电子排布式为_______ 。
(2)N、O、S三种元素的第一电离能由大到小的顺序为_______ 。
(3)沸点: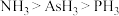 ,原因为
,原因为_______ 。
(4)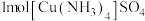 含有σ键的数目为
含有σ键的数目为_______ 。
(5)S与 形成的某化合物晶体的晶胞(实心点表示
形成的某化合物晶体的晶胞(实心点表示 ,空心点表示S)如图所示:
,空心点表示S)如图所示:

①该化合物的化学式为_______ 。
②已知该晶胞的晶胞参数为 ,阿伏加德罗常数为NA,则该晶胞的密度为
,阿伏加德罗常数为NA,则该晶胞的密度为_______  。
。
 的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:
的实验操作如下:向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。回答以下问题:(1)基态
 价层电子排布式为
价层电子排布式为(2)N、O、S三种元素的第一电离能由大到小的顺序为
(3)沸点:
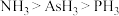 ,原因为
,原因为(4)
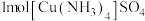 含有σ键的数目为
含有σ键的数目为(5)S与
 形成的某化合物晶体的晶胞(实心点表示
形成的某化合物晶体的晶胞(实心点表示 ,空心点表示S)如图所示:
,空心点表示S)如图所示:
①该化合物的化学式为
②已知该晶胞的晶胞参数为
 ,阿伏加德罗常数为NA,则该晶胞的密度为
,阿伏加德罗常数为NA,则该晶胞的密度为 。
。
您最近一年使用:0次
3 . 镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体 的工艺流程如下。
的工艺流程如下。
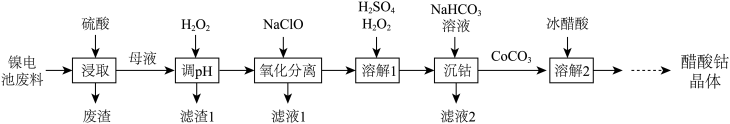
已知:①浸取母液中除铝元素外,其他金属元素的化合价均为 价。
价。
②部分金属阳离子沉淀的 如下表。
如下表。
请回答下列问题:
(1)“浸取”时可以提高浸取率的操作有_______ (任写1条)。
(2)“调 ”时溶液的
”时溶液的 范围是
范围是_______ ,所得滤渣1的主要成分为_______ (填化学式)。
(3)“氧化分离”操作控制溶液 ,加入
,加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)“溶解1”操作中加入 的作用为
的作用为_______ ,“沉钴”操作过程中发生反应的离子方程式为_______ 。
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为_______ 。
(6)碱金属可以插入石墨层中,钾 的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。

C—C键的键长为 ,则K层中m与n两个K原子之间的距离为
,则K层中m与n两个K原子之间的距离为_______  ,设
,设 为阿伏加德罗常数的值,若晶胞参数分别为
为阿伏加德罗常数的值,若晶胞参数分别为 、
、 、
、 ,则该石墨插层化合物的晶胞密度为
,则该石墨插层化合物的晶胞密度为_______  (用含x、y、z、
(用含x、y、z、 的代数式表示)。
的代数式表示)。
 的工艺流程如下。
的工艺流程如下。
已知:①浸取母液中除铝元素外,其他金属元素的化合价均为
 价。
价。②部分金属阳离子沉淀的
 如下表。
如下表。| 沉淀物 |  |  |  |  |  |  |
开始沉淀 | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
完全沉淀 | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)“浸取”时可以提高浸取率的操作有
(2)“调
 ”时溶液的
”时溶液的 范围是
范围是(3)“氧化分离”操作控制溶液
 ,加入
,加入 发生反应的离子方程式为
发生反应的离子方程式为(4)“溶解1”操作中加入
 的作用为
的作用为(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为
(6)碱金属可以插入石墨层中,钾
 的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
的石墨插层化合物具有超导性,其中K层平行于石墨层。图1为其晶胞图,垂直于石墨层方向的原子投影如图2所示。
C—C键的键长为
 ,则K层中m与n两个K原子之间的距离为
,则K层中m与n两个K原子之间的距离为 ,设
,设 为阿伏加德罗常数的值,若晶胞参数分别为
为阿伏加德罗常数的值,若晶胞参数分别为 、
、 、
、 ,则该石墨插层化合物的晶胞密度为
,则该石墨插层化合物的晶胞密度为 (用含x、y、z、
(用含x、y、z、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-02-18更新
|
992次组卷
|
4卷引用:广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题
广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题湖南省百校2023届高三开年摸底联考化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(工业流程题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试平行卷
4 . 氮化硼 是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到
是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到 和
和 ,如图所示。下列叙述正确的是
,如图所示。下列叙述正确的是

 是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到
是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到 和
和 ,如图所示。下列叙述正确的是
,如图所示。下列叙述正确的是
A.硼酸具有片层状结构,层与层之间, 单元间都以范德华力连接 单元间都以范德华力连接 |
| B.立方氮化硼结构与金刚石相似。立方氮化硼晶胞中每个氮原子周围有4个硼原子 |
C. 与 与 反应后再用氨气中和得到 反应后再用氨气中和得到 , , 含有配位键的数目为 含有配位键的数目为 |
D. 与 与 都是由极性键构成的极性分子 都是由极性键构成的极性分子 |
您最近一年使用:0次
2023-02-18更新
|
449次组卷
|
5卷引用:广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题
5 . 我国力争2030年前实现碳达峰,2060年前实现碳中和。CO2的综合利用是实现碳中和的措施之一。
Ⅰ.CO2和CH4在催化剂表面可以合成CH3COOH,该反应势能图如下(*指微粒吸附在催化剂表面,H#指H吸附在催化剂载体上的氧原子上,TS表示过渡态):

(1)写出控速步的基元反应:_______________________________
(2)下列说法正确的有___________ 。
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b.从图中可看出催化效果更好的是催化剂2
c.从图中可看出CH3COOH(g)*比CH3COOH(g)能量低
d.使用高活性催化剂可降低反应焓变,加快反应速率
Ⅱ.CO2和H2一定条件下也可以合成甲醇,该过程存在副反应二。
反应一:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H1 = - 49.3kJ/mol
CH3OH(g) + H2O(g) △H1 = - 49.3kJ/mol
反应二:CO2(g) + H2(g) CO(g) + H2O(g) △H2
CO(g) + H2O(g) △H2
(3)已知25℃和101kPa下,H2(g)、CO(g)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1,H2O(l)= H2O(g) △H=+44kJ•mol-1,则△H2=_______ kJ/mol。
(4)在某密闭容器中充入n(CO2):n(H2)=5:17的混合气体,于5.0MPa和催化剂作用下发生反应,平衡时CO和CH3OH在含碳产物中物质的量百分数及CO2的转化率随温度的变化如图所示。
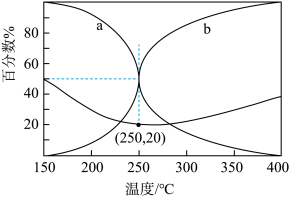
①表示平衡时 CH3OH在含碳产物中物质的量百分数的曲线是_________ (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是_______ 。
③250℃时副反应CO2(g)+H2(g) CO(g)+H2O(g)的Kp=
CO(g)+H2O(g)的Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
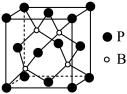
(5)我国科学家研究出一种磷化硼纳米颗粒作为高选择性CO2 电化学还原为甲醇的非金属电催化剂,磷化硼结构与金刚石结构相似,其晶胞如图所示。其中磷化硼晶体中“普通共价键”与配位键的数目之比___________ ;已知阿伏加德罗常数的值为NA,晶胞参数为a pm,则磷化硼晶体的密度为_________ g·pm−3(结果用含a、NA的最简分数表达式表示)。
Ⅰ.CO2和CH4在催化剂表面可以合成CH3COOH,该反应势能图如下(*指微粒吸附在催化剂表面,H#指H吸附在催化剂载体上的氧原子上,TS表示过渡态):

(1)写出控速步的基元反应:
(2)下列说法正确的有
a.增大催化剂表面积可提高CO2在催化剂表面的吸附速率
b.从图中可看出催化效果更好的是催化剂2
c.从图中可看出CH3COOH(g)*比CH3COOH(g)能量低
d.使用高活性催化剂可降低反应焓变,加快反应速率
Ⅱ.CO2和H2一定条件下也可以合成甲醇,该过程存在副反应二。
反应一:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) △H1 = - 49.3kJ/mol
CH3OH(g) + H2O(g) △H1 = - 49.3kJ/mol反应二:CO2(g) + H2(g)
 CO(g) + H2O(g) △H2
CO(g) + H2O(g) △H2(3)已知25℃和101kPa下,H2(g)、CO(g)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1,H2O(l)= H2O(g) △H=+44kJ•mol-1,则△H2=
(4)在某密闭容器中充入n(CO2):n(H2)=5:17的混合气体,于5.0MPa和催化剂作用下发生反应,平衡时CO和CH3OH在含碳产物中物质的量百分数及CO2的转化率随温度的变化如图所示。

①表示平衡时 CH3OH在含碳产物中物质的量百分数的曲线是
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是
③250℃时副反应CO2(g)+H2(g)
 CO(g)+H2O(g)的Kp=
CO(g)+H2O(g)的Kp=(5)我国科学家研究出一种磷化硼纳米颗粒作为高选择性CO2 电化学还原为甲醇的非金属电催化剂,磷化硼结构与金刚石结构相似,其晶胞如图所示。其中磷化硼晶体中“普通共价键”与配位键的数目之比

您最近一年使用:0次
名校
解题方法
6 . Ga和As均位于元素周期表第四周期,砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等,其晶胞结构如图所示,其中原子1的坐标为(0,0,0),原子2的坐标为(1,1,1)。下列有关说法中错误的是
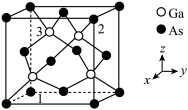

A.原子3的坐标为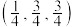 |
B.根据元素周期律,原子半径 |
| C.GaAs的熔点为1238℃,硬度大,晶体类型为共价晶体 |
D.若晶胞边长为a pm,阿伏加德罗常数的值为 ,则GaAs晶体的密度为 ,则GaAs晶体的密度为 |
您最近一年使用:0次
2022-12-31更新
|
908次组卷
|
7卷引用:广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题
广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题广东省梅州市名校2022-2023学年高三上学期期末考试化学试题(已下线)河北省部分学校2022-2023学年高三上学期期末考试变式汇编(10-13)(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)(已下线)专题03 晶体结构与性质(知识串讲+专题过关)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)天津市第三中学2022-2023学年高二下学期期中质量检测化学试题河北省石家庄实验中学2022-2023学年高二上学期期末考试化学试题
名校
7 . 中国科学家在国际上首次实现了CO2到淀粉的合成,不依赖植物光合作用,原料只需CO2、H2和电,相关成果发表在《科学》上。回答下列问题:
(1)CO2的空间结构为_______ 形,其中C原子的杂化方式为_______ 。
(2)Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:_______ 。
(3)淀粉在一定条件下可水解成葡萄糖 ,葡萄糖分子中键角∠H1C1O1
,葡萄糖分子中键角∠H1C1O1_______ ∠C1C2O2 (填“>”、“<”或“=”)。
(4)①(CH3NH3)PbI3的晶胞结构如图所示:

其中B代表Pb2+。则_______ 代表I-,原子分数坐标A为(0,0,0),B为( ,
, ,
, ),则C的原子分数坐标为
),则C的原子分数坐标为_______ 。
②已知(CH3NH3)PbI3的摩尔质量为Mg·mol-1,NA为阿伏加德罗常数的值,则该晶体的密度为_______ g·cm-3。
(1)CO2的空间结构为
(2)Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:
(3)淀粉在一定条件下可水解成葡萄糖
 ,葡萄糖分子中键角∠H1C1O1
,葡萄糖分子中键角∠H1C1O1(4)①(CH3NH3)PbI3的晶胞结构如图所示:

其中B代表Pb2+。则
 ,
, ,
, ),则C的原子分数坐标为
),则C的原子分数坐标为②已知(CH3NH3)PbI3的摩尔质量为Mg·mol-1,NA为阿伏加德罗常数的值,则该晶体的密度为
您最近一年使用:0次
2022-09-14更新
|
360次组卷
|
3卷引用:广东省汕头市金山中学2022-2023学年高三上学期开学考试化学试题
名校
8 . 氯化铵是“侯氏制碱法”的副产品,在工农业生产中具有重要用途。回答下列问题:
(1)氯化铵的立方晶胞结构如图所示:

①与 等距离且最近的Cl-有
等距离且最近的Cl-有_______ 个。
②若氯化铵的密度为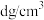 ,设
,设 为阿伏加德罗常数的值,则晶胞参数a=
为阿伏加德罗常数的值,则晶胞参数a=_______ nm(用含d、 的代数式表示)。
的代数式表示)。
(2)常温下,用 计测得某
计测得某 溶液的
溶液的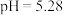 。
。
①用离子方程式表示 溶液呈酸性的原因:
溶液呈酸性的原因:____________ 。
②若溶液中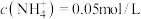 ,则水解常数
,则水解常数
_______ (提示: 和
和 的物质的量浓度几乎相等,
的物质的量浓度几乎相等,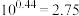 。结果保留2位有效数字)。
。结果保留2位有效数字)。
(3)为探究溶液浓度和 浓度对氯化铵水解的影响,学习小组利用
浓度对氯化铵水解的影响,学习小组利用 溶液和
溶液和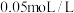 的
的 溶液,按下表配制总体积相同的系列溶液。测定
溶液,按下表配制总体积相同的系列溶液。测定 ,记录数据。
,记录数据。
①补充表中数据:a=_______ 。
②由实验I和II可知,稀释 溶液,
溶液,_______ (填“促进"或“抑制”) 水解,结合表中数据,给出判断理由:
水解,结合表中数据,给出判断理由:_______
③结合表中数据分析 增大,
增大, 水解程度
水解程度_______ (填“增大”、“减小”或“不变”)。
④画出稀释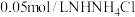 溶液时,
溶液时, 随加入水量的变化曲线图
随加入水量的变化曲线图_______ ,标注出 的变化范围。
的变化范围。
(1)氯化铵的立方晶胞结构如图所示:

①与
 等距离且最近的Cl-有
等距离且最近的Cl-有②若氯化铵的密度为
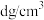 ,设
,设 为阿伏加德罗常数的值,则晶胞参数a=
为阿伏加德罗常数的值,则晶胞参数a= 的代数式表示)。
的代数式表示)。(2)常温下,用
 计测得某
计测得某 溶液的
溶液的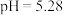 。
。①用离子方程式表示
 溶液呈酸性的原因:
溶液呈酸性的原因:②若溶液中
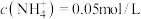 ,则水解常数
,则水解常数
 和
和 的物质的量浓度几乎相等,
的物质的量浓度几乎相等,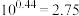 。结果保留2位有效数字)。
。结果保留2位有效数字)。(3)为探究溶液浓度和
 浓度对氯化铵水解的影响,学习小组利用
浓度对氯化铵水解的影响,学习小组利用 溶液和
溶液和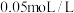 的
的 溶液,按下表配制总体积相同的系列溶液。测定
溶液,按下表配制总体积相同的系列溶液。测定 ,记录数据。
,记录数据。| 序号 | 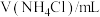 |  | 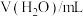 |  |
| I | 20 | 0 | 0 | 5.28 |
| II | 2 | 0 | 18 | 5.78 |
| III | 2 | a | 16 | 5.78 |
| IV | 2 | 10 | 8 | 5.78 |
②由实验I和II可知,稀释
 溶液,
溶液, 水解,结合表中数据,给出判断理由:
水解,结合表中数据,给出判断理由:③结合表中数据分析
 增大,
增大, 水解程度
水解程度④画出稀释
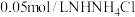 溶液时,
溶液时, 随加入水量的变化曲线图
随加入水量的变化曲线图 的变化范围。
的变化范围。
您最近一年使用:0次
2022-08-05更新
|
225次组卷
|
2卷引用:广东省2023届高三上学期开学联考化学试题
21-22高三上·广东广州·期末
名校
9 . 回答下列问题:
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。回答下列问题:
①基态锌原子的电子排布式为___ ,原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为___ 。
②Cd与Zn同族,价电子数相同,若配离子[Cd(CN)x](x-2)-的中心离子价电子数与配体提供的电子数之和为18,则x=____ 。
③碲和硫同主族,TeO 的空间构型为
的空间构型为___ ,写出一个与TeO 互为等电子体的分子
互为等电子体的分子___ 。
(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。1mol石墨烯含六元环的数目为___ ;石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如图),氧化石墨烯中键角α___ (填“>”、“<”或“=”)键角β,原因是___ 。
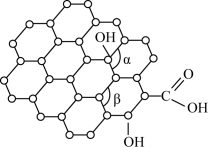
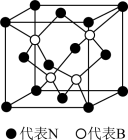
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的___ (填“四面体”、“八面体”或“立方体”)空隙中。若晶胞边长为apm,B原子半径为bpm,N原子半径为cpm,则该晶胞的空间利用率为____ (列出计算式),氮硼原子间的最短距离为___ pm。
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。回答下列问题:
①基态锌原子的电子排布式为
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为②Cd与Zn同族,价电子数相同,若配离子[Cd(CN)x](x-2)-的中心离子价电子数与配体提供的电子数之和为18,则x=
③碲和硫同主族,TeO
 的空间构型为
的空间构型为 互为等电子体的分子
互为等电子体的分子(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。1mol石墨烯含六元环的数目为

(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的

您最近一年使用:0次
2022-01-23更新
|
612次组卷
|
4卷引用:广东名校2021-2022学年高三下学期开学测试化学试题
广东名校2021-2022学年高三下学期开学测试化学试题(已下线)广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题湖南省长沙市雅礼中学2021-2022学年高三下学期月考(七)化学试题湖南省娄底市2022届高三上学期第二次模拟考试化学试题
10 . 有关晶体的结构如图所示,下列说法中错误的是
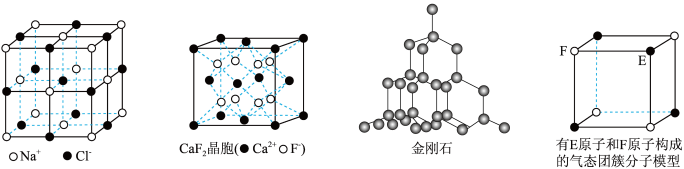
| A.在NaCl晶体中,距Na+最近的Cl-形成为正四面体形 |
| B.在CaF2晶体中,每个晶胞平均占有4个Ca2+ |
| C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2 |
| D.该气态团簇分子的分子式为E4F4或F4E4 |
您最近一年使用:0次
2021-10-23更新
|
1789次组卷
|
17卷引用:广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题
广东省广州大学附属中学2023-2024学年高二下学期开学测化学试题广东省广州市第十六中学2022-2023学年高二下学期5月月考化学试题辽宁省实验中学东戴河分校两校2020-2021学年高二4月联考化学试题(已下线)3.3 金属晶体与离子晶体(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)辽宁省渤海大学附属高级中学2021-2022学年高三上学期第二次月考化学试题四川省内江市威远中学校2021-2022学年高二上学期期中考试化学试题选择性必修第二册 期末学业水平检测山西省朔州市怀仁市大地学校2021-2022学年高二下学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学校2022-2023学年高二下学期期中考试化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期期中考试化学试题黑龙江省大庆市大庆中学2022-2023学年高二下学期5月期中考试化学试题河北省石家庄实验中学2022-2023学年高二上学期期末考试化学试题浙江省宁波市奉化区2023-2024学年高二上学期期末检测化学试题(已下线)热点06 物质的聚集状态与晶体的常识山东省泰安市新泰第一中学老校区(新泰中学)2023-2024学年高二下学期第一次月考化学试题安徽师范大学附属中学2023-2024学年高二下学期4月测试化学试题(已下线)猜想03 晶体结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)



