解题方法
1 . 下列说法正确的是
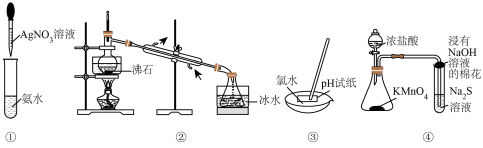
| A.图①操作配制银氨溶液 | B.图②装置可用于分离溴苯和苯 |
| C.图③操作测定氯水的pH | D.图④装置可用于比较Cl、S元素的非金属性 |
您最近一年使用:0次
2 . 氯化亚铜(CuCl)是石油工业常用的脱硫剂和脱色剂,以低品位铜矿(主要成分为CuS。CuS2和铁的氧化物)为原料制备CuCl步骤如下: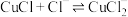 )。
)。
请回答:
(1)还原过程中所得产物的主要溶质的化学式是___________ 。
(2)下列有关说法不正确 的是___________。
(3)“稀释”过程中,pH对CuCl产率的影响如图所示: 左右的原因
左右的原因___________ 。
(4)为测定CuCl产品纯度进行如下实验:
a.称量所得CuCl产品 g溶于硝酸,配制成250mL溶液;取出
g溶于硝酸,配制成250mL溶液;取出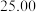 mL,加入足量的
mL,加入足量的 mL
mL 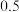 mol/L
mol/L  溶液,充分反应;
溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用 标准溶液滴定过量的
标准溶液滴定过量的 溶液;
溶液;
d.重复实验操作三次,消耗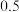 mol/L
mol/L  溶液的体积平均为
溶液的体积平均为 mL。
mL。
已知 ,
,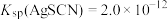 。
。
①加入硝基苯的作用是________ 。
②滴定选用的指示剂是________ 。
A. B.
B. C.
C. D.
D.
③CuCl的纯度为________ 。
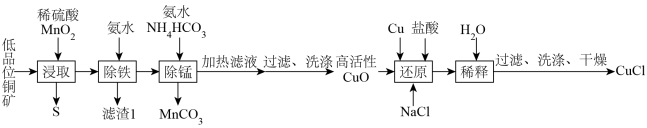
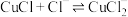 )。
)。请回答:
(1)还原过程中所得产物的主要溶质的化学式是
(2)下列有关说法
| A.“浸取”过程中稀硫酸可以用浓硫酸代替 |
B.滤渣1的成分是 |
C.“除锰”后的滤液中Cu元素主要以 形式存在 形式存在 |
D.“除锰”后滤液加热的主要目的是除去多余的氨水和 |
(3)“稀释”过程中,pH对CuCl产率的影响如图所示:
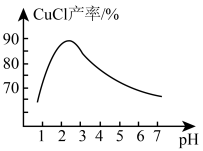
 左右的原因
左右的原因(4)为测定CuCl产品纯度进行如下实验:
a.称量所得CuCl产品
 g溶于硝酸,配制成250mL溶液;取出
g溶于硝酸,配制成250mL溶液;取出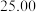 mL,加入足量的
mL,加入足量的 mL
mL 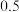 mol/L
mol/L  溶液,充分反应;
溶液,充分反应;b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂,用
 标准溶液滴定过量的
标准溶液滴定过量的 溶液;
溶液;d.重复实验操作三次,消耗
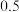 mol/L
mol/L  溶液的体积平均为
溶液的体积平均为 mL。
mL。已知
 ,
,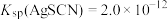 。
。①加入硝基苯的作用是
②滴定选用的指示剂是
A.
 B.
B. C.
C. D.
D.
③CuCl的纯度为
您最近一年使用:0次
3 . 实验室初步分离苯甲酸乙酯、苯甲酸和环己烷的流程如下:
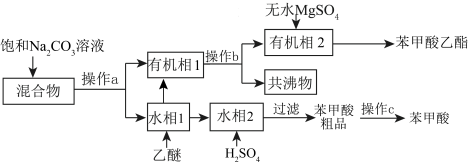
已知:苯甲酸乙酯的沸点为 ,“乙醚-环己烷-水共沸物”的沸点为
,“乙醚-环己烷-水共沸物”的沸点为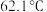 。
。
下列说法不正确 的是

已知:苯甲酸乙酯的沸点为
 ,“乙醚-环己烷-水共沸物”的沸点为
,“乙醚-环己烷-水共沸物”的沸点为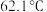 。
。下列说法
| A.操作a为分液,操作c为重结晶 | B.操作b中需用到直形冷凝管 |
| C.可用冷水洗涤苯甲酸粗品 | D.无水 可以用浓硫酸代替 可以用浓硫酸代替 |
您最近一年使用:0次
2023-11-15更新
|
1216次组卷
|
5卷引用:浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题
浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题(已下线)专题03 化学实验基础(3大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)热点11 微型工艺流程江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高二上学期12月月考化学试题
4 . 废镍催化剂主要含Ni,还有少量Cu、Fe、Al及其氧化物、SiO2.某研究小组设计如图所示工艺流程制备硫酸镍晶体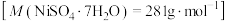 。
。
①镍的化学性质与铁相似,能与酸缓慢反应。
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
(1)“滤渣2”的成分是___________ (用化学式表示)。溶液中加入H2O2的目的是___________ (用离子方程式表示)。
(2)“调pH”可选用的物质___________ (填序号)。
A.Na2CO3 B.NiCO3 C.H2SO4 D.NiSO4
“调pH”的范围为___________ 。
(3)下列有关说法不正确 的是___________。
(4)测定产品的纯度。
计算产品的纯度为___________ 。
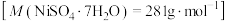 。
。
①镍的化学性质与铁相似,能与酸缓慢反应。
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀的pH | 7.2 | 4.0 | 2.2 | 7.5 |
| 沉淀完全的pH | 9.0 | 5.6 | 3.2 | 9.0 |
(1)“滤渣2”的成分是
(2)“调pH”可选用的物质
A.Na2CO3 B.NiCO3 C.H2SO4 D.NiSO4
“调pH”的范围为
(3)下列有关说法
| A.酸浸步骤可用水浴加热,以加速反应 |
| B.操作A中的有机溶剂可选用乙醇 |
| C.调pH后过滤,需用玻璃棒对漏斗中的混合物充分搅拌 |
| D.操作B中包含“结晶、过滤、洗涤、煅烧”等操作 |
(4)测定产品的纯度。
| 操作步骤 | 涉及反应 |
| ①准确称取制备的硫酸镍样品5.620g,加入含0.0200molEDTA的二钠盐溶液(用H2Y2-表示),充分反应后定容成100mL。 | 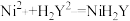 |
②取25.00mL上述溶液于锥形瓶中,加二甲酚橙作指示剂,用 标准液滴定到终点,平行实验三次,平均消耗20.00mLZn2+标准液。 标准液滴定到终点,平行实验三次,平均消耗20.00mLZn2+标准液。 |  |
您最近一年使用:0次
5 . 实验室合成并提纯山梨酸乙酯(密度 ,沸点195.5℃)的过程如下图所示。下列说法正确的是
,沸点195.5℃)的过程如下图所示。下列说法正确的是

 ,沸点195.5℃)的过程如下图所示。下列说法正确的是
,沸点195.5℃)的过程如下图所示。下列说法正确的是
| A.操作①控温110℃,目的是除去生成的水 |
| B.操作③可以通过观察气泡现象控制试剂a的用量 |
| C.操作③④均应收集下层液体 |
| D.操作②⑤可用玻璃棒轻轻拨散固体,以加快过滤速率 |
您最近一年使用:0次
6 . 某研究小组以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉,按如下流程开展实验:
已知:

①硫化铜精矿在酸性条件下与氧气反应:
②金属离子开始沉淀和沉淀完全的pH值如下表所示:
(1)步骤Ⅰ,通入 采用高压的原因是
采用高压的原因是___________ ;
(2)下列有关说法正确的是___________。
(3)步骤Ⅰ、Ⅲ需要高压反应釜装置如图。步骤Ⅲ中,首先关闭出气口,向高压反应釜中通入固定流速的 ,然后通过控制气阀
,然后通过控制气阀 或
或 ,维持反应釜中的压强为
,维持反应釜中的压强为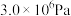 。请给出反应过程中的操作排序:
。请给出反应过程中的操作排序:______
g→___________→___________→___________→c→___________。

a.开启气阀 b.开启气阀
b.开启气阀 ,通入高压
,通入高压 c.关闭气阀
c.关闭气阀 d.开启气阀
d.开启气阀 e.开启气阀
e.开启气阀 ,通入高压
,通入高压 f.关闭气阀
f.关闭气阀 g.开启搅拌器 h.拆下罐体
g.开启搅拌器 h.拆下罐体
(4)步骤Ⅲ,高压 可以从滤液中置换出金属Cu,而无法置换出金属Zn。请结合方程式说明其原因是
可以从滤液中置换出金属Cu,而无法置换出金属Zn。请结合方程式说明其原因是___________ ;
(5)铜纯度的测定
步骤1:取0.200g粗铜,加入一定量浓 、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的
、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的 ,冷却;
,冷却;
步骤2:将步骤1所得溶液加水定容至250mL,量取25.00mL置于锥形瓶中,加入过量KI溶液,再加入少量淀粉溶液,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液30.00mL。
溶液30.00mL。
已知: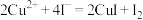 ,
,
①产品中铜的质量分数为___________ ;
②测定过程中,下列说法正确的是___________ 。
A.步骤1中若未反应的 未除尽,则导致滴定结果偏低
未除尽,则导致滴定结果偏低
B.步骤2中应先用蒸馏水洗涤酸式滴定管后,再用硫代硫酸钠标准液润洗
C.滴定过程中,若向锥形瓶内加少量蒸馏水,则滴定结果偏低
D.滴定前平视刻度线,滴定后仰视,则测定的结果偏高
已知:

①硫化铜精矿在酸性条件下与氧气反应:

②金属离子开始沉淀和沉淀完全的pH值如下表所示:
 |  |  |  |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 |
(1)步骤Ⅰ,通入
 采用高压的原因是
采用高压的原因是(2)下列有关说法正确的是___________。
| A.步骤Ⅰ,过滤得到的滤渣中含有S |
B.步骤Ⅱ, 调节pH至4,使 调节pH至4,使 、 、 沉淀完全 沉淀完全 |
| C.步骤Ⅲ,增加溶液的酸度不利于Cu生成 |
| D.为加快过滤速率,需用玻璃棒对漏斗中的沉淀进行充分搅拌 |
(3)步骤Ⅰ、Ⅲ需要高压反应釜装置如图。步骤Ⅲ中,首先关闭出气口,向高压反应釜中通入固定流速的
 ,然后通过控制气阀
,然后通过控制气阀 或
或 ,维持反应釜中的压强为
,维持反应釜中的压强为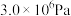 。请给出反应过程中的操作排序:
。请给出反应过程中的操作排序:g→___________→___________→___________→c→___________。

a.开启气阀
 b.开启气阀
b.开启气阀 ,通入高压
,通入高压 c.关闭气阀
c.关闭气阀 d.开启气阀
d.开启气阀 e.开启气阀
e.开启气阀 ,通入高压
,通入高压 f.关闭气阀
f.关闭气阀 g.开启搅拌器 h.拆下罐体
g.开启搅拌器 h.拆下罐体(4)步骤Ⅲ,高压
 可以从滤液中置换出金属Cu,而无法置换出金属Zn。请结合方程式说明其原因是
可以从滤液中置换出金属Cu,而无法置换出金属Zn。请结合方程式说明其原因是(5)铜纯度的测定
步骤1:取0.200g粗铜,加入一定量浓
 、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的
、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的 ,冷却;
,冷却;步骤2:将步骤1所得溶液加水定容至250mL,量取25.00mL置于锥形瓶中,加入过量KI溶液,再加入少量淀粉溶液,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液30.00mL。
溶液30.00mL。已知:
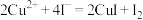 ,
,
①产品中铜的质量分数为
②测定过程中,下列说法正确的是
A.步骤1中若未反应的
 未除尽,则导致滴定结果偏低
未除尽,则导致滴定结果偏低B.步骤2中应先用蒸馏水洗涤酸式滴定管后,再用硫代硫酸钠标准液润洗
C.滴定过程中,若向锥形瓶内加少量蒸馏水,则滴定结果偏低
D.滴定前平视刻度线,滴定后仰视,则测定的结果偏高
您最近一年使用:0次
解题方法
7 . 某实验小组设计粗食盐(含有少量 MgSO4和 CaSO4)的提纯方案如下:

已知: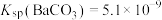 ,
,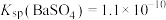 ,下列说法
,下列说法不正确 的是

已知:
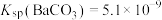 ,
,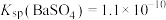 ,下列说法
,下列说法| A.操作I中依据 NaCl 的溶解度估算加水量 |
| B.操作Ⅱ和Ⅳ煮沸增大沉淀的颗粒直径,利于后续过滤 |
| C.为了节约过滤时间,操作Ⅲ和Ⅴ可以合并进行 |
| D.操作Ⅵ可以借助 pH计精确控制加入盐酸的用量 |
您最近一年使用:0次
8 . 下列实验能达到实验目的的是
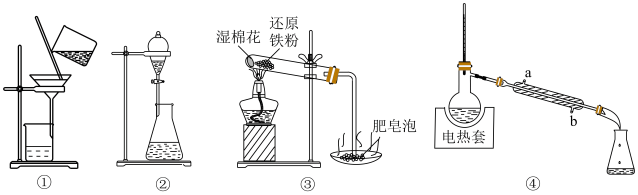
| A.图①操作可除去溴水中的溴单质 |
| B.图②操作用于分离饱和碳酸钠溶液和乙酸乙酯,将分层的液体依次从下口放出 |
| C.图③装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气 |
| D.图④装置用于蒸馏、收集低沸点成分,冷凝水应该从 a口进b口出 |
您最近一年使用:0次
2023-11-09更新
|
508次组卷
|
3卷引用:浙江省杭州市2023-2024学年高三上学期11月期中考试(一模)化学试题
浙江省杭州市2023-2024学年高三上学期11月期中考试(一模)化学试题(已下线)专题03 化学实验基础(3大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省部分学校2024届高三下学期模拟考试化学试卷
9 . 巫山桃花铁矿是重庆迄今发现的最大铁矿,储量上亿吨,按市场估值在400亿以上。其所含化学成分有Fe2O3、MgO、SiO2和不溶物(不溶物不参与反应)。现模拟用该铁矿来制备高铁酸钠[Na2FeO4],其流程设计如图:
请回答下列问题:
(1)请写出基态Fe原子的价电子排布式_______ 。
(2)将矿石粉碎的目的________ 。
(3)操作1的名称是______ ,调pH后过滤所得滤渣的主要成分是_______ 。
(4)常温下,若测得操作1后所得滤液中c(Mg2+)=0.2mol/L,则调pH时的最佳取值范围为_______ 。(已知lg2=0.3,当某离子浓度≤10-5mol/L时可认为其完全沉淀,计算结果保留1位小数)。
(5)氧化时可向滤液中先加入稍过量NaOH溶液,然后再加入NaClO溶液,请写出该反应的离子方程式_______ 。NaClO为常见漂白剂,其水溶液因水解而呈碱性,则NaClO溶液中各离子浓度由大到小的关系为______ 。

| 难溶物 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
| Ksp | 8×10-16 | 4×10-38 | 2×10-11 |
(1)请写出基态Fe原子的价电子排布式
(2)将矿石粉碎的目的
(3)操作1的名称是
(4)常温下,若测得操作1后所得滤液中c(Mg2+)=0.2mol/L,则调pH时的最佳取值范围为
(5)氧化时可向滤液中先加入稍过量NaOH溶液,然后再加入NaClO溶液,请写出该反应的离子方程式
您最近一年使用:0次
10 . 碘酸钙为白色固体,微溶于水,是一种无机精细与专用化学品,一种制备并测定六水合碘酸钙含量的实验设计如下。
步骤Ⅰ:碘酸氢钾( )的制备
)的制备
在三颈烧瓶中加入2.54g 、2.60g氯酸钾和50mL水,滴加6mol/L的盐酸至
、2.60g氯酸钾和50mL水,滴加6mol/L的盐酸至 ,控制温度85℃左右,装置如图。
,控制温度85℃左右,装置如图。
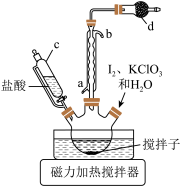
步骤Ⅱ:碘酸钙晶体[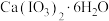 ]的制备
]的制备
将步骤Ⅰ反应后的溶液转入烧杯中,加入KOH溶液调节 ;继续滴加11mL1mol/L
;继续滴加11mL1mol/L 溶液,充分反应后用冰水冷却,抽滤、用少量冰水洗涤、再用少量无水乙醇洗涤,干燥,得粗产品碘酸钙晶体4.50g。
溶液,充分反应后用冰水冷却,抽滤、用少量冰水洗涤、再用少量无水乙醇洗涤,干燥,得粗产品碘酸钙晶体4.50g。
步骤Ⅲ:产品中碘酸钙晶体含量测定
①准确称取1.200g粗产品,置于烧杯中,加入20mL 溶解样品,转移到250mL容量瓶中定容。量取25.00mL溶液于碘量瓶中,加入稍过量的KI,然后用0.1000mol/L
溶解样品,转移到250mL容量瓶中定容。量取25.00mL溶液于碘量瓶中,加入稍过量的KI,然后用0.1000mol/L 标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去25.24mL标准溶液。
标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去25.24mL标准溶液。
②空白实验:不取产品,其余试剂用量和步骤相同,消耗0.04mL 标准溶液。
标准溶液。
已知: ,
, ,
,
请回答下列问题:
(1)仪器c与普通漏斗相比的优点为_____ 。
(2)步骤1中有黄绿色气体产生,则制备 ;反应的化学方程式为
;反应的化学方程式为_____ ,d中盛放的药品是_____ 。(写化学式)
(3)步骤Ⅰ中控制温度85℃左右的原因是_____ 。
(4)步骤Ⅱ中用少量无水乙醇洗涤的目的是_____ 。
(5)下列关于滴定分析的操作,不正确的是_____ 。
A.用量筒量取25.00待测液转移至碘量瓶中
B.滴定过程中用少量蒸馏水将锥形瓶内壁附着的溶液冲下
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“零刻度”以下
(6)碘酸钙晶体中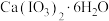 (相对分子质量为498)的纯度为
(相对分子质量为498)的纯度为_____ (计算结果保留两位小数)。
步骤Ⅰ:碘酸氢钾(
 )的制备
)的制备在三颈烧瓶中加入2.54g
 、2.60g氯酸钾和50mL水,滴加6mol/L的盐酸至
、2.60g氯酸钾和50mL水,滴加6mol/L的盐酸至 ,控制温度85℃左右,装置如图。
,控制温度85℃左右,装置如图。
步骤Ⅱ:碘酸钙晶体[
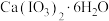 ]的制备
]的制备将步骤Ⅰ反应后的溶液转入烧杯中,加入KOH溶液调节
 ;继续滴加11mL1mol/L
;继续滴加11mL1mol/L 溶液,充分反应后用冰水冷却,抽滤、用少量冰水洗涤、再用少量无水乙醇洗涤,干燥,得粗产品碘酸钙晶体4.50g。
溶液,充分反应后用冰水冷却,抽滤、用少量冰水洗涤、再用少量无水乙醇洗涤,干燥,得粗产品碘酸钙晶体4.50g。步骤Ⅲ:产品中碘酸钙晶体含量测定
①准确称取1.200g粗产品,置于烧杯中,加入20mL
 溶解样品,转移到250mL容量瓶中定容。量取25.00mL溶液于碘量瓶中,加入稍过量的KI,然后用0.1000mol/L
溶解样品,转移到250mL容量瓶中定容。量取25.00mL溶液于碘量瓶中,加入稍过量的KI,然后用0.1000mol/L 标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去25.24mL标准溶液。
标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去25.24mL标准溶液。②空白实验:不取产品,其余试剂用量和步骤相同,消耗0.04mL
 标准溶液。
标准溶液。已知:
 ,
, ,
,
请回答下列问题:
(1)仪器c与普通漏斗相比的优点为
(2)步骤1中有黄绿色气体产生,则制备
 ;反应的化学方程式为
;反应的化学方程式为(3)步骤Ⅰ中控制温度85℃左右的原因是
(4)步骤Ⅱ中用少量无水乙醇洗涤的目的是
(5)下列关于滴定分析的操作,不正确的是
A.用量筒量取25.00待测液转移至碘量瓶中
B.滴定过程中用少量蒸馏水将锥形瓶内壁附着的溶液冲下
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“零刻度”以下
(6)碘酸钙晶体中
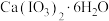 (相对分子质量为498)的纯度为
(相对分子质量为498)的纯度为
您最近一年使用:0次



