1 . 烟气催化脱硝利用脱硝剂能将烟气中的氮氧化物转化为无毒无害的物质,有效减少了烟气对空气的污染,其脱硝过程如图所示,下列说法中错误的是


| A.在烟气脱硝过程中NOx被氧化为N2 |
| B.如果把NOx看成NO,则发生的反应为6NO+4NH3=5N2+6H2O |
| C.空气中NOx的含量高低是检验空气质量的标准之一 |
| D.每处理含0.3molNOx的烟气需消耗4.48L(已折算成标准状况下)氨气 |
您最近一年使用:0次
2022-09-08更新
|
348次组卷
|
2卷引用:河北省邢台市名校联盟2021-2022学年高一下学期第二次联考化学试题
名校
解题方法
2 . 以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图:
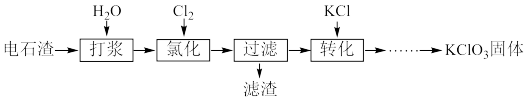
(1)实验室可用MnO2为反应物之一制取Cl2,写出该反应的离子方程式:______ 。
(2)“氯化”过程在75℃左右进行,反应为Cl2与Ca(OH)2反应生成Ca(ClO3)2和CaCl2。
①反应的化学方程式为_______ 。
②每反应0.6 mol Cl2,转移电子的物质的量为______ 。
(3)“过滤”所得滤渣主要为CaCO3,检验滤渣中是否含Ca(OH)2的方法是______ 。
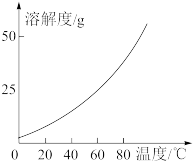
(4)向“过滤”后所得滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3。KClO3的溶解度随温度的变化如图所示,若溶液中KClO3的质量分数为10%,从该溶液中尽可能多的析出KClO3固体的方法是_______ 。

(1)实验室可用MnO2为反应物之一制取Cl2,写出该反应的离子方程式:
(2)“氯化”过程在75℃左右进行,反应为Cl2与Ca(OH)2反应生成Ca(ClO3)2和CaCl2。
①反应的化学方程式为
②每反应0.6 mol Cl2,转移电子的物质的量为
(3)“过滤”所得滤渣主要为CaCO3,检验滤渣中是否含Ca(OH)2的方法是
(4)向“过滤”后所得滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3。KClO3的溶解度随温度的变化如图所示,若溶液中KClO3的质量分数为10%,从该溶液中尽可能多的析出KClO3固体的方法是

您最近一年使用:0次
名校
3 . 某同学设计了如图装置用于制取SO2和验证SO2的漂白性、水溶液的酸性、还原性。
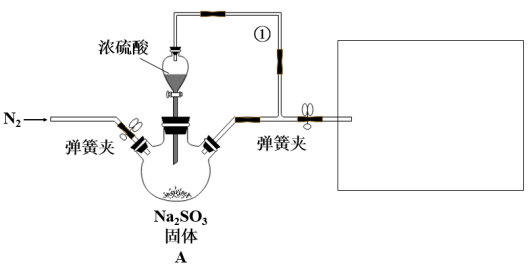
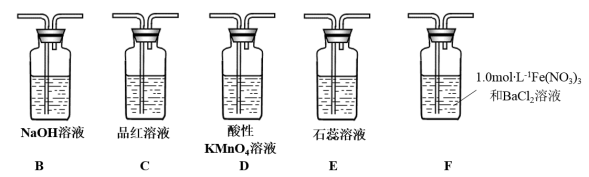
试回答下列问题:
(1)装置A中发生反应的化学方程式为___ 。
(2)装置A中用于添加浓硫酸的仪器名称为___ ,导管①的作用是__ 。
(3)在框图内选择合适装置(从B~E中选择)依次验证SO2的漂白性、水溶液的酸性、还原性,上述各装置按气流从左到右方向连接顺序为A→__ (填装置的字母编号)。
(4)装置D中发生反应的离子方程式是___ 。
(5)已知:1.0mol/L的Fe(NO3)3溶液的pH=1,若将SO2气体通入装置F,装置F中产生了白色沉淀,其成分是__ (填化学式),分析F中产生白色沉淀的可能原因及观察到的其他现象:___ 。
(6)实验中发现Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g产品,配成100mL溶液,移取25.00mL溶液,用0.2000mol/L酸性KMnO4溶液进行反应,消耗KMnO4溶液20.00mL,其中KMnO4→Mn2+。产品中Na2SO3的质量分数为___ 。


试回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)装置A中用于添加浓硫酸的仪器名称为
(3)在框图内选择合适装置(从B~E中选择)依次验证SO2的漂白性、水溶液的酸性、还原性,上述各装置按气流从左到右方向连接顺序为A→
(4)装置D中发生反应的离子方程式是
(5)已知:1.0mol/L的Fe(NO3)3溶液的pH=1,若将SO2气体通入装置F,装置F中产生了白色沉淀,其成分是
(6)实验中发现Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g产品,配成100mL溶液,移取25.00mL溶液,用0.2000mol/L酸性KMnO4溶液进行反应,消耗KMnO4溶液20.00mL,其中KMnO4→Mn2+。产品中Na2SO3的质量分数为
您最近一年使用:0次
解题方法
4 . 下图为某同学设计的原电池装置,当电解质溶液为稀硫酸时:
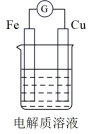
(1)Fe电极是_______ (填“正”或“负”)极,其电极反应为_______ 。
(2)Cu电极发生_______ 反应(填“氧化”或“还原”)。
(3)原电池工作一段时间后,铁片的质量减少了2.8g,铜片表面产生气体_______ L(标准状况下);电路中转移的电子为_______ mol。
(4)某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。则负极的反应式_______ 。关于该电池的下列说法,正确的是_______ (填写字母代号)。

a.工作时电极b作正极,O2-通过固体介质NASICON由电极b流向电极a
b.工作时电流由电极a通过传感器流向电极b
c.传感器中通过的电流越大,尾气中CO的含量越高

(1)Fe电极是
(2)Cu电极发生
(3)原电池工作一段时间后,铁片的质量减少了2.8g,铜片表面产生气体
(4)某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。则负极的反应式

a.工作时电极b作正极,O2-通过固体介质NASICON由电极b流向电极a
b.工作时电流由电极a通过传感器流向电极b
c.传感器中通过的电流越大,尾气中CO的含量越高
您最近一年使用:0次
5 . 合成氨工业采用循环操作的主要目的是
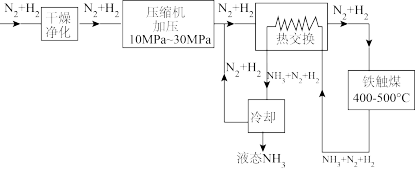
| A.增大氮气和氢气的浓度 | B.节省能量,有利于气态氨的冷却 |
| C.提高氮气和氢气的利用率 | D.提高平衡混合物中 的百分含量 的百分含量 |
您最近一年使用:0次
名校
解题方法
6 . 氮氧化物气体是危害最大、最难处理的大气污染物之一。控制氮氧化物废气排放的技术措施主要分两大类:一类是源头控制;另一类是尾部控制,即烟气脱硝。烟气脱硝的方法有以下几种,回答相关问题:
I.氨气催化还原氮氧化物
(1)已知:N2(g)+3H2(g) 2NH3(g) △H1=-94.4kJ·mol-1
2NH3(g) △H1=-94.4kJ·mol-1
2NO(g) N2(g)+O2(g) △H2=-180kJ·mol-1
N2(g)+O2(g) △H2=-180kJ·mol-1
H2O(l) H2O(g) △H3=+44kJ·mol-1
H2O(g) △H3=+44kJ·mol-1
且氢气的燃烧热为285.8kJ·mol-1,请写出4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H=
5N2(g)+6H2O(g) △H=____ 。
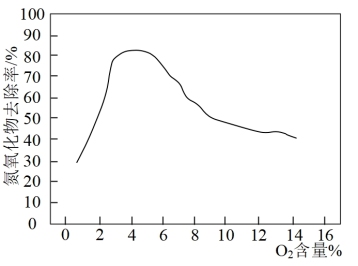
(2)①在有氧条件下:NH3+O→NH2+OH,NH2与NO发生还原反应:NH2+NO→N2+H2O,NH2在还原NO的同时还会被氧化为NO,氮氧化物去除率与氧气的含量及温度关系图象如图所示,当反应气体中O2含量低于6%时,氮氧化物去除率上升的主要原因:____ 。当反应气体中O2含量高于6%时,氮氧化物去除率随O2含量升高而降低的原因:____ 。
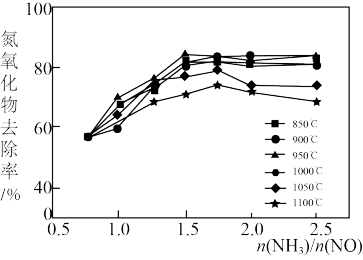
②氮氧化物去除率随着氨氮比 及温度的变化图象如图所示,应选择最佳的氨氮比为:
及温度的变化图象如图所示,应选择最佳的氨氮比为:____ 、氨还原氮氧化物的最佳温度:____ 。
II.氢气还原氮氧化物
(3)①在催化剂表面H2还原NO的基元反应及活化能Ea(kJ·mol-1)如图所示。

写出氢气还原NO的总反应化学方程式:____ ;基元反应慢反应决定总反应速率,决定NO被还原成N2速率的是基元反应____ (填相应序号)。
②若对总反应初始速率与NO、H2的初始浓度的关系为v=kcx(H2)cy(NO),k为速率常数,只受温度影响。在某温度时测得的相关数据如表所示。
关系式中x=____ 、y=____ ;由此,____ (填“H2”或“NO”)的浓度对速率影响程度更大。
③300℃下将等物质的量H2、NO置于刚性密闭容器中,在催化剂的作用下只发生以上反应,达到平衡后压强为P,此时NO的转化率为80%,用气体的平衡分压代替物质的量浓度,表示的压强平衡常数Kp=____ 。
I.氨气催化还原氮氧化物
(1)已知:N2(g)+3H2(g)
 2NH3(g) △H1=-94.4kJ·mol-1
2NH3(g) △H1=-94.4kJ·mol-12NO(g)
 N2(g)+O2(g) △H2=-180kJ·mol-1
N2(g)+O2(g) △H2=-180kJ·mol-1H2O(l)
 H2O(g) △H3=+44kJ·mol-1
H2O(g) △H3=+44kJ·mol-1且氢气的燃烧热为285.8kJ·mol-1,请写出4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H=
5N2(g)+6H2O(g) △H=(2)①在有氧条件下:NH3+O→NH2+OH,NH2与NO发生还原反应:NH2+NO→N2+H2O,NH2在还原NO的同时还会被氧化为NO,氮氧化物去除率与氧气的含量及温度关系图象如图所示,当反应气体中O2含量低于6%时,氮氧化物去除率上升的主要原因:

②氮氧化物去除率随着氨氮比
 及温度的变化图象如图所示,应选择最佳的氨氮比为:
及温度的变化图象如图所示,应选择最佳的氨氮比为:
II.氢气还原氮氧化物
(3)①在催化剂表面H2还原NO的基元反应及活化能Ea(kJ·mol-1)如图所示。

写出氢气还原NO的总反应化学方程式:
②若对总反应初始速率与NO、H2的初始浓度的关系为v=kcx(H2)cy(NO),k为速率常数,只受温度影响。在某温度时测得的相关数据如表所示。
| H2的初始压强P0(H2)=53.3kPa | NO的初始压强P0(NO)=53.3kPa | ||
| P0(NO)/kPa | v/(kPa•s-1) | P0(H2)/kPa | v/(kPa•s-1) |
| 47.8 | 20.0 | 38.4 | 21.3 |
| 39.9 | 13.7 | 27.3 | 14.6 |
| 20.2 | 3.33 | 19.6 | 10.5 |
③300℃下将等物质的量H2、NO置于刚性密闭容器中,在催化剂的作用下只发生以上反应,达到平衡后压强为P,此时NO的转化率为80%,用气体的平衡分压代替物质的量浓度,表示的压强平衡常数Kp=
您最近一年使用:0次
2022-05-25更新
|
377次组卷
|
5卷引用:河北省石家庄市部分学校2022届高三下学期5月模拟考试化学试题
河北省石家庄市部分学校2022届高三下学期5月模拟考试化学试题(已下线)考点25 化学反应速率与平衡图象-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)T19-原理综合题(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
7 . 下图为实验室某试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题。
(1)该NaOH溶液的物质的量浓度为___________ mol•L-1。
(2)现在要配制该浓度的NaOH溶液l00 mL,需称量___________ g固体氢氧化钠。
(3)配制溶液的基本步骤如图所示,按实验过程先后顺序排列(不重复)___________ 。

(4)上述实验步骤A、B、E、F都用到的仪器名称为___________ 。
(5)判断下列操作对NaOH溶液的物质的量浓度的影响(填“偏高”“偏低”或“无影响”)。
①溶解NaOH后的烧杯未进行洗涤___________ 。
②容量瓶中原有少量蒸馏水___________ 。
③定容时俯视容量瓶刻度线___________ 。
| 氢氧化钠溶液 化学式:NaOH 相对分子质量:40 密度:1.2g/cm3 质量分数:20% |
(2)现在要配制该浓度的NaOH溶液l00 mL,需称量
(3)配制溶液的基本步骤如图所示,按实验过程先后顺序排列(不重复)

(4)上述实验步骤A、B、E、F都用到的仪器名称为
(5)判断下列操作对NaOH溶液的物质的量浓度的影响(填“偏高”“偏低”或“无影响”)。
①溶解NaOH后的烧杯未进行洗涤
②容量瓶中原有少量蒸馏水
③定容时俯视容量瓶刻度线
您最近一年使用:0次
8 . 膨松剂是在食品加工过程中加入的,能使面坯发起形成多孔组织的,使食品具有松软和酥脆特点的一类物质,其有效物质为 。某兴趣小组为研究某膨松剂的性质,设计了如下实验:
。某兴趣小组为研究某膨松剂的性质,设计了如下实验:
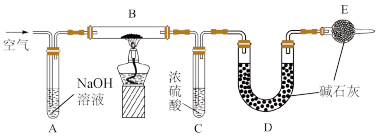
已知:
①碱石灰是固体氧化钙和氢氧化钠的混合物。装置气密性良好,且各装置中试剂皆过量。
②在加热情况下的产气量 是检验膨松剂品质的一项重要指标。
是检验膨松剂品质的一项重要指标。
(1)A中NaOH溶液的作用为_______ ,E中碱石灰的作用为_______ 。
(2)将一定质量的膨松剂置于B中,B中发生的反应为_______ 。
(3)实验时先连接好A、B和C,通入一段时间空气,再连接上D、E;点燃酒精灯开始实验;充分反应后停止加热,应继续通入一段时间空气,这样做的目的是_______ 。
(4)实验结束后称量_______ 装置的质量差即为膨松剂的产气量。
(5)如果取5g膨松剂样品,测得产气量为0.44g,则该膨松剂的有效成分的百分含量为_______ ,产气体积为_______ mL(标准状况下)。
 。某兴趣小组为研究某膨松剂的性质,设计了如下实验:
。某兴趣小组为研究某膨松剂的性质,设计了如下实验:
已知:
①碱石灰是固体氧化钙和氢氧化钠的混合物。装置气密性良好,且各装置中试剂皆过量。
②在加热情况下的产气量
 是检验膨松剂品质的一项重要指标。
是检验膨松剂品质的一项重要指标。(1)A中NaOH溶液的作用为
(2)将一定质量的膨松剂置于B中,B中发生的反应为
(3)实验时先连接好A、B和C,通入一段时间空气,再连接上D、E;点燃酒精灯开始实验;充分反应后停止加热,应继续通入一段时间空气,这样做的目的是
(4)实验结束后称量
(5)如果取5g膨松剂样品,测得产气量为0.44g,则该膨松剂的有效成分的百分含量为
您最近一年使用:0次
9 . 设NA为阿伏加德罗常数的值。下列有关叙述正确的是
| A.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| B.将0.1 mol氯化铁溶于1 L水中,所得溶液含有的Fe3+数目为0.1NA |
| C.硝酸与铜反应得到NO2和N2O4的混合物23 g,则铜失去的电子总数为NA |
| D.在100 g质量分数为64%的乙酸(C2H418O2)水溶液中,含氢原子总数为8NA |
您最近一年使用:0次
10 . 设 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是A.10g质量分数为46%的乙醇水溶液中所含氧原子数为0.4 |
B.100mL1mol·L-1的硅酸钠溶液中含有的 数为0.1 数为0.1 |
C.将2.24L 通入足量溴水中充分反应,生成 通入足量溴水中充分反应,生成 的数目为0.4 的数目为0.4 |
D.12g 在熔融时的离子总数为0.3 在熔融时的离子总数为0.3 |
您最近一年使用:0次
2021-04-25更新
|
622次组卷
|
6卷引用:河北省邯郸市2021届高三第二次模拟考试化学试题
河北省邯郸市2021届高三第二次模拟考试化学试题(已下线)专题01 物质的量 气体摩尔体积(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高三上学期开学考试化学试题



