1 . 铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理。
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3 + 6OH- - 6e- = N2 + 6H2O反应的电极为 (填“阴”、“阳”)极;
②-OH(自由羟基)电氧化
在电流作用下,利用产生的强氧化性中间产物OH脱氮,-OH中O元素的化合价 ;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化NH4+的离子方程式 。
(2)探究适宜的实验条件
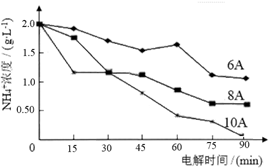
下图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择 A。
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有·OH;
假设二:只有HClO;
假设三: 。
(4)请你设计实验探究脱氮过程中是否有·OH产生,完成下表内容。
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因 。
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3 + 6OH- - 6e- = N2 + 6H2O反应的电极为 (填“阴”、“阳”)极;
②-OH(自由羟基)电氧化
在电流作用下,利用产生的强氧化性中间产物OH脱氮,-OH中O元素的化合价 ;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化NH4+的离子方程式 。
(2)探究适宜的实验条件
下图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择 A。

(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有·OH;
假设二:只有HClO;
假设三: 。
(4)请你设计实验探究脱氮过程中是否有·OH产生,完成下表内容。
| 实验方案 | 预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中·OH |
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因 。
您最近一年使用:0次
13-14高三上·上海·阶段练习
解题方法
2 . 钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
完成下列各题:
(1)实验②所得溶液中的溶质是_______ (写化学式),样品中n(Fe)∶n(Fe3O4)=________ ,m=____________ 。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)_________ 。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围___________ 。
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是
(2)计算实验③中每份硝酸溶液的体积(V)(mL)
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围
您最近一年使用:0次
2016-12-09更新
|
1097次组卷
|
3卷引用:上海市六校联考2016届高考模拟试卷(3月份)化学试题
13-14高三上·上海奉贤·期末
3 . 化学学习中,有关物质性质的学习离不开实验,请阅读下列对应的内容,并按要求完成填空。
(1)实验室经常用烧杯进行性质实验研究,如图所示装置及下表中试剂,过一段时间实验1、2、3、4烧杯①中的现象分别是_____ ,_________ ,________ ,______ 。
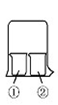
(2)用下图装置:废铜屑制硝酸铜,反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____ (填写化学式)。
(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题。
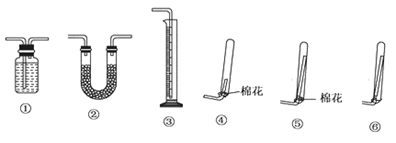
①若要测定生成的NH3的体积,则必须选择的装置是______ (填装置序号),装置中所盛试剂应具有的性质是_______ ,收集干燥的NH3,收集装置应选择(填装置序号)_______ ,理由是__________ 。
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1—10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式_______ 。
(4)下图是苯与溴发生反应并进行产物检验的反应装置:
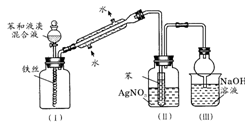
实验装置中的冷凝管“左低右高”的放置目的是____________ ,整套实验装置中能防止倒吸的装置是_____ (填装置序号)。
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫。
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠。
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠。
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎。
②将研钵中的样品露置在空气中两天。
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡。
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少。
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)________ 。
(6)如果要验证③是否成立的实验方法是______________________ 。
(1)实验室经常用烧杯进行性质实验研究,如图所示装置及下表中试剂,过一段时间实验1、2、3、4烧杯①中的现象分别是

| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |

(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题。

①若要测定生成的NH3的体积,则必须选择的装置是
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1—10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式
(4)下图是苯与溴发生反应并进行产物检验的反应装置:

实验装置中的冷凝管“左低右高”的放置目的是
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫。
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠。
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠。
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎。
②将研钵中的样品露置在空气中两天。
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡。
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少。
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)
(6)如果要验证③是否成立的实验方法是
您最近一年使用:0次
2010·四川绵阳·一模
4 . (Ⅰ)混合物的分离与提纯在化学实验中占有重要的位置。下图表示从固体混合物中分离X的方案,请回答有关问题。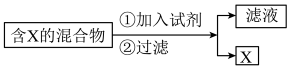
(1)若按照以上图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是_______ ,有关反应的化学方程式为______________ ;
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作)__________________________ 。
(Ⅱ)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(3)该工艺的中间过程会发生反应: ,反应的氧化剂是
,反应的氧化剂是______________ ,氧化产物为__________
(4)在精炼铜的过程中,电解液中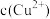 逐渐下降,
逐渐下降,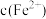 、
、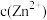 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的 、
、 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
甲同学设计了如下除杂方案:
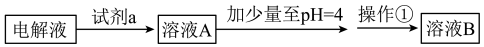
①试剂a是__________ ,其目的是____________________________________ ;根据溶度积该方案能够除去的杂质金属阳离子是____________ 。写出检验该杂质金属阳离子的操作方法:_______________________________________________ .
②乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使 生成
生成 沉淀而除去”,乙同学认为甲同学的方案中也
沉淀而除去”,乙同学认为甲同学的方案中也
应该将溶液pH调至7~8。你认为乙同学的建议是否正确?________ (填“是”或“否”),理由是_________________________________________________ 。

(1)若按照以上图示从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是
(2)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),请设计一种以框图形式表示的实验方案(注明物质和操作)
(Ⅱ)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(3)该工艺的中间过程会发生反应:
 ,反应的氧化剂是
,反应的氧化剂是(4)在精炼铜的过程中,电解液中
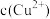 逐渐下降,
逐渐下降,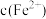 、
、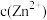 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的 、
、 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。| 物质 |  |  |  |  |
溶度积 | 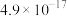 | 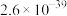 | 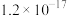 | 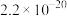 |
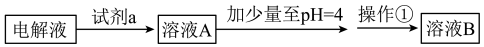
①试剂a是
②乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7~8,可使
 生成
生成 沉淀而除去”,乙同学认为甲同学的方案中也
沉淀而除去”,乙同学认为甲同学的方案中也应该将溶液pH调至7~8。你认为乙同学的建议是否正确?
您最近一年使用:0次
13-14高三·江苏南通·阶段练习
名校
5 . LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是______ 、______ 。反应设备不能用玻璃材质的原因是______ (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的______ 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:______ 。
(3)第④步分离采用的方法是______ ;第⑤步分离尾气中HF、HCl采用的方法是______ 。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为______ mol(用含w、n的代数式表示)。

已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:
(3)第④步分离采用的方法是
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为
您最近一年使用:0次
2016-12-08更新
|
376次组卷
|
5卷引用:四川省南充高级中学2018届高三上学期第四次检测理综化学试题
四川省南充高级中学2018届高三上学期第四次检测理综化学试题(已下线)2015届江苏省海安中学、常州一中、沭阳中学高三联合调研化学试卷2014-2015学年湖南省双峰一中高二下期中理科化学试卷2017届湖南省安仁一中、永兴一中高三上学期8月月考化学试卷河北省大名县第一中学2018届高三(实验班)上学期第一次月考化学试题
2014高三·全国·专题练习
名校
6 . 2013年中国水周的主题是:“节约保护水资源,大力建设生态文明”.
(1)ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_________ 倍.
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图
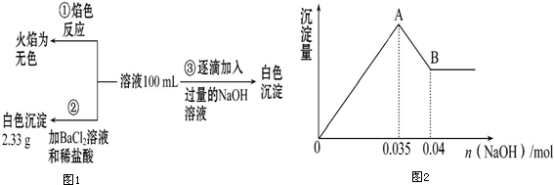
请根据上图回答下列问题:
①实验中需配制1.0mol•L﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为_______________ .
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为___________ .
③试确定NO3-是否存在?________ (填“存在”“不存在”或“不确定”),若存在,试计算c(NO3-)=_____ (若不存在,此问不必作答).
(1)ClO2和Cl2(还原产物都为Cl﹣)是生活中常用的净水消毒剂.当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的
(2)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作流程和有关现象如图所示:操作③的相关图象如图

请根据上图回答下列问题:
①实验中需配制1.0mol•L﹣1的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为
③试确定NO3-是否存在?
您最近一年使用:0次
2016-12-09更新
|
267次组卷
|
5卷引用:新疆乌什县阿克托海乡中学2019届高三年级四月调研考试理综化学试题
新疆乌什县阿克托海乡中学2019届高三年级四月调研考试理综化学试题(已下线)2014届高考化学二轮专题冲刺第3讲 离子反应氧化还原反应练习卷2016届山东省枣庄市滕州五中高三上学期期末化学试卷吉林省长春市第五中学2021届高三上学期期中考试化学试题湖北省石首市第一中学2019-2020学年高三上学期8月月考化学试题
7 . 钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用。已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3。请回答下列问题:
(1)在空气中加热CoCO3可得到黑色Co3O4,写出该反应的化学方程式_______________ 。
(2)Co3O4与浓盐酸反应能生成黄绿色气体,写出该反应的离子方程式______________ 。
(3)常温下,CoCl2溶液在碱性条件下可以得到粉红色Co(OH)2沉淀。已知当溶液中某离子的浓度≤10-5mol·L-1时,就认为该离子不存在,Ksp[Co(OH)2]=1.0×10-15mol3·L-3。若要使0.1 mol·L-1CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为____________ 。
(4)Co(OH)2具有较显著的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式_______________ 。
(5)Co(OH)2在空气中加热时,样品质量随温度变化的曲线如下图所示,通过分析计算确定:

①1000℃时,固体的成分为_____________ 。②取800℃时的产物(其中Co的化合价为+2、+3),用480 mL5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。则该钴氧化物中n(Co2+) :n(Co3+)=__________ 。
(1)在空气中加热CoCO3可得到黑色Co3O4,写出该反应的化学方程式
(2)Co3O4与浓盐酸反应能生成黄绿色气体,写出该反应的离子方程式
(3)常温下,CoCl2溶液在碱性条件下可以得到粉红色Co(OH)2沉淀。已知当溶液中某离子的浓度≤10-5mol·L-1时,就认为该离子不存在,Ksp[Co(OH)2]=1.0×10-15mol3·L-3。若要使0.1 mol·L-1CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为
(4)Co(OH)2具有较显著的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式
(5)Co(OH)2在空气中加热时,样品质量随温度变化的曲线如下图所示,通过分析计算确定:

①1000℃时,固体的成分为
您最近一年使用:0次
名校
8 . 以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为_______ L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________ 。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________ mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=
② 计算KClO4样品的纯度(请写出计算过程。)
您最近一年使用:0次
2016-12-09更新
|
304次组卷
|
6卷引用:2016届江苏省清江中学高三下学期考前练习化学试卷
2010·江西新余·三模
名校
9 . 某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计实验方案.验证假设】该小组对燃烧后的白色产物进行如下探究:
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是_______ 。
(2)乙同学认为方案2得到的结论正确,白色物质为_______ 。
(3)通过方案1和方案2的实验,你认为上述三个假设中,_______ 成立。你的理由是_______ 。
(4)钠在二氧化碳中燃烧的化学方程式为_______ 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:_______ 。
【实验】将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计实验方案.验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(1)甲同学认为方案1得到的结论不正确,其理由是
(2)乙同学认为方案2得到的结论正确,白色物质为
(3)通过方案1和方案2的实验,你认为上述三个假设中,
(4)钠在二氧化碳中燃烧的化学方程式为
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:
您最近一年使用:0次
2016-12-09更新
|
1429次组卷
|
5卷引用:2011届江西省新余一中高三第三次模拟考试化学试卷
(已下线)2011届江西省新余一中高三第三次模拟考试化学试卷(已下线)2014年高考化学苏教版总复习 10-4 化学实验方案设计与评价练习卷(已下线)2014高考名师推荐化学探究组成、性质的实验方案的设计与评价福建省莆田市仙游县枫亭中学2020届高三上学期期中考试化学试题陕西省西安市第一中学2020-2021学年高一上学期12月月考化学试题
2011·安徽合肥·二模
10 . 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是

下列说法正确的是
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ | B.V=224 |
| C.样品中CuO的质量为4.0g | D.V=448 |
您最近一年使用:0次



