1 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用如图所示装置制备干燥纯净的氯气并收集,请回答下列问题。

(1)I中所盛试剂为__ (填序号,下同),II中所盛试剂为__ 。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→________________ ;收集氯气选择用向下排空气法,相同条件下,氯气的密度与氢气的密度之比为__ 。
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定含有CaCl2,请设计实验探究该样品中可能存在的其他物质。[已知Ca(ClO)2可使品红溶液褪色]
I.提出合理假设。
假设1:该漂白粉未变质,含有__ ;
假设2:该漂白粉全部变质,含有__ ;
假设3:该漂白粉部分变质,既含有CaCl2、Ca(ClO)2,又含有CaCO3。
II.设计实验方案,进行实验。

(1)I中所盛试剂为
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定含有CaCl2,请设计实验探究该样品中可能存在的其他物质。[已知Ca(ClO)2可使品红溶液褪色]
I.提出合理假设。
假设1:该漂白粉未变质,含有
假设2:该漂白粉全部变质,含有
假设3:该漂白粉部分变质,既含有CaCl2、Ca(ClO)2,又含有CaCO3。
II.设计实验方案,进行实验。
| 实验步骤 | 预期现象和结论 |
| ①取少量上述漂白粉样品于试管中,加入适量稀盐酸,观察是否有气泡产生 | a.若无气泡产生,则 b. |
| ②向步骤①反应后的试管中滴加1~2滴品红溶液,振荡 | c.若品红溶液褪色,结合实验①中的b判断,则 d.若品红溶液不褪色,则 |
您最近一年使用:0次
名校
解题方法
2 . 高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。

①C为制备K2FeO4装置,KOH溶液过量的原因是___________ 。
②D为尾气处理装置,发生反应的离子方程式为___________ 。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
①由方案I中溶液变红可知a中含有___________ 。该离子的产生___________ (填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________ 。方案Ⅱ得出氧化性:Cl2___________  (填“>”或“<”)
(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:___________ +___________H+=___________O2↑+___________ Fe3++___________(配平及完成上述离子方程式)。
+___________H+=___________O2↑+___________ Fe3++___________(配平及完成上述离子方程式)。__________
现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
(1)制备K2FeO4。

①C为制备K2FeO4装置,KOH溶液过量的原因是
②D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②方案Ⅱ用KOH溶液洗涤的目的是
 (填“>”或“<”)
(填“>”或“<”)(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:___________
 +___________H+=___________O2↑+___________ Fe3++___________(配平及完成上述离子方程式)。
+___________H+=___________O2↑+___________ Fe3++___________(配平及完成上述离子方程式)。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为
您最近一年使用:0次
解题方法
3 . 氯化亚铜(CuCl)是一种见光易分解的白色固体,难溶于水,在潮湿的环境中易被氧气氧化为碱式氯化铜。实验室用SOCl2与CuCl2溶液混合制取CuCl的装置如图所示。
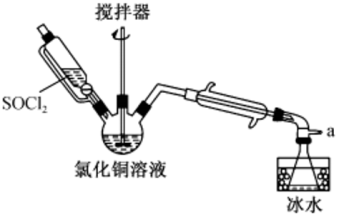
已知:
①SOCl2是一种易发烟的液体,遇水剧烈水解生成SO2和HCl气体;
②CuCl在溶液中存在如下平衡:CuCl(s)+3Cl-(aq) [CuCl4]3-(aq)(无色)。
[CuCl4]3-(aq)(无色)。
回答下列问题:
(1)配制CuCl2溶液所需的蒸馏水需要去氧气,最简单的去氧操作是_______ 。
(2)当三颈烧瓶的溶液由_____ 时(填实验现象),则说明反应已经完成,可以停止实验。
(3)实验结束后需要先向三颈烧瓶中加入去氧水,然后再进行过滤得到CuCl。加水的作用是____ ,过滤时需要在避光的条件下进行,原因是_____ 。
(4)经过滤得到的CuCl沉淀,先用无水乙醇洗涤,然后在真空干燥机内于70℃下干燥2小时,冷却,密封保存。“70℃真空干燥”的目的是_____ 。
(5)久置在空气中的CuCl可完全变质为碱式氯化铜[xCuCl2·yCu(OH)2,其x、y为整数],为探究该碱式氯化铜的组成,设计如下实验步骤:
①准确称取4.216g样品,溶于足量乙酸中,加蒸馏水配制成100mL溶液;
②取25mL溶液,向其中加入足量的AgNO3溶液,充分反应后过滤、洗涤、干燥,所得白色固体质量为0.574g;
③另取25mL溶液,向其中加入过量的KI溶液,再用0.400mol·L-1的Na2S2O3标准溶液滴定至终点,消耗标准溶液25.00mL。已知滴定过程涉及如下反应:2Cu2++4I-=2CuI↓+I2、2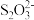 +I2=2I-+
+I2=2I-+ 。
。
计算碱式氯化铜中x=_____ ;y=____ 。

已知:
①SOCl2是一种易发烟的液体,遇水剧烈水解生成SO2和HCl气体;
②CuCl在溶液中存在如下平衡:CuCl(s)+3Cl-(aq)
 [CuCl4]3-(aq)(无色)。
[CuCl4]3-(aq)(无色)。回答下列问题:
(1)配制CuCl2溶液所需的蒸馏水需要去氧气,最简单的去氧操作是
(2)当三颈烧瓶的溶液由
(3)实验结束后需要先向三颈烧瓶中加入去氧水,然后再进行过滤得到CuCl。加水的作用是
(4)经过滤得到的CuCl沉淀,先用无水乙醇洗涤,然后在真空干燥机内于70℃下干燥2小时,冷却,密封保存。“70℃真空干燥”的目的是
(5)久置在空气中的CuCl可完全变质为碱式氯化铜[xCuCl2·yCu(OH)2,其x、y为整数],为探究该碱式氯化铜的组成,设计如下实验步骤:
①准确称取4.216g样品,溶于足量乙酸中,加蒸馏水配制成100mL溶液;
②取25mL溶液,向其中加入足量的AgNO3溶液,充分反应后过滤、洗涤、干燥,所得白色固体质量为0.574g;
③另取25mL溶液,向其中加入过量的KI溶液,再用0.400mol·L-1的Na2S2O3标准溶液滴定至终点,消耗标准溶液25.00mL。已知滴定过程涉及如下反应:2Cu2++4I-=2CuI↓+I2、2
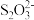 +I2=2I-+
+I2=2I-+ 。
。计算碱式氯化铜中x=
您最近一年使用:0次
4 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是___ 。
②B装置出来的气体是否需要干燥___ (填“是”或“否”), 装置B的作用是___ ,反应的化学方程式为___ 。
③D中NaOH溶液的作用___ 。
④装置C中发生反应的化学方程式有_____ 。
⑤实验结束时,读取实验中生成气体的体积时,不合理的是_____ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,已知氧气的密度为ρg/L,则样品中过氧化钠的质量分数为____ 。
⑦实验完成后E到F之间导管内残留水的体积会使测量结果___ (填“偏大”“偏小”或“不影响”)。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是
②B装置出来的气体是否需要干燥
③D中NaOH溶液的作用
④装置C中发生反应的化学方程式有
⑤实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,已知氧气的密度为ρg/L,则样品中过氧化钠的质量分数为
⑦实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
5 . 通过下列实验操作和实验现象,得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下,分别测定浓度均为0.1mol• L-1的Na2CO3溶液与CH3COONa溶液的 pH,Na2CO3溶液的pH大于CH3COONa溶液 | HCO3电离出H+的能力比CH3COOH的弱 |
| B | 将乙醇与浓硫酸混合加热,产生的气体通入酸性KMnO4溶液,溶液紫红色褪去 | 产生的气体中一定含有乙烯 |
| C | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,有白色沉淀产生 | 样品接触空气已氧化变质 |
| D | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 | 淀粉已经完全水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 某实验需要用到480 mL 0.1mol·L-1FeSO4溶液。下列说法正确的是
| A.选择480 mL容量瓶和100 mL量筒 |
| B.用Na2O2可检验样品是否变质 |
| C.转移溶液时,玻璃棒紧靠在容量瓶刻度线下方 |
| D.若定容时仰视刻度线,所配制溶液浓度偏大 |
您最近一年使用:0次
2019-11-03更新
|
130次组卷
|
2卷引用:河南省洛阳市第四十三中学2022届高三上学期开学考试化学试题
解题方法
7 . (1)0.3molNH3分子中所含原子数与___________ 个H2O分子中所含原子数相等。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有______________ (填“氧化性”或“还原性”);
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________ 。
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_________ ,
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________ 。
A.Cl- B.NO3- C.CO32- D.OH-
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)
A.Cl- B.NO3- C.CO32- D.OH-
您最近一年使用:0次
8 . 下列关于化学实验的现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 取少量Fe(NO3)2样品溶于稀硫酸,再滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已经变质 |
| B | 实验室制取乙酸乙酯完成后,向反应容器中加NaHCO3溶液 | 试管中产生气泡 | 乙酸有剩余 |
| C | 向蔗糖中加入浓硫酸并将所得气体通入紫色石蕊试液 | 紫色石蕊试液先变红后褪色 | 蔗糖与浓硫酸反应产生了具有漂白性的酸性气体 |
| D | 将一小块钠投入装有无水乙醇的试管中 | 钠沉入试管底部且表面有气泡产生 | 钠能与无水乙醇反应且密度大于乙醇 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 下列有关实验操作、现象和目的或结论的说法正确的是
| 选项 | 操作 | 目的或结论 |
| A | 向盛有少量Mg(OH)2 固体的试管中加入适量CH3COONH4 浓溶液,充分振荡,白色固体溶解 | NH4+与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解 |
| B | 海带提碘实验中,为了制取海带灰的浸取液,需要煮沸海带灰和水的混合物2-3min | 主要目的是去除溶液中的氧气,避免碘离子被氧化 |
| C | 保存硫酸亚铁溶液需加入少量稀盐酸和铁钉 | 防止Fe2+水解以及被氧气氧化 |
| D | 将Fe(NO3)2 晶体溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 | 检验Fe(NO3)2样品是否已被氧化而变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-02-23更新
|
422次组卷
|
3卷引用:河南省周口市2018届高三上学期期末抽测调研化学试题
名校
解题方法
10 . 下列各项中操作或现象能达到预期实验目的的是
| 实验目的 | 操作或现象 | |
| A | 分离Fe2O3、Al2O3 | 将混合物置于足量NaOH溶液中,然后依次进行过滤、洗涤、蒸发、灼烧四项操作 |
| B | 确定KCl中是否含有NaCl | 做焰色反应实验,观察焰色是否显黄色 |
| C | 确定FeCl2是否完全变质 | 取少量的FeCl2样品于试管中,逐滴加入酸性高锰酸钾溶液 |
| D | 除去Fe粉中的I2 | 加热使I2升华 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-01-11更新
|
310次组卷
|
4卷引用:河南省商丘市第一高级中学2017-2018学年高一上学期第二次月考化学试题



