1 . 根据英国地质调查局的报告,我国是世界上锑产量最大的国家,产量占全球的84%。锑在自然界中主要存在于辉锑矿(Sb2S3)中,湖南省冷水江市的锡矿山是世界最大锑矿,估计储量为210万吨。
(1)写出锑原子的核外电子排布,并以此判断其最常见的三个化合价:_______ 。
(2)在一些安全火柴的火柴头中使用了三硫化二锑。写出其燃烧时的化学反应方程式:_______ 。
(3)锑有两种常见氟化物。取其高价态的氟化物,在它的HF溶液中慢慢加入H2O2,得锑含量为44.97%的白色离子化合物A,其阴离子呈八面体结构。A的结构简式为_______ ,A不稳定,易缓慢分解为B和某种气体,写出生成B的化学方程式:_______ 。
(1)写出锑原子的核外电子排布,并以此判断其最常见的三个化合价:
(2)在一些安全火柴的火柴头中使用了三硫化二锑。写出其燃烧时的化学反应方程式:
(3)锑有两种常见氟化物。取其高价态的氟化物,在它的HF溶液中慢慢加入H2O2,得锑含量为44.97%的白色离子化合物A,其阴离子呈八面体结构。A的结构简式为
您最近一年使用:0次
2 . 低浓度含砷As废水可用铁盐沉淀法处理。通常情况下,废水中同时存在三价砷和五价砷,其去除原理为:Fe3++AsO =FeAsO3↓,Fe3++AsO
=FeAsO3↓,Fe3++AsO =FeAsO4↓。
=FeAsO4↓。
已知:①三价砷的毒性高于五价砷;
②Ksp(FeAsO3)>Ksp(FeAsO4);
③K2FeO4具有较强的氧化性。pH越小,其氧化性越强,稳定性越弱。
(1)pH约为7时,为除去废水中的砷,下列试剂中去除效果较好的是____ (填序号)。
A.FeCl3 B.K2FeO4 C.FeCl3、K2FeO4
选择该试剂的理由是___ 。
(2)一定条件下,以K2FeO4去除废水中的砷,溶液的pH对砷去除率的影响如图1所示:

①当pH>8时,pH越大,砷去除率越低,其原因可能是___ 。
②当pH<5时,pH越小,砷去除率越低,其原因可能是___ 。
(3)Na2S2O8易溶于水、有氧化性,利用Fe—Na2S2O8体系去除废水中的五价砷,反应机理如图2所示。

已知:•OH(羟基自由基)是一种不带电荷的活性中间体,“•”表示未成对电子。
①写出•OH的电子式____ 。
②S2O 在此过程中的作用与发生的变化可描述为
在此过程中的作用与发生的变化可描述为___ 。
 =FeAsO3↓,Fe3++AsO
=FeAsO3↓,Fe3++AsO =FeAsO4↓。
=FeAsO4↓。已知:①三价砷的毒性高于五价砷;
②Ksp(FeAsO3)>Ksp(FeAsO4);
③K2FeO4具有较强的氧化性。pH越小,其氧化性越强,稳定性越弱。
(1)pH约为7时,为除去废水中的砷,下列试剂中去除效果较好的是
A.FeCl3 B.K2FeO4 C.FeCl3、K2FeO4
选择该试剂的理由是
(2)一定条件下,以K2FeO4去除废水中的砷,溶液的pH对砷去除率的影响如图1所示:

①当pH>8时,pH越大,砷去除率越低,其原因可能是
②当pH<5时,pH越小,砷去除率越低,其原因可能是
(3)Na2S2O8易溶于水、有氧化性,利用Fe—Na2S2O8体系去除废水中的五价砷,反应机理如图2所示。

已知:•OH(羟基自由基)是一种不带电荷的活性中间体,“•”表示未成对电子。
①写出•OH的电子式
②S2O
 在此过程中的作用与发生的变化可描述为
在此过程中的作用与发生的变化可描述为
您最近一年使用:0次
3 . 钻在材料、化工等领域应用广泛。可用废旧锂电池预处理得到的活性物质 (不溶于水)为原料回收金属钻或制备草酸钻(
(不溶于水)为原料回收金属钻或制备草酸钻(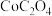 )。已知:在溶液中
)。已知:在溶液中 可与
可与 、
、 形成配离子
形成配离子 、
、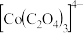 。
。
(1)用30%过氧化氢、 硫酸混合溶液对活性物质进行浸出,浸出时
硫酸混合溶液对活性物质进行浸出,浸出时 生成
生成 ,则反应的离子方程式为
,则反应的离子方程式为_______ 。
(2)用锌棒作阳极、石墨作阴极电解浸出液,将 还原为Co单质以回收金属钻。若其他条件相同,测得pH约为4时
还原为Co单质以回收金属钻。若其他条件相同,测得pH约为4时 的残留率最低,其可能原因是
的残留率最低,其可能原因是_______ 。
(3)向浸出液中加入草酸铵[ ]溶液可制得
]溶液可制得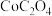 。其他条件相同时,溶液pH、
。其他条件相同时,溶液pH、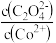 对钴沉淀率的影响如图1、图2所示。
对钴沉淀率的影响如图1、图2所示。

①“沉钴”时采取的最适宜的pH和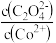 分别为
分别为_______ 、_______ 。
②pH>2.5时,钴沉淀率变化的可能原因是_______ 。
(4)Co与CO、 在一定条件下可制得
在一定条件下可制得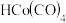 。
。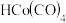 与
与 可反应生成高碳醛,反应历程如图所示,则由
可反应生成高碳醛,反应历程如图所示,则由 生成高碳醛总的化学反应方程式可表示为
生成高碳醛总的化学反应方程式可表示为_______ 。

 (不溶于水)为原料回收金属钻或制备草酸钻(
(不溶于水)为原料回收金属钻或制备草酸钻(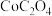 )。已知:在溶液中
)。已知:在溶液中 可与
可与 、
、 形成配离子
形成配离子 、
、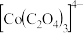 。
。(1)用30%过氧化氢、
 硫酸混合溶液对活性物质进行浸出,浸出时
硫酸混合溶液对活性物质进行浸出,浸出时 生成
生成 ,则反应的离子方程式为
,则反应的离子方程式为(2)用锌棒作阳极、石墨作阴极电解浸出液,将
 还原为Co单质以回收金属钻。若其他条件相同,测得pH约为4时
还原为Co单质以回收金属钻。若其他条件相同,测得pH约为4时 的残留率最低,其可能原因是
的残留率最低,其可能原因是(3)向浸出液中加入草酸铵[
 ]溶液可制得
]溶液可制得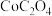 。其他条件相同时,溶液pH、
。其他条件相同时,溶液pH、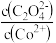 对钴沉淀率的影响如图1、图2所示。
对钴沉淀率的影响如图1、图2所示。
①“沉钴”时采取的最适宜的pH和
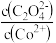 分别为
分别为②pH>2.5时,钴沉淀率变化的可能原因是
(4)Co与CO、
 在一定条件下可制得
在一定条件下可制得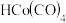 。
。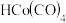 与
与 可反应生成高碳醛,反应历程如图所示,则由
可反应生成高碳醛,反应历程如图所示,则由 生成高碳醛总的化学反应方程式可表示为
生成高碳醛总的化学反应方程式可表示为
您最近一年使用:0次
4 . 煤电工业产生的烟气或汽车尾气中常含有NOx、CO等污染大气的气体,其中的NOx来源于如下反应:
反应Ⅰ:
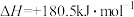
反应Ⅱ:
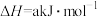
(1)反应Ⅱ在常温下就能自发进行,则a_______ 0。(填“>”或“<”)
(2)煤电工业烟气中的NO可利用“氨法脱硝”处理,其反应为
①反应中,生成 时,被
时,被 氧化的
氧化的 的质量为
的质量为_______ 。
②工业上可利用尿素[ ]水解制得
]水解制得 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)为避免汽车尾气中的NOx和CO直接排放到大气中,可利用“三元催化转换器”将其转化为 和
和 。
。
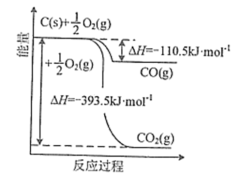
①已知含碳物质参与反应的能量变化如所示,则NO(g)和CO(g)转化为 和
和 的热化学方程式为
的热化学方程式为_______ 。
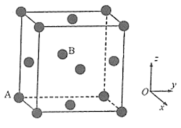
②“三元催化转换器”中用到了金属铂,如图为金属铂的晶胞结构示意图。金属铂晶体中,铂原子周围与之紧邻的其他铂原子数目为_______ 。若A原子的分数坐标为(0,0,0),则B原子的分数坐标为_______ 。
反应Ⅰ:

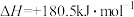
反应Ⅱ:

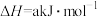
(1)反应Ⅱ在常温下就能自发进行,则a
(2)煤电工业烟气中的NO可利用“氨法脱硝”处理,其反应为

①反应中,生成
 时,被
时,被 氧化的
氧化的 的质量为
的质量为②工业上可利用尿素[
 ]水解制得
]水解制得 ,该反应的化学方程式为
,该反应的化学方程式为(3)为避免汽车尾气中的NOx和CO直接排放到大气中,可利用“三元催化转换器”将其转化为
 和
和 。
。①已知含碳物质参与反应的能量变化如所示,则NO(g)和CO(g)转化为
 和
和 的热化学方程式为
的热化学方程式为
②“三元催化转换器”中用到了金属铂,如图为金属铂的晶胞结构示意图。金属铂晶体中,铂原子周围与之紧邻的其他铂原子数目为

您最近一年使用:0次
5 .  价铬有强氧化性和毒性,必须进行处理后排放。处理含铬废水并制备
价铬有强氧化性和毒性,必须进行处理后排放。处理含铬废水并制备 的流程如下:
的流程如下:

已知:
(1)①写出 与
与 溶液在酸性条件下反应的离子方程式:
溶液在酸性条件下反应的离子方程式:___________ 。
② 转化为
转化为 时,不同
时,不同 条件对铬元素的去除效果如图所示,调节
条件对铬元素的去除效果如图所示,调节 时总铬浓度先减小再增大的原因是
时总铬浓度先减小再增大的原因是___________ 。

(2)测定 样品中
样品中 的质量分数。称取样品0.5000g,加水溶解配成
的质量分数。称取样品0.5000g,加水溶解配成 溶液。移取
溶液。移取 于锥形瓶中,加入过量
于锥形瓶中,加入过量 ,充分反应后,加热煮沸,然后加
,充分反应后,加热煮沸,然后加 酸化。此时铬元素以
酸化。此时铬元素以 形式存在,再加入
形式存在,再加入 ,摇匀,充分反应(
,摇匀,充分反应( ),用
),用 标准
标准 溶液滴定至接近终点时,加入淀粉溶液,继续滴定至终点,消耗标准
溶液滴定至接近终点时,加入淀粉溶液,继续滴定至终点,消耗标准 溶液21.00mL(
溶液21.00mL( )。
)。
①标准 溶液需盛放在
溶液需盛放在___________ (填“酸式”或“碱式”)滴定管中,滴定至终点的现象为___________ 。
②若未充分加热煮沸,则测量结果会___________ (填“偏大”“偏小”或“无影响”)。
③计算样品中 的质量分数:
的质量分数:___________ (写出计算过程)。
 价铬有强氧化性和毒性,必须进行处理后排放。处理含铬废水并制备
价铬有强氧化性和毒性,必须进行处理后排放。处理含铬废水并制备 的流程如下:
的流程如下:
已知:

(1)①写出
 与
与 溶液在酸性条件下反应的离子方程式:
溶液在酸性条件下反应的离子方程式:②
 转化为
转化为 时,不同
时,不同 条件对铬元素的去除效果如图所示,调节
条件对铬元素的去除效果如图所示,调节 时总铬浓度先减小再增大的原因是
时总铬浓度先减小再增大的原因是
(2)测定
 样品中
样品中 的质量分数。称取样品0.5000g,加水溶解配成
的质量分数。称取样品0.5000g,加水溶解配成 溶液。移取
溶液。移取 于锥形瓶中,加入过量
于锥形瓶中,加入过量 ,充分反应后,加热煮沸,然后加
,充分反应后,加热煮沸,然后加 酸化。此时铬元素以
酸化。此时铬元素以 形式存在,再加入
形式存在,再加入 ,摇匀,充分反应(
,摇匀,充分反应( ),用
),用 标准
标准 溶液滴定至接近终点时,加入淀粉溶液,继续滴定至终点,消耗标准
溶液滴定至接近终点时,加入淀粉溶液,继续滴定至终点,消耗标准 溶液21.00mL(
溶液21.00mL( )。
)。①标准
 溶液需盛放在
溶液需盛放在②若未充分加热煮沸,则测量结果会
③计算样品中
 的质量分数:
的质量分数:
您最近一年使用:0次
名校
解题方法
6 . 实验室用严重锈蚀的废铁屑为原料制备硫酸亚铁晶体( ),流程如下:
),流程如下:

下列说法正确的是
 ),流程如下:
),流程如下:
下列说法正确的是
| A.上述流程中涉及的反应均属于氧化还原反应 |
B.“酸溶”时试剂 可用稀硫酸或稀盐酸 可用稀硫酸或稀盐酸 |
C.“还原”时发生反应的离子方程式为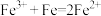 |
| D.“结晶”采用的方式是蒸发浓缩、冷却结晶 |
您最近一年使用:0次
2021-06-30更新
|
1153次组卷
|
8卷引用:江苏省南通市2020-2021学年高一下学期期末考试化学试题
解题方法
7 . 大气、水体常见污染元素主要有氮、硫。含氮废气、废液处理是化学学科重要研究课题。
(1)在含 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是___ 。
(2)用NaClO可以将氨氮(NH3、NH )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式___ 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。
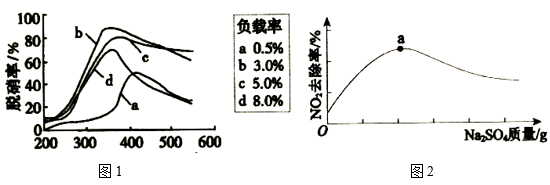
为达到最佳的脱硝效果,应采取的反应条件为___ (填温度和负载率数值)。
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+ (aq)
(aq) CaSO4(s)+
CaSO4(s)+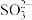 (aq)
(aq)
Ⅱ.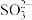 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq)
浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是___ 。
(1)在含
 、
、 废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++
废水中加入镁矿工业废水(含Mg2+),以除去N、P,其反应离子方程为Mg2++ +
+
 MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是
MgNH4PO4↓,该方法除N、P需要控制污水的pH在适当范围,原因是(2)用NaClO可以将氨氮(NH3、NH
 )氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式
)氧化为N2脱离溶液,NaClO去除NH3反应的化学方程式(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。

为达到最佳的脱硝效果,应采取的反应条件为
(4)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
Ⅰ.CaSO3(s)+
 (aq)
(aq) CaSO4(s)+
CaSO4(s)+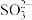 (aq)
(aq)Ⅱ.
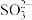 (aq)+2NO2(g)+H2O(l)
(aq)+2NO2(g)+H2O(l)
 (aq)+2
(aq)+2 (aq)+2H+( aq)
(aq)+2H+( aq) 浆液中CaSO3质量一定时,Na2SO4的质量与NO2的去除率变化趋势如图2所示。a点后NO2去除率降低的原因是
您最近一年使用:0次
2021-06-30更新
|
142次组卷
|
2卷引用:江苏省宿迁市2020-2021学年高二下学期期末考试化学试题
8 . X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是
A.X、Y生成H2的物质的量之比一定为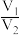 |
B.X、Y消耗酸的物质的量之比一定为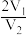 |
C.产物中X、Y化合价之比一定为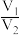 |
D.由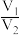 一定能确定产物中X、Y的化合价 一定能确定产物中X、Y的化合价 |
您最近一年使用:0次
2021-06-29更新
|
8204次组卷
|
27卷引用:江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题
江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题(已下线)题型01 以物质的量为中心的计算-【好题汇编】备战2023-2024学年高一化学期末真题分类汇编(江苏专用)2021年新高考山东化学高考真题(已下线)课时11 物质的量、气体摩尔体积-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题02 化学计量与化学计算-备战2022年高考化学真题及地市好题专项集训【山东专用】江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题山东省烟台市第二中学2021-2022学年高一10月月考化学试题2021年山东高考化学试题变式题1-10湖北省武汉市汉阳、江夏2021-2022学年高一上学期12月联考化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题(已下线)第04讲 物质的量 气体摩尔体积 (练)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题湖南攸县长鸿实验中学2022-2023学年高三上学期第二次月考化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学武汉市第一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题02 阿伏加德罗常数及其化学计算 (练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第一章 物质的量 第1讲 物质的量 气体摩尔体积山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点02 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)辽宁省沈阳市五校协作体2023-2024学年高一上学期11月期中考试化学试题(已下线)第01讲 物质的量 气体摩尔体积(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
9 . 亚氯酸钠( )是一种高效的消毒剂和漂白剂,工业上以氯酸钠(
)是一种高效的消毒剂和漂白剂,工业上以氯酸钠( )为原料制备
)为原料制备 的流程如下:
的流程如下:

(1)“还原”得到 气体,母液中溶质的主要成分是
气体,母液中溶质的主要成分是____ (填化学式), 与
与 发生反应的离子方程式为
发生反应的离子方程式为____ 。
(2)分析电解一段时间后溶液中 的含量。
的含量。
已知:① 被
被 还原为
还原为 、
、 的转化率与溶液pH的20关系如图所示。
的转化率与溶液pH的20关系如图所示。

②当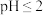 时,
时, 也能被
也能被 完全还原为
完全还原为 。
。
③反应生成的用标准 溶液滴定:
溶液滴定: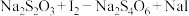 (未配平)
(未配平)
准确量取500mL水样加入到锥形瓶中,加入NaOH溶液调节pH为7~8,加入足量KI晶体,充分搅拌后,滴加几滴淀粉溶液,用0.2000mol/L标准 溶液滴定至终点,滴定终点的现象是
溶液滴定至终点,滴定终点的现象是____ ,消耗 溶液20.00mL。计算电解后所得溶液中
溶液20.00mL。计算电解后所得溶液中 的含量(mg/L)
的含量(mg/L)___ (写出计算过程)。
 )是一种高效的消毒剂和漂白剂,工业上以氯酸钠(
)是一种高效的消毒剂和漂白剂,工业上以氯酸钠( )为原料制备
)为原料制备 的流程如下:
的流程如下:
(1)“还原”得到
 气体,母液中溶质的主要成分是
气体,母液中溶质的主要成分是 与
与 发生反应的离子方程式为
发生反应的离子方程式为(2)分析电解一段时间后溶液中
 的含量。
的含量。已知:①
 被
被 还原为
还原为 、
、 的转化率与溶液pH的20关系如图所示。
的转化率与溶液pH的20关系如图所示。
②当
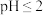 时,
时, 也能被
也能被 完全还原为
完全还原为 。
。③反应生成的用标准
 溶液滴定:
溶液滴定: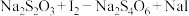 (未配平)
(未配平)准确量取500mL水样加入到锥形瓶中,加入NaOH溶液调节pH为7~8,加入足量KI晶体,充分搅拌后,滴加几滴淀粉溶液,用0.2000mol/L标准
 溶液滴定至终点,滴定终点的现象是
溶液滴定至终点,滴定终点的现象是 溶液20.00mL。计算电解后所得溶液中
溶液20.00mL。计算电解后所得溶液中 的含量(mg/L)
的含量(mg/L)
您最近一年使用:0次
2021-06-27更新
|
175次组卷
|
2卷引用:江苏省无锡市2020-2021学年期高二下学期期终教学质量抽测建议卷化学试题
解题方法
10 . 以湿法炼锌矿渣[主要含 和少量ZnS、
和少量ZnS、 、
、 、CuO等杂质]和
、CuO等杂质]和 为原料制备碱式碳酸锌[
为原料制备碱式碳酸锌[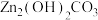 ]。
]。
(1)还原浸出
①铁酸锌( ,难溶于水)与
,难溶于水)与 在酸性条件下反应的离子方程式为
在酸性条件下反应的离子方程式为_______ 。
②锌、铁浸出率与溶液pH及温度有关。溶液pH增大浸出率降低,原因是_______ 。
③室温下测得浸出液中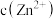 为0.03
为0.03 ,则该溶液中
,则该溶液中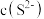 为
为_______ 。[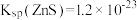 ]
]
(2)提纯制备
已知: 沉淀完全的pH为3.2,
沉淀完全的pH为3.2, 和
和 开始沉淀的pH分别为5.2、6.2;
开始沉淀的pH分别为5.2、6.2;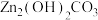 溶于稀酸和稀碱,难溶于水和乙醇;用
溶于稀酸和稀碱,难溶于水和乙醇;用 调节pH,可使
调节pH,可使 转化为
转化为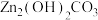 ,pH与锌沉淀率关系如图所示。
,pH与锌沉淀率关系如图所示。
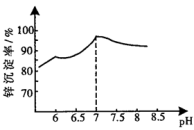
①请补充完整以“酸浸液”为原料,制取碱式碳酸锌固体的实验方案:在酸浸液中先加入20%双氧水充分反应,调节 除去溶液中的
除去溶液中的____ ,过滤,弃去滤渣,向滤液中____ ,得碱式碳酸锌固体。[实验中须使用的试剂:锌粉、 、乙醇]
、乙醇]
②加入 后析出
后析出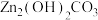 ,同时产生一种无毒气体,该反应的离子方程式为:
,同时产生一种无毒气体,该反应的离子方程式为:_____ 。
 和少量ZnS、
和少量ZnS、 、
、 、CuO等杂质]和
、CuO等杂质]和 为原料制备碱式碳酸锌[
为原料制备碱式碳酸锌[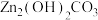 ]。
]。(1)还原浸出
①铁酸锌(
 ,难溶于水)与
,难溶于水)与 在酸性条件下反应的离子方程式为
在酸性条件下反应的离子方程式为②锌、铁浸出率与溶液pH及温度有关。溶液pH增大浸出率降低,原因是
③室温下测得浸出液中
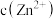 为0.03
为0.03 ,则该溶液中
,则该溶液中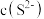 为
为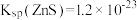 ]
](2)提纯制备
已知:
 沉淀完全的pH为3.2,
沉淀完全的pH为3.2, 和
和 开始沉淀的pH分别为5.2、6.2;
开始沉淀的pH分别为5.2、6.2;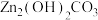 溶于稀酸和稀碱,难溶于水和乙醇;用
溶于稀酸和稀碱,难溶于水和乙醇;用 调节pH,可使
调节pH,可使 转化为
转化为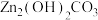 ,pH与锌沉淀率关系如图所示。
,pH与锌沉淀率关系如图所示。
①请补充完整以“酸浸液”为原料,制取碱式碳酸锌固体的实验方案:在酸浸液中先加入20%双氧水充分反应,调节
 除去溶液中的
除去溶液中的 、乙醇]
、乙醇]②加入
 后析出
后析出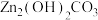 ,同时产生一种无毒气体,该反应的离子方程式为:
,同时产生一种无毒气体,该反应的离子方程式为:
您最近一年使用:0次



