名校
1 . 2020年9月,研究人员在金星大气中探测到了磷化氢(PH3)气体。PH3常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备PH3的流程如图所示:
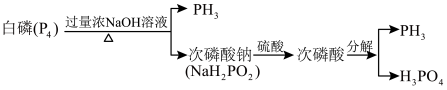
A.白磷与浓NaOH溶液反应的化学方程式为: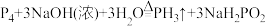 |
| B.次磷酸的分子式为H3PO2,属于一元酸 |
| C.流程中,PH3属于还原产物 |
| D.理论上,1mol白磷可生产2molPH3 |
您最近一年使用:0次
2021-06-30更新
|
1545次组卷
|
8卷引用:安徽省淮北市2021届高三第一次模拟考试化学试题
安徽省淮北市2021届高三第一次模拟考试化学试题福建省三明第一中学2021-2022学年高三上学期学段考化学试题广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)(已下线)专题14物质的反应和转化-五年(2018~2022)高考真题汇编(全国卷)河南省开封市5县2022-2023学年高一下学期3月联考化学试题河南省新乡市第十二中学2023-2024学年高一下学期3月月考化学试题
2 . 随着电动汽车的大量使用,废旧锂电池的再利用成为科技工作者研究的重要课题,某化工厂从废旧锂电池正极材料(主要成分为LiCoO2、炭黑及铝片)中回收锂、铝、钴的流程如图所示。
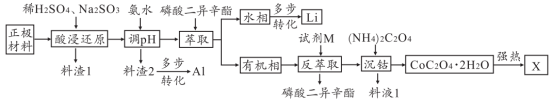
(1)CoC2O4中钴元素化合价为_______ ,料渣1的成分是_______ 。
(2)酸浸还原过程中,Na2SO3的作用是_______ (用离子方程式表示),还要防火防爆,原因是_______ 。
(3)常温下,当pH=4.7时,溶液中沉淀完全(c(Al3+)≤10-5 mol/L),则Ksp[Al(OH)3]最大值为_______ ,以料渣2为原料制备Al的过程简述为_______ 。
(4)磷酸二异辛酯必须具有的两种物理性质是_______ ,54.9 g CoC2O4·2H2O在空气中充分加热至330℃时,固体质量不再变化时称得固体为24.1 g,则得到X的化学方程式为_______ 。

(1)CoC2O4中钴元素化合价为
(2)酸浸还原过程中,Na2SO3的作用是
(3)常温下,当pH=4.7时,溶液中沉淀完全(c(Al3+)≤10-5 mol/L),则Ksp[Al(OH)3]最大值为
(4)磷酸二异辛酯必须具有的两种物理性质是
您最近一年使用:0次
3 .  常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是
。下列说法错误的是
 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是
。下列说法错误的是A.产生22.4L(标准状况) 时,反应中转移 时,反应中转移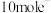 |
| B.反应中氧化剂和还原剂的物质的量之比为11:6 |
C.可用石灰乳吸收反应产生的 制备漂白粉 制备漂白粉 |
D.可用酸化的淀粉碘化钾溶液检验食盐中 的存在 的存在 |
您最近一年使用:0次
2021-06-09更新
|
15565次组卷
|
74卷引用:安徽省合肥市第九中学2022届高三第一次阶段测验化学试卷
安徽省合肥市第九中学2022届高三第一次阶段测验化学试卷安徽省六安市新安中学2022-2023学年高三上学期第二次月考化学试题安徽省宿城第一中学2022-2023学年高一上学期阶段检测化学试题2021年新高考湖南化学高考真题河北省辛集中学 2020-2021学年高二下学期期末考试化学试题(已下线)课时09 氧化还原反应概念及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向05 氧化还原反应-备战2022年高考化学一轮复习考点微专题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题11 富集在海水中的元素——氯 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第5讲 氧化还原反应(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)山东省济宁市实验中学2022届高三上学期开学考试化学试题湖南省邵阳邵东市第一中学2022届高三上学期第一次月考化学试题江西省赣州市第十四中学2022届高三上学期第二次月考化学试题北京市第二十中学2021-2022学年高一上学期期中考试化学试题山西省运城市2021-2022学年高三上学期期中考试化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)吉林省东北师范大学附属中学2021-2022学年高三上学期一模考试化学试题甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题天津市第一中学2021-2022学年高三上学期第二次月考化学试题2021年湖南省高考化学试卷变式题1-10(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)河南省名校联盟2021-2022学年高三上学期第三次诊断考试化学试题辽宁省凌源市2021-2022学年高三下学期高三开学考试化学试题河南省顶尖名校联盟2021-2022学年高二下学期联赛考试化学试题(已下线)卷06 氧化还原-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)查补易混易错点05 氧化还原反应-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题04 氧化还原反应-三年(2020-2022)高考真题分项汇编(已下线)微专题10 “守恒法”在氧化还原反应计算中的应用-备战2023年高考化学一轮复习考点微专题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第03讲 氧化还原反应(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河南省濮阳市第一高级中学2023届高三第一次质量检测化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题第二章 海水中的重要元素——钠和氯 ★综合拔高练江苏省南通市通州区金沙中学2021-2022学年高一上学期1月学业水平调研化学试题四川省广元市树人中学2021-2022学年高三上学期第二次段考化学试题江西省瑞金市第二中学2022-2023学年高三上学期开学考试化学试题江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题湖南省常德市桃源县第一中学2022-2023学年高三上学期9月月考化学试题河北省石家庄市第四中学2022-2023学年高三上学期十月月考化学试题(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题湖南省长沙市同升湖实验学校2022-2023学年高三上学期第三次月考化学试题(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)广西钟山县钟山中学2021-2022学年高二上学期第一次(9月)月考化学(文科)试题湖南省株洲市九方中学2022-2023学年高一上学期第三次月考化学试题(已下线)专题07 氧化还原反应分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题卷07 氧化还原反应的概念、规律及应用-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题09 氧化还原反应(已下线)专题09 氧化还原反应(已下线)第5讲 氧化还原反应方程式的配平与计算(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)【知识图鉴】单元讲练测必修第一册第一单元03巩固练(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)云南省开远市第一中学校2022-2023学年高二下学期5月月考化学试题广东省台山市第一中学2023-2024学年高三上学期第一次月考化学试题广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题吉林省长春外国语学校2023-2024学年高三上学期9月月考化学试题北京工业大学附属中学2022-2023学年高三上学期开学测试化学试题辽宁省沈阳市新民市高级中学2023-2024学年高三上学期10月月考化学试题广东省惠州市博罗县博师高级中学2023-2024学年高三上学期9月月考化学试题福建省厦门第六中学2023-2024学年高一上学期1月月考化学试题甘肃省天水市甘谷县第三中学2023-2024学年高一上学期12月第三次月考化学试卷
4 . 根据溶液中发生的两个反应:①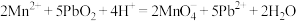 ;②
;② 。下列说法不正确的是
。下列说法不正确的是
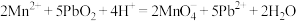 ;②
;② 。下列说法不正确的是
。下列说法不正确的是A.反应①中氧化剂和还原剂的物质的量之比为 |
B.酸性条件下,氧化性: |
| C.实验室将高锰酸钾酸化时,常用硫酸酸化而不用盐酸酸化 |
D.反应②中每生成 的气体,则反应中转移的电子的物质的量为 的气体,则反应中转移的电子的物质的量为 |
您最近一年使用:0次
2021-05-27更新
|
742次组卷
|
6卷引用:安徽省黄山市屯溪第一中学2021-2022学年高一上学期期中考试化学试题
安徽省黄山市屯溪第一中学2021-2022学年高一上学期期中考试化学试题辽宁省沈阳郊联体2021届高三5月四模化学试题河北省沧州市2021届高考第三次模拟考试化学试题(已下线)第05讲 氧化还原反应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)重庆市缙云教育联盟2021-2022学年高一12月月考化学试题山东省淄博市桓台第二中学2021-2022学年高三9月月考化学试题
解题方法
5 . 软锰矿(成分如表1所示)的成分是二氧化锰,其中还含有少量二氧化硅、铁、氧化铝以及少量的重金属等。废铁屑还原软锰矿生产高纯硫酸锰晶体的工艺流程如图1所示。
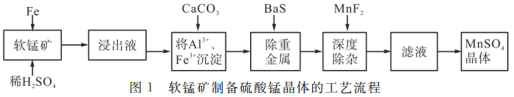
表1软锰矿的化学成分
(1)浸出液中检测到存在Fe3+,软锰矿与铁屑发生的离子反应是___________ ;
(2)加入碳酸钙之前需要加入双氧水的作用是___________ ,用碳酸钙除去铁、铝的原理是___________ 。(表2数据可供参考)。
表2不同金属离子沉淀的pH
(3)深度除杂中所加二氟化锰的作用是___________ 。
(4)从滤液中获得硫酸锰晶体的方法是___________ 。(硫酸锰在不同温度下的溶解度见表3)
表3硫酸锰在不同温度下的溶解度
(5)H2SO4/MnO2的物质的量比不同对锰的浸出率η有影响;实验表明,当H2SO4、MnO2的物质的量比2.1∶1锰的浸出率较高(见图2),请结合反应原理说明原因:___________ 。
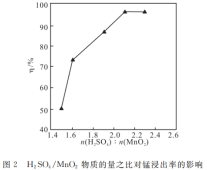

表1软锰矿的化学成分
| 成分 | 含量/% | 成分 | 含量/% |
| MnO2 | 35.23 | Fe | 2.16 |
| SiO2 | 15.67 | Al2O3 | 3.34 |
| MgO | 0.18 | CaO | 4.82 |
(2)加入碳酸钙之前需要加入双氧水的作用是
表2不同金属离子沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 1.5 | 6.5 | 3.3 | 7.7 |
| 沉淀完全 | 3.7 | 9.7 | 5.2 | 9.8 |
(4)从滤液中获得硫酸锰晶体的方法是
表3硫酸锰在不同温度下的溶解度
| 温度/℃ | 50 | 80 | 90 | 100 |
| 溶解度/(g/100g水) | 58 | 48 | 42 | 34 |

您最近一年使用:0次
2021-05-25更新
|
491次组卷
|
3卷引用:安徽省示范高中培优联盟2020-2021学年高二下学期春季联赛化学试题
解题方法
6 . CO2的转化对解决环境、能源问题意义重大,利用Al-CO2电池,能有效地将CO2转化成化工原料草酸铝Al2(C2O4)3,总反应为:2Al+6CO2=Al2(C2O4)3,下列说法正确的是
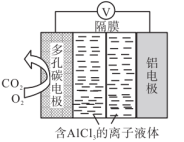

| A.电流方向:多孔碳电极→含AlCl3的离子的液体→铝电极 |
B.电池的正极反应式:2CO2+2e-=C2O |
| C.正极反应过程中,O2起氧化剂作用 |
| D.电池中转移0.1mol电子,消耗标准状况下CO2为6.72L |
您最近一年使用:0次
解题方法
7 . 某小组利用含铅废料(主要含PbO、PbSO4和PbO2)制备化工产品三盐(PbSO4·3PbO·H2O)的工艺流程如图:
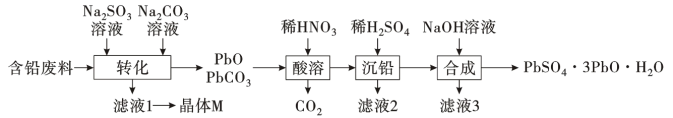
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13,Pb(OH)2具有两性,PbO2有强氧化性。请回答下列问题:
(1)结晶水合物M(M=322g/mol)的化学式为___ 。
(2)“转化”中,加入Na2SO3溶液的离子反应方程式___ 。
(3)“转化”中,加入Na2CO3目的是___ 。
(4)下列试剂可以替代Na2SO3溶液___ (填写字母)。
A.H2O2溶液 B.Na2SO4溶液 C.高锰酸钾溶液 D.Fe2(SO4)3溶液
(5)该流程中可以循环利用的物质是___ (填写物质名称)。
(6)“酸溶”时,反应温度为40℃,其主要原因是___ 。
(7)合成三盐的化学方程式为___ ,解释“合成”需控制溶液的pH不能大于10的原因___ 。

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13,Pb(OH)2具有两性,PbO2有强氧化性。请回答下列问题:
(1)结晶水合物M(M=322g/mol)的化学式为
(2)“转化”中,加入Na2SO3溶液的离子反应方程式
(3)“转化”中,加入Na2CO3目的是
(4)下列试剂可以替代Na2SO3溶液
A.H2O2溶液 B.Na2SO4溶液 C.高锰酸钾溶液 D.Fe2(SO4)3溶液
(5)该流程中可以循环利用的物质是
(6)“酸溶”时,反应温度为40℃,其主要原因是
(7)合成三盐的化学方程式为
您最近一年使用:0次
2021-05-17更新
|
329次组卷
|
2卷引用:安徽省淮北市树人高级中学2020-2021学年高二下学期期末考试化学试题
名校
解题方法
8 . 接触法制硫酸、氨氧化法制硝酸、工业制备高纯硅经过下列主要变化:FeS2  SO2
SO2 SO3
SO3 H2SO4 NH3
H2SO4 NH3  NO
NO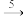 NO2
NO2  HNO3 SiO2
HNO3 SiO2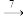 Si(粗)
Si(粗) SiHCl3
SiHCl3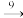 Si(纯)。下列说法符合事实的是(已知SiHCl3中H的化合价为-1)
Si(纯)。下列说法符合事实的是(已知SiHCl3中H的化合价为-1)
 SO2
SO2 SO3
SO3 H2SO4 NH3
H2SO4 NH3  NO
NO NO2
NO2  HNO3 SiO2
HNO3 SiO2 Si(粗)
Si(粗) SiHCl3
SiHCl3 Si(纯)。下列说法符合事实的是(已知SiHCl3中H的化合价为-1)
Si(纯)。下列说法符合事实的是(已知SiHCl3中H的化合价为-1)| A.所有变化都是氧化还原反应 |
| B.2、4、5、8 都是化合反应, 反应3、6均用水作吸收剂 |
C.反应7的化学方程式为SiO2 +C  Si+CO2 Si+CO2 |
| D.反应1每生成标况下17.92 L SO2转移4.4mol电子;反应9每生成1molSi转移4mol电子 |
您最近一年使用:0次
2021-05-10更新
|
1301次组卷
|
3卷引用:安徽省合肥市第一中学2020-2021学年高一下学期期中考试化学试题
解题方法
9 . MnO2是重要的化工原料,由软锰矿(主要成分为MnO2,还含有少量Fe3O4、Al2O3和SiO2等杂质)和硫化锰(MnS)制备精MnO2的一种工艺流程如图:

已知:相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“滤渣1”中含有未反应完全的矿粉、S和______ 。
(2)“纯化”时加MnO2的作用是______ ,假定溶液中c(Mn2+)=0.1mol·L-1,则加入氨水调节溶液pH的范围为______ 。
(3)“沉锰”时生成MnCO3,工业上不直接用Na2CO3溶液来沉锰的原因为______ 。
(4)“热分解”后所得物质中还有少量MnO,需进一步进行氧化,“氧化”时生成的气体2为氯气,写出该过程中发生反应的化学方程式______ 。
(5)操作x为______ 。
(6)工业上还可用电解“Mn2+纯化液”来制取MnO2,其阳极电极反应式为______ 。电解后的废水中还含有少量Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S进行二级沉降。已知Ksp(MnS)=2.5×10-10,欲使溶液中c(Mn2+)≤1.0×10-5mol·L-1,则应保持溶液中c(S2-)______ ≥mol·L-1。

已知:相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| Fe3+ | Al3+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
回答下列问题:
(1)“滤渣1”中含有未反应完全的矿粉、S和
(2)“纯化”时加MnO2的作用是
(3)“沉锰”时生成MnCO3,工业上不直接用Na2CO3溶液来沉锰的原因为
(4)“热分解”后所得物质中还有少量MnO,需进一步进行氧化,“氧化”时生成的气体2为氯气,写出该过程中发生反应的化学方程式
(5)操作x为
(6)工业上还可用电解“Mn2+纯化液”来制取MnO2,其阳极电极反应式为
您最近一年使用:0次
10 . 废钒催化剂的主要成分为V2O5、V2O4、K2SO4、Al2O3、SiO2、Fe2O3。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。下图为废钒催化剂回收工艺路线:
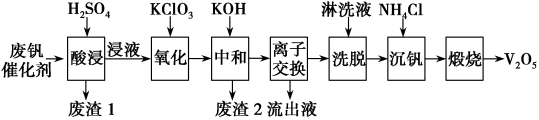
已知:①酸浸时,V2O5、V2O4分别转化为VO ,VO2+
,VO2+
②“离子交换”和“洗脱”过程可简单表示为4ROH+V4O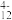
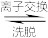 R4V4O12+4OH-(ROH为阴离子交换树脂)
R4V4O12+4OH-(ROH为阴离子交换树脂)
(1)酸浸时需要粉碎废钒催化剂,目的是_______ 。
(2)写出酸浸时V2O4的转化反应方程式_______ 。废渣1的主要成分是_______ (填化学式)。
(3)氧化时加入0.1molKClO3,理论上能氧化_______ mol的VO2+离子。
(4)中和时pH应控制在大于_______ 。(精确到0.1)(已知中和时钒元素未形成沉淀,Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33,离子浓度小于1.0×10-5mol/L时认为沉淀完全)。
(5)为了提高洗脱效率,淋洗液应该呈_______ (填酸性或碱性)。
(6)已知沉钒时溶液中产生钒酸铵沉淀(NH4VO3),写出煅烧时的化学反应方程式_______ 。

已知:①酸浸时,V2O5、V2O4分别转化为VO
 ,VO2+
,VO2+②“离子交换”和“洗脱”过程可简单表示为4ROH+V4O
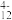
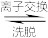 R4V4O12+4OH-(ROH为阴离子交换树脂)
R4V4O12+4OH-(ROH为阴离子交换树脂)(1)酸浸时需要粉碎废钒催化剂,目的是
(2)写出酸浸时V2O4的转化反应方程式
(3)氧化时加入0.1molKClO3,理论上能氧化
(4)中和时pH应控制在大于
(5)为了提高洗脱效率,淋洗液应该呈
(6)已知沉钒时溶液中产生钒酸铵沉淀(NH4VO3),写出煅烧时的化学反应方程式
您最近一年使用:0次



