名校
解题方法
1 . 廉价的“84消毒液”能有效杀灭病毒。有效氯含量是衡量含氯消毒液的消毒能力的物理量,有效氯含量指一定量消毒剂的氧化能力相当于多少Cl2氧化能力。
(1)某同学欲用NaClO固体配制有效氯含量为35.5g·L-184消毒液960mL,用托盘天平称量NaClO的质量为___________ 。
(2)配制该消毒液的几个关键操作步骤中有错误的操作是___________
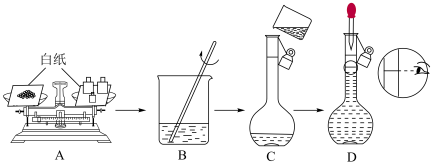
(3)若定容操作时仰视观察,配制溶液的浓度将___________ (填“偏大”“偏小”“无影响”);若有误差将如何处理完成实验?___________ 。
(4)①在适当的条件下NaClO溶液可以除去生活污水中的氨氮(以NH3计算)生成无污染性气体,该反应的离子方程式为___________ 。
②实验发现废水中的氨氮去除率与溶液pH、温度及次氯酸钠投入量等因素有关。
其他条件一定时,氨氮去除率与温度的关系如下图所示(已知NaClO+H2O NaOH+HClO)。
NaOH+HClO)。
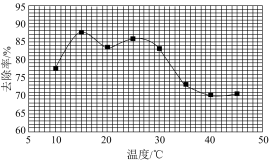
实验现象可知用NaClO消除生活污水中的氨氮选择的合适温度为___________ ;当温度高于30℃时,温度越高,氨氮去除率减小的原因可能是___________ 。
(1)某同学欲用NaClO固体配制有效氯含量为35.5g·L-184消毒液960mL,用托盘天平称量NaClO的质量为
(2)配制该消毒液的几个关键操作步骤中有错误的操作是

(3)若定容操作时仰视观察,配制溶液的浓度将
(4)①在适当的条件下NaClO溶液可以除去生活污水中的氨氮(以NH3计算)生成无污染性气体,该反应的离子方程式为
②实验发现废水中的氨氮去除率与溶液pH、温度及次氯酸钠投入量等因素有关。
其他条件一定时,氨氮去除率与温度的关系如下图所示(已知NaClO+H2O
 NaOH+HClO)。
NaOH+HClO)。
实验现象可知用NaClO消除生活污水中的氨氮选择的合适温度为
您最近一年使用:0次
名校
解题方法
2 . 生活处处皆化学,它已渗透到社会生活各方面。下列叙述不合理的是
| A.实验室中若金属钠失火,一定不能采用泡沫灭火器灭火 |
| B.血液透析净化尿毒症患者的血液,利用了胶体的性质 |
| C.牙膏中的摩擦剂(如SiO2等)一般都易溶于水 |
| D.家庭中84消毒液杀菌、消毒过生中发生了氧化还原反应 |
您最近一年使用:0次
名校
解题方法
3 . 某实验小组在研究物质的分解实验,回答下列问题。
Ⅰ、查阅资料显示,大多数硝酸盐受热能分解。已知Cu(NO3)2受热分解产生黑色固体和两种气体,其中一种气体呈红棕色(NO2),另一种为单质。Cu2O为红色固体。
(1)写出Cu(NO3)2受热分解的化学反应方程式_____ 。
(2)有同学将带火星木条深入集气瓶中,木条复燃,从而说明NO2具有助燃性,请说明你的观点并阐述理由:_____ (填“有”、“无”或“不确定”)助燃性,理由是_____ 。
Ⅱ、将Cu(NO3)2受热分解产生的黑色固体用氢气还原,将看到黑色固体变为红色。
(3)探究红色固体成分时得到以下猜想:①红色固体为Cu;②红色固体为_____ ;③红色固体为Cu2O和Cu的混合物。
(4)验证猜想时,某同学将红色固体溶于稀硫酸,发现固体部分溶解,溶液变成蓝色,经过计算从而证明红色固体中含有Cu2O。请写出Cu2O在稀硫酸中发生歧化反应反应的离子方程式:_____ 。
Ⅰ、查阅资料显示,大多数硝酸盐受热能分解。已知Cu(NO3)2受热分解产生黑色固体和两种气体,其中一种气体呈红棕色(NO2),另一种为单质。Cu2O为红色固体。
(1)写出Cu(NO3)2受热分解的化学反应方程式
(2)有同学将带火星木条深入集气瓶中,木条复燃,从而说明NO2具有助燃性,请说明你的观点并阐述理由:
Ⅱ、将Cu(NO3)2受热分解产生的黑色固体用氢气还原,将看到黑色固体变为红色。
(3)探究红色固体成分时得到以下猜想:①红色固体为Cu;②红色固体为
(4)验证猜想时,某同学将红色固体溶于稀硫酸,发现固体部分溶解,溶液变成蓝色,经过计算从而证明红色固体中含有Cu2O。请写出Cu2O在稀硫酸中发生歧化反应反应的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . I.分类法有助于人们发现和预测物质的性质,在化学学习中,科学的分类方法几乎是无可替代的。
(1)按要求对以下物质进行分类:①黄铜;② ;③
;③ 溶液;④熔融
溶液;④熔融 ;⑤酒精;⑥氨气;⑦
;⑤酒精;⑥氨气;⑦ 气体。上述物质中能导电的是
气体。上述物质中能导电的是___________ (填序号,下同);属于电解质的是___________ ;属于非电解质的是___________ 。
(2)写出物质②在水溶液中的电离方程式:___________ ;干燥的 不能导电的原因是
不能导电的原因是___________ 。
Ⅱ.氧化还原反应是一类重要的化学反应。
(3)已知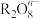 在一定条件下可以把
在一定条件下可以把 离子氧化为
离子氧化为 ,
,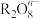 被还原为
被还原为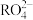 ,反应中氧化剂与还原剂的物质的量之比为
,反应中氧化剂与还原剂的物质的量之比为 ,则
,则
___________ ,写出上述反应的离子方程式,并用单线桥法标出电子转移的方向和数目:___________ 。若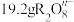 中含氧原子的个数为
中含氧原子的个数为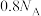 ,则
,则 的相对原子质量为
的相对原子质量为___________ 。
(1)按要求对以下物质进行分类:①黄铜;②
 ;③
;③ 溶液;④熔融
溶液;④熔融 ;⑤酒精;⑥氨气;⑦
;⑤酒精;⑥氨气;⑦ 气体。上述物质中能导电的是
气体。上述物质中能导电的是(2)写出物质②在水溶液中的电离方程式:
 不能导电的原因是
不能导电的原因是Ⅱ.氧化还原反应是一类重要的化学反应。
(3)已知
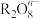 在一定条件下可以把
在一定条件下可以把 离子氧化为
离子氧化为 ,
,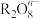 被还原为
被还原为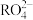 ,反应中氧化剂与还原剂的物质的量之比为
,反应中氧化剂与还原剂的物质的量之比为 ,则
,则
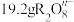 中含氧原子的个数为
中含氧原子的个数为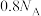 ,则
,则 的相对原子质量为
的相对原子质量为
您最近一年使用:0次
名校
解题方法
5 . 过氧化钠与气态非金属氧化物反应有如下规律:与最高价气态非金属氧化物反应能生成盐,放出氧气(如反应①),与次高价气态非金属氧化物反应能直接化合生成盐,不放出氧气(如反应②,下列化学方程式均未配平)。
①
②
下列说法正确的是
①

②

下列说法正确的是
| A.反应①属于氧化还原反应,反应②不属于氧化还原反应 |
B.转移相等的电子时,反应①与反应②消耗的 的质量比为 的质量比为 |
C.根据题中规律,可推知 (未配平) (未配平) |
D.反应①中 是氧化产物,反应②中 是氧化产物,反应②中 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
您最近一年使用:0次
名校
解题方法
6 . FeCl3和CuCl2都是重要的化工原料。工业上常采用将Cu与含少量FeCl3的稀盐酸中持续通入空气的条件下反应制备CuCl2,在该反应中FeCl3起催化作用。其反应原理如下图所示,请完成下列问题:

(1)写出用饱和FeCl3溶液制取Fe(OH)3胶体的离子方程式___________ ;检验所得分散系是胶体的实验方法为 ___________ 。
(2)0.2 L0.5 mol/LFeCl3溶液中的Cl-的物质的量浓度为___________ 。
(3)图示制备CuCl2分为两步完成,写出反应Ⅰ的离子方程式___________ ;反应Ⅱ属于氧化还原反应,其中氧化剂是 ___________ ,氧化产物为___________ ;
(4)写出总反应的化学方程式,并在方程式中表示出电子转移的方向与数目_______ 。

(1)写出用饱和FeCl3溶液制取Fe(OH)3胶体的离子方程式
(2)0.2 L0.5 mol/LFeCl3溶液中的Cl-的物质的量浓度为
(3)图示制备CuCl2分为两步完成,写出反应Ⅰ的离子方程式
(4)写出总反应的化学方程式,并在方程式中表示出电子转移的方向与数目
您最近一年使用:0次
2023-12-31更新
|
40次组卷
|
2卷引用:安徽省宿州市萧城一中 宿州二中 宿州雪枫中学2023-2024学年高一上学期11月期中联考化学试题
名校
解题方法
7 . 铁的化合物在生活、生产中用途十分广泛。回答下列问题:
(1)高铁酸钠( )是一种新型绿色消毒剂,能以
)是一种新型绿色消毒剂,能以 溶液为原料,经氧化制得,步骤如下:
溶液为原料,经氧化制得,步骤如下:
i.向 溶液中加入稀硫酸酸化;
溶液中加入稀硫酸酸化;
ii.在30℃左右加入H2O2溶液搅拌;
iii.再依次向其中加入NaOH溶液、NaClO溶液;
iv.经分离可得 。
。
已知:H2O2溶液可将 氧化为
氧化为 。
。
① 中铁元素的化合价为
中铁元素的化合价为___________ ,其在处理水时既能起到杀菌消毒作用,又能起到净水作用的原因是___________ 。
②加入H2O2溶液时发生反应的离子方程式为___________ ,该步反应不能在较高温度下进行的原因是___________ 。
③加入NaOH溶液后,再加入NaClO溶液时发生反应的化学方程式为___________ ,用单线桥标出电子转移的方向和数目:___________ 。
(2)无水 (易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水
(易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水 的实验装置如图所示(E用来收集产物):
的实验装置如图所示(E用来收集产物):

①在E处收集产物是利用了
___________ 的性质。
②实验过程中若D、E之间出现堵塞,可通过___________ (填简单操作),使实验能继续进行。
③某同学用5.60g干燥铁粉制得无水 13.00g,该次实验的产率(
13.00g,该次实验的产率( )是
)是___________ 。
④无水 的作用是
的作用是___________ 。
(1)高铁酸钠(
 )是一种新型绿色消毒剂,能以
)是一种新型绿色消毒剂,能以 溶液为原料,经氧化制得,步骤如下:
溶液为原料,经氧化制得,步骤如下:i.向
 溶液中加入稀硫酸酸化;
溶液中加入稀硫酸酸化;ii.在30℃左右加入H2O2溶液搅拌;
iii.再依次向其中加入NaOH溶液、NaClO溶液;
iv.经分离可得
 。
。已知:H2O2溶液可将
 氧化为
氧化为 。
。①
 中铁元素的化合价为
中铁元素的化合价为②加入H2O2溶液时发生反应的离子方程式为
③加入NaOH溶液后,再加入NaClO溶液时发生反应的化学方程式为
(2)无水
 (易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水
(易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水 的实验装置如图所示(E用来收集产物):
的实验装置如图所示(E用来收集产物):
①在E处收集产物是利用了

②实验过程中若D、E之间出现堵塞,可通过
③某同学用5.60g干燥铁粉制得无水
 13.00g,该次实验的产率(
13.00g,该次实验的产率( )是
)是④无水
 的作用是
的作用是
您最近一年使用:0次
8 . 过碳酸钠( ,相对分子质量314)俗名固体双氧水,是一种新型家用清洁剂和消毒剂,相比于传统消毒剂有高效、绿色的优点;过碳酸钠是一种白色细小颗粒状粉末,具有碳酸钠和双氧水的双重性质,其3%水溶液的pH约为10.某兴趣小组制备过碳酸钠的实验方案如下:
,相对分子质量314)俗名固体双氧水,是一种新型家用清洁剂和消毒剂,相比于传统消毒剂有高效、绿色的优点;过碳酸钠是一种白色细小颗粒状粉末,具有碳酸钠和双氧水的双重性质,其3%水溶液的pH约为10.某兴趣小组制备过碳酸钠的实验方案如下:
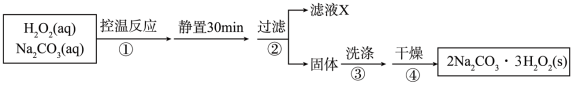
已知: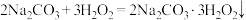 。
。
回答下列问题:
(1)过碳酸钠中O元素有两种化合价,分别是_______ ;某同学取适量过碳酸钠溶液,滴加酚酞,微热后振荡,观察到的现象是_______ 。
(2)制备过程中“过滤”用到的主要玻璃仪器是_______ 。“控温反应”中一般控制温度不高于50℃的原因是_______ ,向滤液X中加入无水乙醇可析出过碳酸钠,原因是_______ 。
(3)以下关于过碳酸钠的说法正确的是_______(填选项字母)。
(4)有研究认为过碳酸钠溶液强力的杀菌消毒效果来自于 在碱性条件下转化为氧化性更强的
在碱性条件下转化为氧化性更强的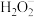 离子。请将过碳酸钠溶液中产生
离子。请将过碳酸钠溶液中产生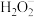 离子的方程式补充完整并配平:
离子的方程式补充完整并配平:______
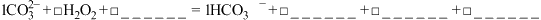
(5)市售过碳酸钠一般都含有碳酸钠,现用以下方案测定某过碳酸钠样品的纯度:
称量73.4g样品;全部溶于水中并加入足量稀盐酸充分反应;加热蒸发至蒸发皿中出现大量晶体时,停止加热,利用余热蒸干蒸发皿中剩余水分;称量所得固体质量为58.5g。
①“全部溶于水中并加入足量稀盐酸”产生两种无色无味的气体,写出该反应的化学方程式_______ ;
②该样品中过碳酸钠的质量分数_______ (保留小数点后一位)。
 ,相对分子质量314)俗名固体双氧水,是一种新型家用清洁剂和消毒剂,相比于传统消毒剂有高效、绿色的优点;过碳酸钠是一种白色细小颗粒状粉末,具有碳酸钠和双氧水的双重性质,其3%水溶液的pH约为10.某兴趣小组制备过碳酸钠的实验方案如下:
,相对分子质量314)俗名固体双氧水,是一种新型家用清洁剂和消毒剂,相比于传统消毒剂有高效、绿色的优点;过碳酸钠是一种白色细小颗粒状粉末,具有碳酸钠和双氧水的双重性质,其3%水溶液的pH约为10.某兴趣小组制备过碳酸钠的实验方案如下:
已知:
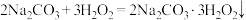 。
。回答下列问题:
(1)过碳酸钠中O元素有两种化合价,分别是
(2)制备过程中“过滤”用到的主要玻璃仪器是
(3)以下关于过碳酸钠的说法正确的是_______(填选项字母)。
| A.过碳酸钠是混合物 |
B.过碳酸钠水溶液的显碱性可能与 有关 有关 |
| C.制备过碳酸钠的过程涉及氧化还原反应 |
D.可用 粉末大致判断过碳酸钠水溶液是否已经失效 粉末大致判断过碳酸钠水溶液是否已经失效 |
(4)有研究认为过碳酸钠溶液强力的杀菌消毒效果来自于
 在碱性条件下转化为氧化性更强的
在碱性条件下转化为氧化性更强的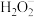 离子。请将过碳酸钠溶液中产生
离子。请将过碳酸钠溶液中产生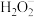 离子的方程式补充完整并配平:
离子的方程式补充完整并配平: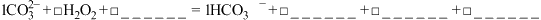
(5)市售过碳酸钠一般都含有碳酸钠,现用以下方案测定某过碳酸钠样品的纯度:
称量73.4g样品;全部溶于水中并加入足量稀盐酸充分反应;加热蒸发至蒸发皿中出现大量晶体时,停止加热,利用余热蒸干蒸发皿中剩余水分;称量所得固体质量为58.5g。
①“全部溶于水中并加入足量稀盐酸”产生两种无色无味的气体,写出该反应的化学方程式
②该样品中过碳酸钠的质量分数
您最近一年使用:0次
2023-12-23更新
|
159次组卷
|
2卷引用:安徽省2023-2024学年高一上学期期中联考化学试题
9 . 碱式硫酸铁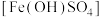 难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
(1)锥形瓶中发生反应的化学方程式为___________ ;某同学认为用 溶液代替稀硝酸更好,理由是
溶液代替稀硝酸更好,理由是___________ 。
(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为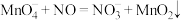 。
。
该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为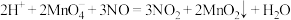 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为___________ 。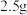 产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用
产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用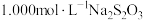 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为 、
、 )。
)。
①盛装 标准溶液的滴定管应选用
标准溶液的滴定管应选用___________ (填“酸式”或“碱式”)滴定管。
②判断达到滴定终点的方法为___________ 。
③该产品的纯度为___________  ,滴定过程中,如果滴定速度过慢,可能导致所测结果
,滴定过程中,如果滴定速度过慢,可能导致所测结果___________ (填“偏高”“偏低”或“无影响”)。
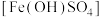 难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:(1)锥形瓶中发生反应的化学方程式为
 溶液代替稀硝酸更好,理由是
溶液代替稀硝酸更好,理由是(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为
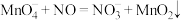 。
。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为
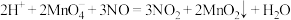 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为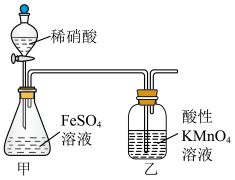
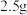 产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用
产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用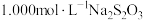 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为 、
、 )。
)。①盛装
 标准溶液的滴定管应选用
标准溶液的滴定管应选用②判断达到滴定终点的方法为
③该产品的纯度为
 ,滴定过程中,如果滴定速度过慢,可能导致所测结果
,滴定过程中,如果滴定速度过慢,可能导致所测结果
您最近一年使用:0次
2023-12-21更新
|
94次组卷
|
2卷引用:安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
10 . “青花浓淡出毫端,画上磁坯面面宽”是《陶歌》中描述青花瓷制作的诗句,“青花”的主要成分是一种蓝色钴料(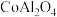 )。以钴矿(含有
)。以钴矿(含有 、
、 、CuO、
、CuO、 等)制备
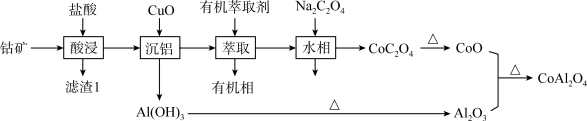
等)制备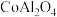 的工艺流程如下图:
的工艺流程如下图:
已知:① 具有极强的氧化性,在水中极易被还原成
具有极强的氧化性,在水中极易被还原成 。
。
②下表列出了几种离子生成氢氧化物沉淀的pH:
回答下列问题:
(1)“酸浸”过程中,可以加快反应速率和提高原料利用率的方法是_____ (写出一种方法即可)。滤渣1的成分是_____ 。
(2)“酸浸”过程中 与盐酸反应生成
与盐酸反应生成 和一种黄绿色气体,写出该反应的离子方程式
和一种黄绿色气体,写出该反应的离子方程式_____ ;依据“绿色化学”理念,解决酸浸过程中污染气体的方法是_____ 。
(3)沉铝过程中需要CuO调节的pH范围是_____ 。
(4)有机萃取剂的作用是_____ ,萃取用到的玻璃仪器有_____ 。
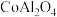 )。以钴矿(含有
)。以钴矿(含有 、
、 、CuO、
、CuO、 等)制备
等)制备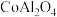 的工艺流程如下图:
的工艺流程如下图:
已知:①
 具有极强的氧化性,在水中极易被还原成
具有极强的氧化性,在水中极易被还原成 。
。②下表列出了几种离子生成氢氧化物沉淀的pH:
| 金属离子 |  |  |  |
| 开始沉淀pH | 3.6 | 7.6 | 6.0 |
| 完全沉淀pH | 4.7 | 9.2 | 8.0 |
(1)“酸浸”过程中,可以加快反应速率和提高原料利用率的方法是
(2)“酸浸”过程中
 与盐酸反应生成
与盐酸反应生成 和一种黄绿色气体,写出该反应的离子方程式
和一种黄绿色气体,写出该反应的离子方程式(3)沉铝过程中需要CuO调节的pH范围是
(4)有机萃取剂的作用是
您最近一年使用:0次



