1 . 大连理工大学课题组通过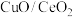 催化,使
催化,使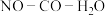 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: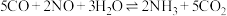 ,
, 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是
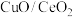 催化,使
催化,使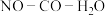 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: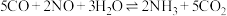 ,
, 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是A.标准状况下,2.24LNO中含有电子数为 |
B.消耗0.3molNO则生成的 中σ键数目为 中σ键数目为 |
C.生成3.4g 能消除CO的数目为 能消除CO的数目为 |
D.0.5molCO、0.2molNO和0.3mol 在容器中反应转移电子数为 在容器中反应转移电子数为 |
您最近一年使用:0次
名校
解题方法
2 . 磷酸三甲酯常用作阻燃剂,可采用下列流程合成少量该物质:
(1)反应⑤为加热条件下的分解反应,反应中还产生了三角锥形结构的气体,请写出⑤的化学方程式___________ 。
(2)关于上述流程图,下列说法正确的是___________。
(3)已知含氧酸分子结构中非羟基氧原子数越多,该含氧酸酸性就越强。亚磷酸为中强酸,而亚砷酸( )为弱酸,它们酸性差别很大。
)为弱酸,它们酸性差别很大。
①写出亚磷酸溶液与足量的氢氧化钠溶液反应的离子反应方程式___________ 。
②请写出亚砷酸的结构式为___________ 。
(4) 与水反应生成
与水反应生成 和一种气体,请设计实验验证该气体
和一种气体,请设计实验验证该气体___________ 。
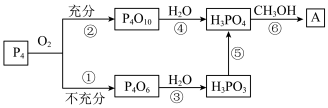
已知:磷酸和亚磷酸的结构式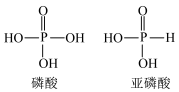
(1)反应⑤为加热条件下的分解反应,反应中还产生了三角锥形结构的气体,请写出⑤的化学方程式
(2)关于上述流程图,下列说法正确的是___________。
| A.①~⑥反应过程中涉及到磷元素的三种不同价态 |
| B.化合物A可能有多种不同的结构 |
C.高浓度 溶液黏度较大,原因可能是浓溶液中存在较多氢键 溶液黏度较大,原因可能是浓溶液中存在较多氢键 |
D. 分子构型为正四面体形结构,键角为 分子构型为正四面体形结构,键角为 |
(3)已知含氧酸分子结构中非羟基氧原子数越多,该含氧酸酸性就越强。亚磷酸为中强酸,而亚砷酸(
 )为弱酸,它们酸性差别很大。
)为弱酸,它们酸性差别很大。①写出亚磷酸溶液与足量的氢氧化钠溶液反应的离子反应方程式
②请写出亚砷酸的结构式为
(4)
 与水反应生成
与水反应生成 和一种气体,请设计实验验证该气体
和一种气体,请设计实验验证该气体
您最近一年使用:0次
2023-12-03更新
|
318次组卷
|
5卷引用:安徽省马鞍山市第二中学2023-2024学年高三上学期12月份阶段性测试化学试题
安徽省马鞍山市第二中学2023-2024学年高三上学期12月份阶段性测试化学试题浙江省台州市2023-2024学年高三上学期第一次教学质量评估试题-化学试题卷浙江省杭州第四中学2023-2024学年高二上学期期末考试化学试题(已下线)专题08 工艺流程综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
解题方法
3 . ZnCO3·2Zn(OH)2是制备活性ZnO的中间体。实验室以含锌废液(主要成分为ZnSO4,含有少量Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2的实验流程如图所示:
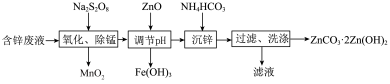
已知:还原性 Fe2+ > Mn2+;过二硫酸钠(Na2S2O8)中的硫显+6价。
请回答下列问题:
(1)试分析Na2S2O8中-1价和-2价的氧原子个数之比为___________ 。
(2)“氧化、除锰”阶段:
①该阶段需用玻璃棒不断搅拌,其目的是___________ 。
②生成MnO2的化学方程式为MnSO4+ Na2S2O8+ 2H2O =MnO2↓+2H2SO4+2Na2SO4,该反应的离子方程式为___________ ;试写出Na2S2O8将Fe2+氧化为Fe3+的离子方程式___________ 。
③不能用Cl2代替Na2S2O8,其原因是___________ 。
(3)“滤液”中的主要溶质为___________ (填化学式);检查ZnCO3·2Zn(OH)2洗涤干净的操作方法为___________ ,说明沉淀洗涤干净。
(4)ZnCO3·2Zn(OH)2经焙烧可得活性ZnO。焙烧a g ZnCO3·2Zn(OH)2理论上可得到___________ g活性ZnO(用含a的代数式表示){已知Mr[ZnCO3·2Zn(OH)2]=323}。

已知:还原性 Fe2+ > Mn2+;过二硫酸钠(Na2S2O8)中的硫显+6价。
请回答下列问题:
(1)试分析Na2S2O8中-1价和-2价的氧原子个数之比为
(2)“氧化、除锰”阶段:
①该阶段需用玻璃棒不断搅拌,其目的是
②生成MnO2的化学方程式为MnSO4+ Na2S2O8+ 2H2O =MnO2↓+2H2SO4+2Na2SO4,该反应的离子方程式为
③不能用Cl2代替Na2S2O8,其原因是
(3)“滤液”中的主要溶质为
(4)ZnCO3·2Zn(OH)2经焙烧可得活性ZnO。焙烧a g ZnCO3·2Zn(OH)2理论上可得到
您最近一年使用:0次
名校
解题方法
4 . 120℃时将1.6g由CO2、H2O组成的混合气体通入盛有足量Na2O2的密闭容器中,充分反应后容器中残留的固体比反应前增重0.64 g。下列说法错误的是
| A.反应过程中生成O2的质量为0.96 g |
| B.反应过程中被还原的元素的质量为0.96 g |
| C.该混合气体中CO2的质量分数为45% |
| D.反应过程中Na2O2既是氧化剂又是还原剂 |
您最近一年使用:0次
2023-11-28更新
|
220次组卷
|
3卷引用:安徽省淮南第二中学、淮南第一中学2023-2024学年高一上学期11月期中考试化学试题
解题方法
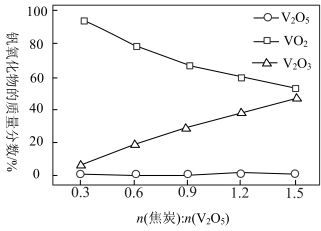
5 . 在800℃下, 和焦炭反应可生成
和焦炭反应可生成 和
和 ,同时得到
,同时得到 或CO或两者的混合物。反应体系中钒氧化物的质量分数(%)随
或CO或两者的混合物。反应体系中钒氧化物的质量分数(%)随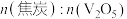 的变化关系如图所示。下列说法中错误的是
的变化关系如图所示。下列说法中错误的是
 和焦炭反应可生成
和焦炭反应可生成 和
和 ,同时得到
,同时得到 或CO或两者的混合物。反应体系中钒氧化物的质量分数(%)随
或CO或两者的混合物。反应体系中钒氧化物的质量分数(%)随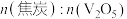 的变化关系如图所示。下列说法中错误的是
的变化关系如图所示。下列说法中错误的是
A.焦炭用量越大,反应后体系中 的质量分数越小 的质量分数越小 |
B. 的氧化性比 的氧化性比 和 和 强 强 |
C.若氧化产物有CO和 ,产物中 ,产物中 ,则参加反应的 ,则参加反应的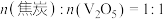 |
D.若氧化产物只有 ,参加反应的 ,参加反应的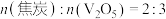 时,反应所得 时,反应所得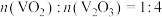 |
您最近一年使用:0次
2023-11-14更新
|
34次组卷
|
2卷引用:安徽省芜湖市无为市华星学校2023-2024学年高一上学期11月期中考试化学试题
6 . 氧化还原反应是一类重要的化学反应,广泛存在于生产、生活中。回答下列问题:
(1)以乙烯( )脱硫的方法治理燃煤尾气中的
)脱硫的方法治理燃煤尾气中的 ,其机理如图所示。过程ⅰ、ⅱ、ⅲ中涉及氧化还原反应的是
,其机理如图所示。过程ⅰ、ⅱ、ⅲ中涉及氧化还原反应的是___________ ,图中涉及的物质属于酸性氧化物的是___________ (填化学式)。
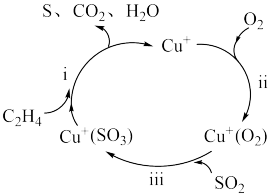
(2)某工业废水含有大些对人体健康有危害的 ,为了降低废水中
,为了降低废水中 的浓度,可以在碱性条件下用铅粉将
的浓度,可以在碱性条件下用铅粉将 还原为
还原为 ,其化学方程式为
,其化学方程式为 。
。
① 中Al的化合价为
中Al的化合价为___________ 。
②上述反应中,被氧化的元素是___________ (填元素符号),被氧化的元素___________ (填“得到”或“失去”)电子;还原产物的化学式为___________ 。
③反应中每生成1个 ,转移
,转移___________ 个电子。
(3)“假黄金”实际上是铜合金,可用稀硝酸鉴别。配平该反应的化学方程式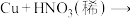
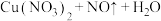 :
:___________ 。
(4)已知 、
、 、
、 均有还原性,它们在酸性溶液中会发生如下反应:
均有还原性,它们在酸性溶液中会发生如下反应:
①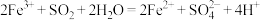
②
③
则 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ (用“>”连接)。
(1)以乙烯(
 )脱硫的方法治理燃煤尾气中的
)脱硫的方法治理燃煤尾气中的 ,其机理如图所示。过程ⅰ、ⅱ、ⅲ中涉及氧化还原反应的是
,其机理如图所示。过程ⅰ、ⅱ、ⅲ中涉及氧化还原反应的是
(2)某工业废水含有大些对人体健康有危害的
 ,为了降低废水中
,为了降低废水中 的浓度,可以在碱性条件下用铅粉将
的浓度,可以在碱性条件下用铅粉将 还原为
还原为 ,其化学方程式为
,其化学方程式为 。
。①
 中Al的化合价为
中Al的化合价为②上述反应中,被氧化的元素是
③反应中每生成1个
 ,转移
,转移(3)“假黄金”实际上是铜合金,可用稀硝酸鉴别。配平该反应的化学方程式
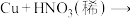
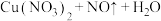 :
:(4)已知
 、
、 、
、 均有还原性,它们在酸性溶液中会发生如下反应:
均有还原性,它们在酸性溶液中会发生如下反应:①
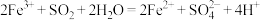
②

③

则
 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为
您最近一年使用:0次
2023-11-06更新
|
142次组卷
|
2卷引用:安徽省滁州市九校联盟2023-2024学年高一上学期11月期中考试化学试题
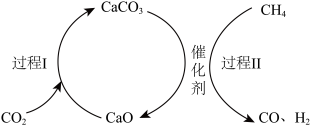
7 . 通过 捕获和转化技术可实现
捕获和转化技术可实现 资源化利用,其物质转化关系如图所示,下列说法
资源化利用,其物质转化关系如图所示,下列说法不正确 的是
 捕获和转化技术可实现
捕获和转化技术可实现 资源化利用,其物质转化关系如图所示,下列说法
资源化利用,其物质转化关系如图所示,下列说法
A. 的捕获和转化有助于减弱温室效应 的捕获和转化有助于减弱温室效应 |
| B.过程I属于化合反应 |
C.捕获和转化 的过程中,CaO可以循环利用 的过程中,CaO可以循环利用 |
D.过程Ⅱ中的反应为 |
您最近一年使用:0次
2023-11-04更新
|
261次组卷
|
2卷引用:安徽省合肥市六校联盟2023-2024学年高一上学期11月期中化学试题
名校
解题方法
8 . 几种含硫物质的转化如下图(部分反应条件略去),下列判断不正确 的是
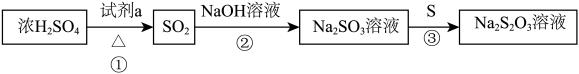
| A.①中,试剂a可以是Cu |
| B.②中,需要确保NaOH溶液足量 |
C.③中,生成1mol  时,转移4mol电子 时,转移4mol电子 |
D.③中,将S换为 ,氧化产物为 ,氧化产物为 |
您最近一年使用:0次
2023-11-02更新
|
543次组卷
|
5卷引用:安徽省亳州市第二完全中学2023-2024学年高一下学期3月第一次月考化学试题
安徽省亳州市第二完全中学2023-2024学年高一下学期3月第一次月考化学试题北京市海淀区2023-2024学年高三上学期期中测试化学试题 北京市北京师范大学燕化附属中学2023-2024学年高一下学期期中考试化学试卷 江西省宜春市上高二中2023-2024学年高一下学期3月月考化学试题 (已下线)高一化学下学期期末押题卷02-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)
名校
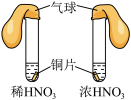
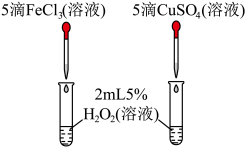
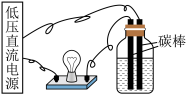
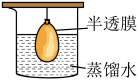
9 . 通过以下实验装置,不能达到实验目的的是
|
|
| A.通过气球膨胀速率比较浓硝酸和稀硝酸的氧化性强弱 | B.通过试管中气泡产生速率比较 和 和 的催化效率高低 的催化效率高低 |
|
|
| C.通过小灯泡亮度判断不同浓度NaCl溶液的导电性强弱 | D.通过以上装置分离NaCl溶液和 胶体 胶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-01更新
|
199次组卷
|
3卷引用:安徽省马鞍山市第二中学2023-2024学年高一下学期期中测试(实验班)化学试卷
名校
10 . 菱锌矿(主要成分是 ,还含有MnO、FeO、
,还含有MnO、FeO、 、
、 等杂质)是制取锌单质的重要原料。回答下列问题:
等杂质)是制取锌单质的重要原料。回答下列问题:
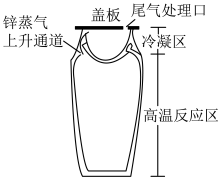
(1)古代以菱锌矿和煤炭饼为原料利用热还原法在如图所示的坩埚中制备Zn。
①该方法中,将菱锌矿敲碎与煤饼混合,此操作的主要目的是_______ 。
②图中盖板除了防止锌蒸气外逸外,另一主要作用是_______ ,尾气中含有CO,处理尾气的方法是_______ 。
(2)现代以菱锌矿为原料利用湿法冶炼锌主要分为如下五个步骤。
步骤1:用稀硫酸充分浸取菱锌矿:
步骤2:在步骤1的滤液中加入适量 除去其中的
除去其中的 ;
;
步骤3:在步骤2的滤液中加入试剂R调节溶液pH除去 ;
;
步骤4:经操作X从步骤3的滤液中获得 晶体:
晶体:
步骤5:将 溶于水配成饱和溶液,电解该饱和溶液得到Zn。
溶于水配成饱和溶液,电解该饱和溶液得到Zn。
①步骤1中用稀硫酸浸取后,所得滤渣的主要成分是_______ (填化学式)。
②步骤2中 与
与 反应生成
反应生成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
③为获得更多产品,步骤3中使用的试剂R应选择_______ (填字母)。
A. B.澄清石灰水 C.ZnO D.
B.澄清石灰水 C.ZnO D.
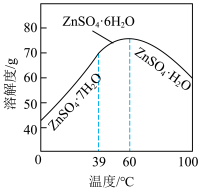
④温度与析出 的关系如图所示,则步骤4中操作X的具体操作是
的关系如图所示,则步骤4中操作X的具体操作是_______ 、冰水洗涤、干燥。
 ,还含有MnO、FeO、
,还含有MnO、FeO、 、
、 等杂质)是制取锌单质的重要原料。回答下列问题:
等杂质)是制取锌单质的重要原料。回答下列问题:
(1)古代以菱锌矿和煤炭饼为原料利用热还原法在如图所示的坩埚中制备Zn。
①该方法中,将菱锌矿敲碎与煤饼混合,此操作的主要目的是
②图中盖板除了防止锌蒸气外逸外,另一主要作用是
(2)现代以菱锌矿为原料利用湿法冶炼锌主要分为如下五个步骤。
步骤1:用稀硫酸充分浸取菱锌矿:
步骤2:在步骤1的滤液中加入适量
 除去其中的
除去其中的 ;
;步骤3:在步骤2的滤液中加入试剂R调节溶液pH除去
 ;
;步骤4:经操作X从步骤3的滤液中获得
 晶体:
晶体:步骤5:将
 溶于水配成饱和溶液,电解该饱和溶液得到Zn。
溶于水配成饱和溶液,电解该饱和溶液得到Zn。①步骤1中用稀硫酸浸取后,所得滤渣的主要成分是
②步骤2中
 与
与 反应生成
反应生成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:③为获得更多产品,步骤3中使用的试剂R应选择
A.
 B.澄清石灰水 C.ZnO D.
B.澄清石灰水 C.ZnO D.
④温度与析出
 的关系如图所示,则步骤4中操作X的具体操作是
的关系如图所示,则步骤4中操作X的具体操作是
您最近一年使用:0次
2023-10-20更新
|
89次组卷
|
4卷引用:安徽省九师联盟2023-2024学年高三上学期9月月考化学试题