名校
1 . 类比思维能帮助我们认识一类本质相似的问题,找出物质变化遵循的共同规律,是利用“已知”解决“未知”的一种有效策略,达到举一反三的学习效果。下列类比正确的是
| 选项 | 已知 | 类比 |
| A. | Na在空气中燃烧生成Na2O2 | Li在空气中燃烧生成Li2O2 |
| B. | Cl2可以将Fe2+氧化成Fe3+ | Br2也可以将Fe2+氧化成Fe3+ |
| C. | Fe可以从CuSO4溶液中置换出Cu | Na也可以从CuSO4溶液中置换出Cu |
| D. | CO2与Na2O2反应生成Na2CO3与O2 | SO2与Na2O2反应生成Na2SO3与O2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 氨基磺酸(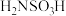 )可作漂白助剂,可减少或消除漂白液中重金属离子的催化作用,从而使漂白液质量得到保证。氨基磺酸在常温下稳定,高温时能完全分解:
)可作漂白助剂,可减少或消除漂白液中重金属离子的催化作用,从而使漂白液质量得到保证。氨基磺酸在常温下稳定,高温时能完全分解: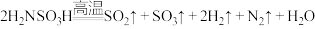 。下列说法正确的是
。下列说法正确的是
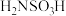 )可作漂白助剂,可减少或消除漂白液中重金属离子的催化作用,从而使漂白液质量得到保证。氨基磺酸在常温下稳定,高温时能完全分解:
)可作漂白助剂,可减少或消除漂白液中重金属离子的催化作用,从而使漂白液质量得到保证。氨基磺酸在常温下稳定,高温时能完全分解: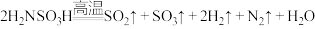 。下列说法正确的是
。下列说法正确的是A.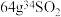 在标准状况下的体积为 在标准状况下的体积为 |
B.该反应生成 时转移 时转移 电子 电子 |
C.可用 溶液检验分解所得混合气体中是否含有 溶液检验分解所得混合气体中是否含有 |
D.相同条件下,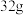 按 按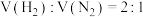 组成的混合气体与 组成的混合气体与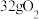 所含原子数相同 所含原子数相同 |
您最近一年使用:0次
2023-10-06更新
|
855次组卷
|
4卷引用:安徽省巢湖市第一中学2024届高三10月月考化学试题
名校
3 . 将一定量的铁粉投入到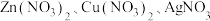 的混合溶液中,充分反应后过滤,得到滤渣和滤液。关于该实验有以下说法:
的混合溶液中,充分反应后过滤,得到滤渣和滤液。关于该实验有以下说法:
①滤渣中一定有银,可能有铜和铁;
②滤液中一定有锌离子,可能有亚铁离子、铜离子和银离子;
③向滤渣中加稀盐酸,有气泡冒出,滤渣中一定有铁,可能有银和铜;
④若滤渣中只有两种单质,则滤液中可能含硝酸铜;
⑤若滤渣中有三种金属单质,则滤液中的溶质只有硝酸锌;
⑥反应后得到滤渣的质量大于反应前加入铁粉的质量;
以上说法正确的是
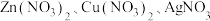 的混合溶液中,充分反应后过滤,得到滤渣和滤液。关于该实验有以下说法:
的混合溶液中,充分反应后过滤,得到滤渣和滤液。关于该实验有以下说法:①滤渣中一定有银,可能有铜和铁;
②滤液中一定有锌离子,可能有亚铁离子、铜离子和银离子;
③向滤渣中加稀盐酸,有气泡冒出,滤渣中一定有铁,可能有银和铜;
④若滤渣中只有两种单质,则滤液中可能含硝酸铜;
⑤若滤渣中有三种金属单质,则滤液中的溶质只有硝酸锌;
⑥反应后得到滤渣的质量大于反应前加入铁粉的质量;
以上说法正确的是
| A.②③⑥ | B.②④⑤ | C.①③⑤ | D.①④⑥ |
您最近一年使用:0次
2023-10-02更新
|
190次组卷
|
5卷引用:安徽省马鞍山市第二中学2023-2024学年高一下学期期中测试(实验班)化学试卷
名校
解题方法
4 . 下列物质的用途涉及氧化还原反应,且加点物质表现还原性的是
A.Mg与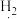 反应制 反应制 用于储氢 用于储氢 | B.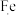 Cl3溶液用于蚀刻铜制电路板 Cl3溶液用于蚀刻铜制电路板 |
| C. | D.发酵时加入 |
您最近一年使用:0次
2023-09-28更新
|
165次组卷
|
5卷引用:安徽省九师联盟2023-2024学年高三上学期9月月考化学试题
名校
解题方法
5 . 铁是应用最广泛的金属,铁的卤化物、氧化物、氢氧化物以及高价铁的含氧酸盐均为重要化合物。如图是铁及其化合物的“价一类”二维图。回答下列问题:
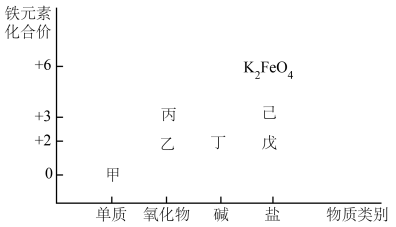
(1)在高温下,甲与水蒸气反应的化学方程式为___________ 。
(2)若戊为硫酸盐,缺铁性贫血往往口服戊,当用戊制成药片时,外表包有一层特殊的糖衣,其作用是防止___________ 。
(3)铁元素的高价铁盐K2FeO4可以做杀毒剂和净水剂,原因是___________ 。
(4)若己为氯化物,工业上还可以用己溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是___________(填字母)。
(5)丁在空气中很容易被氧化,现象是白色沉淀迅速变为灰绿色,最后变为红褐色,该反应的化学方程式为___________ 。某小组同学为探究灰绿色沉淀的成因,提出以下猜想并进行实验验证。
猜想1:白色沉淀吸附Fe2+,呈现灰绿色。
猜想2:铁元素部分被氧化后,Fe(Ⅱ)、Fe(Ⅲ)形成的共沉淀物为灰绿色。
①将试剂i补充完整______________________ 。
②根据实验现象得出结论,猜想___________ (填“1”或“2”)正确。

(1)在高温下,甲与水蒸气反应的化学方程式为
(2)若戊为硫酸盐,缺铁性贫血往往口服戊,当用戊制成药片时,外表包有一层特殊的糖衣,其作用是防止
(3)铁元素的高价铁盐K2FeO4可以做杀毒剂和净水剂,原因是
(4)若己为氯化物,工业上还可以用己溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是___________(填字母)。
| A.若无固体剩余,则溶液中可能含有Fe3+、Cu2+、Fe2+、Zn2+四种离子 |
| B.若溶液中有Cu2+,则体系中一定没有固体剩余 |
C.若有固体剩余,则溶液中一定有反应 发生 发生 |
| D.当溶液中有Fe2+存在时,则一定没有Cu析出 |
猜想1:白色沉淀吸附Fe2+,呈现灰绿色。
猜想2:铁元素部分被氧化后,Fe(Ⅱ)、Fe(Ⅲ)形成的共沉淀物为灰绿色。
| 实验 | 操作 | 试剂(均为0.1 mol·L-1) | 实验现象 |
| Ⅰ | 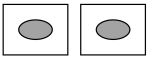 向两片玻璃片中心分别滴加试剂i和ii,面对面快速夹紧。 | i.___________ ii.2滴NaOH溶液 | 玻璃片夹缝中有白色浑浊。分开玻璃片,白色浑浊迅速变为灰绿色 |
| Ⅱ | i.2滴FeSO4溶液、 1滴Fe2(SO4)3溶液 ii.2滴NaOH溶液 | 玻璃片夹缝中立即有灰绿色浑浊 |
②根据实验现象得出结论,猜想
您最近一年使用:0次
2023-09-23更新
|
311次组卷
|
7卷引用:安徽省灵璧中学2024届高三上学期一轮复习联考(一)化学试题
名校
6 . 已知:i: ;ii:KMnO4与浓盐酸反应可产生氯气,下列叙述不正确的是
;ii:KMnO4与浓盐酸反应可产生氯气,下列叙述不正确的是
 ;ii:KMnO4与浓盐酸反应可产生氯气,下列叙述不正确的是
;ii:KMnO4与浓盐酸反应可产生氯气,下列叙述不正确的是A.氧化性:BiO > > >Cl2 >Cl2 |
| B.a=14 |
| C.每生成1molH2O,该反应转移电子为0.7NA |
| D.反应ii中,还原性的HCl与参加反应的HCl之比为5:8 |
您最近一年使用:0次
名校
解题方法
7 . 研究发现,油画创作中用到的颜料雌黄(As2S3)褪色的原因是其在不同的空气湿度和光照条件下发生了以下两种化学反应:
H3AsO4+H2SO4 As2S3
As2S3 As2O3+H2S2O3
As2O3+H2S2O3
下列说法正确的是
H3AsO4+H2SO4
 As2S3
As2S3 As2O3+H2S2O3
As2O3+H2S2O3下列说法正确的是
A.硫代硫酸根S2O 的空间结构是正四面体 的空间结构是正四面体 |
| B.反应①和②中均有两种氧化产物 |
| C.等量的As2S3在反应①和②中耗氧量相等 |
| D.反应①和②中,氧化等量的As2S3转移的电子数之比为7∶3 |
您最近一年使用:0次
解题方法
8 . 氯金酸晶体(HAuCl4•4H2O,Mr=412)用途广泛,黄金深加工中氯金酸的制备往往为第一步反应。某化学实验小组设计用双氧水、氯化氢与金粉反应制备氯金酸,并探究其分解产物。
I.氯金酸晶体的制备
制备氯金酸的装置如图甲所示。检查装置气密性,向三颈烧瓶中加入金粉,通过仪器b向三颈烧瓶中加入30%的双氧水,保持反应装置的温度为40℃,再向三颈烧瓶中通入HCl,一段时间后得到金黄色氯金酸溶液,将反应液经一系列操作可得橘黄色氯金酸晶体。

(1)仪器a的化学名称为_________ ,其作用为_________ 。
(2)实验室利用图乙装置制备HCl气体,在该制备方法中浓硫酸体现的性质是________ ;在恒压滴液漏斗的下口连接有毛细玻璃管,这样做的目的是_________ 。
(3)写出三颈烧瓶里发生反应的化学方程式为_________ 。
(4)“一系列操作”含有过滤操作,该操作所需要的硅酸盐仪器有________ 。
Ⅱ.氯金酸晶体的热分解
研究表明HAuCl4•4H2O(Mr=412)热分解得到Au的过程可分为四步,某实验小组取一定质量的HAuCl4•4H2O样品进行热重分析,固体质量损失率(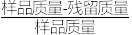 ×100%)随温度变化的曲线如图所示:
×100%)随温度变化的曲线如图所示:

(5)在130.7℃~142.6℃时,质量损失率为8.86%,可能损失的物质是______ (填化学式)。
(6)写出247.4℃~344.5℃时,发生反应的化学方程式________ 。
I.氯金酸晶体的制备
制备氯金酸的装置如图甲所示。检查装置气密性,向三颈烧瓶中加入金粉,通过仪器b向三颈烧瓶中加入30%的双氧水,保持反应装置的温度为40℃,再向三颈烧瓶中通入HCl,一段时间后得到金黄色氯金酸溶液,将反应液经一系列操作可得橘黄色氯金酸晶体。

(1)仪器a的化学名称为
(2)实验室利用图乙装置制备HCl气体,在该制备方法中浓硫酸体现的性质是
(3)写出三颈烧瓶里发生反应的化学方程式为
(4)“一系列操作”含有过滤操作,该操作所需要的硅酸盐仪器有
Ⅱ.氯金酸晶体的热分解
研究表明HAuCl4•4H2O(Mr=412)热分解得到Au的过程可分为四步,某实验小组取一定质量的HAuCl4•4H2O样品进行热重分析,固体质量损失率(
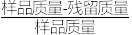 ×100%)随温度变化的曲线如图所示:
×100%)随温度变化的曲线如图所示:
(5)在130.7℃~142.6℃时,质量损失率为8.86%,可能损失的物质是
(6)写出247.4℃~344.5℃时,发生反应的化学方程式
您最近一年使用:0次
名校
解题方法
9 . KClO2是一种极强的氧化剂,在酸性或碱性介质下均能将MnO2溶解,得到紫色溶液。其中一种制备流程如图,下列说法正确的是
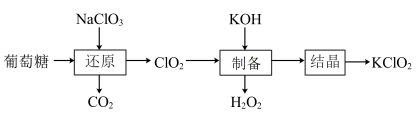

| A.“还原”过程反应的环境为强碱性介质 |
| B.“还原”过程中消耗葡萄糖和NaClO3物质的量之比为1:12 |
C.“制备”过程中发生的离子方程式为:2ClO2+H2O2=2ClO +O2+2H+ +O2+2H+ |
D.在碱性介质下,ClO 的氧化性强于MnO 的氧化性强于MnO |
您最近一年使用:0次
2023-08-28更新
|
240次组卷
|
4卷引用:安徽省十校联盟2023-2024学年高三上学期8月开学摸底考化学试题
10 . 物质的类别和核心元素化合价是研究物质性质的两个重要维度。硫及其部分化合物的“价-类”二维图如图所示,回答下列问题:_______ ;其水溶液在空气中放置容易变浑浊,该反应的化学方程式为_______ 。
(2)通入气体乙可使酸性高锰酸钾溶液褪色,说明乙具有_______ 性;实验中可用足量的NaOH溶液吸收气体乙,防止污染空气,该反应的离子方程式为_______ 。
(3)某同学在用锌与丙的稀溶液反应制 时,为了加快反应速度,将丙的稀溶液换成浓溶液,该同学的方案
时,为了加快反应速度,将丙的稀溶液换成浓溶液,该同学的方案_______ (填“合理”或“不合理”),理由是_______ 。
(4)丁的钠盐在空气中容易变质,检验其是否变质的方法是_______ 。
(5)已知酸性条件下 能被丁还原为
能被丁还原为 ,24mL 0.05
,24mL 0.05 的丁溶液与0.02
的丁溶液与0.02 的
的 溶液恰好反应,则消耗
溶液恰好反应,则消耗 溶液的体积为
溶液的体积为_______ mL。

(2)通入气体乙可使酸性高锰酸钾溶液褪色,说明乙具有
(3)某同学在用锌与丙的稀溶液反应制
 时,为了加快反应速度,将丙的稀溶液换成浓溶液,该同学的方案
时,为了加快反应速度,将丙的稀溶液换成浓溶液,该同学的方案(4)丁的钠盐在空气中容易变质,检验其是否变质的方法是
(5)已知酸性条件下
 能被丁还原为
能被丁还原为 ,24mL 0.05
,24mL 0.05 的丁溶液与0.02
的丁溶液与0.02 的
的 溶液恰好反应,则消耗
溶液恰好反应,则消耗 溶液的体积为
溶液的体积为
您最近一年使用:0次
2023-08-21更新
|
276次组卷
|
2卷引用:安徽省皖中名校2022-2023学年高一下学期期中联考化学试题



