名校
解题方法
1 . K2FeO4为暗紫色有光泽的粉末,是一种新型绿色消毒剂,在实验室通过两步操作制备K2FeO4。回答下列问题:
Ⅰ.制备KClO,装置如下:
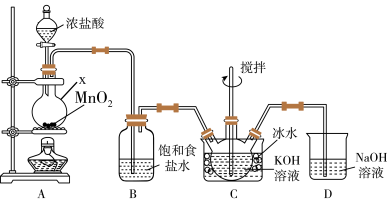
(1)仪器x的名称为___________ ,x中反应的化学方程式为___________ 。
(2)装置B的作用为___________ ;装置C中Cl2与KOH反应得到KClO,该反应离子方程式为___________ 。
(3)装置D的作用为___________ 。
Ⅱ.制备K2FeO4:
(4)待装置C中得到足量KClO后,将三口烧瓶上的导管取下,依次加入适量KOH溶液、Fe(NO3)3溶液并搅拌,控制水浴温度为25 ℃,得到紫色K2FeO4溶液,反应的离子方程式为 。该过程中每制备1 mol K2FeO4,转移电子数目为
。该过程中每制备1 mol K2FeO4,转移电子数目为___________ (用NA表示阿伏加德罗常数的值)。
Ⅰ.制备KClO,装置如下:

(1)仪器x的名称为
(2)装置B的作用为
(3)装置D的作用为
Ⅱ.制备K2FeO4:
(4)待装置C中得到足量KClO后,将三口烧瓶上的导管取下,依次加入适量KOH溶液、Fe(NO3)3溶液并搅拌,控制水浴温度为25 ℃,得到紫色K2FeO4溶液,反应的离子方程式为
 。该过程中每制备1 mol K2FeO4,转移电子数目为
。该过程中每制备1 mol K2FeO4,转移电子数目为
您最近一年使用:0次
2021-09-10更新
|
509次组卷
|
4卷引用:湖南省邵阳市邵东市2021-2022学年高一上学期期末统考化学试题
名校
解题方法
2 . 用氧化焙烧-软锰矿浆吸收工艺处理砷华废渣,吸收液经净化除杂、浓缩结晶等工序可制备工业产品硫酸锰。

已知:a.砷华废渣中硫主要以FeS、FeS2、FeAsS、单质硫、硫酸盐等形态存在;铁主要以Fe2O3、FeAsS、FeS形态存在;砷主要以FeAsS、Fe3(AsO4)2等形态存在。
b.软锰矿吸收的过程中,除锰浸出外,还伴随着杂质Fe、Al、Ca、Pb和Si等的同时浸出。
c.SDD为二乙胺硫代甲酸钠。
d.溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)砷华废渣预先粉碎的目的是___ ;写出焙烧时FeAsS被氧气氧化成+3价金属氧化物和SO2的方程式:___ 。
(2)砷华废渣焙烧温度与Mn的浸出率的关系图如图:
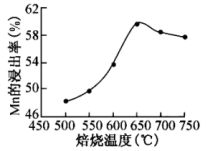
①焙烧的适宜温度为___ 。
②Mn的浸出率随着焙烧的温度升高而升高,温度高于650℃后,Mn的浸出率降低的可能原因是___ 。
(3)软锰矿浆(MnO2)吸收焙烧放出的SO2的化学方程式为___ 。
(4)加入MnO2粉末的目的是氧化Fe2+,其发生反应的离子方程式为___ 。
(5)根据实验目的调节pH的范围是___ 。
(6)称量产品MnSO4·H2O17.21g,溶于水,滴加足量的BaCl2溶液,生成的沉淀,经过过滤、洗涤、干燥后得固体,称量固体的质量为23.30g,则产品中MnSO4·H2O的质量分数为___ %(保留1位小数)。

已知:a.砷华废渣中硫主要以FeS、FeS2、FeAsS、单质硫、硫酸盐等形态存在;铁主要以Fe2O3、FeAsS、FeS形态存在;砷主要以FeAsS、Fe3(AsO4)2等形态存在。
b.软锰矿吸收的过程中,除锰浸出外,还伴随着杂质Fe、Al、Ca、Pb和Si等的同时浸出。
c.SDD为二乙胺硫代甲酸钠。
d.溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Pb2+ | Mn2+ |
| 开始沉淀时pH | 7.0 | 1.9 | 3.7 | 7.1 | 8.1 |
| 完全沉淀时pH | 9.0 | 3.2 | 4.7 | 9.1 | 10.1 |
(1)砷华废渣预先粉碎的目的是
(2)砷华废渣焙烧温度与Mn的浸出率的关系图如图:

①焙烧的适宜温度为
②Mn的浸出率随着焙烧的温度升高而升高,温度高于650℃后,Mn的浸出率降低的可能原因是
(3)软锰矿浆(MnO2)吸收焙烧放出的SO2的化学方程式为
(4)加入MnO2粉末的目的是氧化Fe2+,其发生反应的离子方程式为
(5)根据实验目的调节pH的范围是
(6)称量产品MnSO4·H2O17.21g,溶于水,滴加足量的BaCl2溶液,生成的沉淀,经过过滤、洗涤、干燥后得固体,称量固体的质量为23.30g,则产品中MnSO4·H2O的质量分数为
您最近一年使用:0次
2021-09-10更新
|
252次组卷
|
3卷引用:湖南省天壹名校联盟 2022届高三入学摸底考试化学试题
名校
解题方法
3 . 某萃铜余液主要含有 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备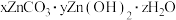 的工艺流程如图甲所示。
的工艺流程如图甲所示。

回答下列问题:
(1)过硫酸钠( )中
)中 的化合价为
的化合价为 ,
,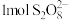 中过氧键的数目为
中过氧键的数目为___________ 。向 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为___________ 。“氧化除锰”过程中,
___________ (填“能”或“不能”)用绿色氧化剂 来代替。
来代替。
(2)向“氧化除锰”后的余液中加入试剂 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为___________ 。
(3)“沉锌”时,应保持溶液 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是___________ 。
(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→___________ →___________ →___________ →___________ →c→关抽气泵。
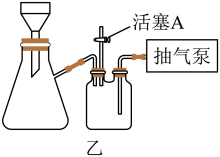
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[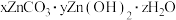 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌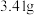 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体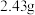 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为___________ 。
 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备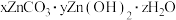 的工艺流程如图甲所示。
的工艺流程如图甲所示。
回答下列问题:
(1)过硫酸钠(
 )中
)中 的化合价为
的化合价为 ,
,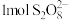 中过氧键的数目为
中过氧键的数目为 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为
 来代替。
来代替。(2)向“氧化除锰”后的余液中加入试剂
 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为(3)“沉锌”时,应保持溶液
 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→

a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[
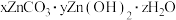 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌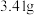 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体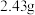 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为
您最近一年使用:0次
2021-09-09更新
|
1572次组卷
|
9卷引用:湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题
湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题全国2022届高三上学期第一次学业质量联合检测化学试题广东省珠海市第二中学2022届高三十月月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】07(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)2019年高考浙江卷化学试题变式题(实验题)
4 . 从砷化镓废料(主要成分为 、
、 、
、 和
和 )中回收镓和砷的工艺流程如图所示。
)中回收镓和砷的工艺流程如图所示。
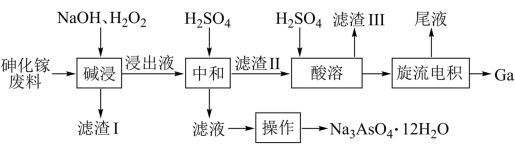
下列说法错误的是
 、
、 、
、 和
和 )中回收镓和砷的工艺流程如图所示。
)中回收镓和砷的工艺流程如图所示。
下列说法错误的是
A.“碱浸”时,温度保持在70℃的目的是提高“碱浸”速率,同时防止 过度分解 过度分解 |
B.“碱浸”时, 被 被 氧化,每反应 氧化,每反应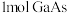 ,转移电子的数目为 ,转移电子的数目为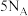 |
C.“旋流电积”所得“尾液”溶质主要是 ,可进行循环利用,提高经济效益 ,可进行循环利用,提高经济效益 |
D.该工艺得到的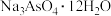 纯度较低,可以通过重结晶的方法进行提纯 纯度较低,可以通过重结晶的方法进行提纯 |
您最近一年使用:0次
2021-09-09更新
|
1505次组卷
|
13卷引用:湖南省株洲市攸县第一中学2022-2023学年高三上学期第一次月考化学试题
湖南省株洲市攸县第一中学2022-2023学年高三上学期第一次月考化学试题湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题全国2022届高三上学期第一次学业质量联合检测化学试题山东省潍坊市第一中学2022届高三10月月考化学试题安徽省合肥工业大学附属中学2021-2022学年高三上学期第一次阶段考试化学试题陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题(已下线)专题06 金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)提升卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)安徽省宿松中学2021-2022学年高三上学期第一次联考化学试题福建省莆田第一中学2021-2022学年高三上学期10月月考化学试题黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)福建省莆田第二十五中学2022-2023学年高三上学期期中考试化学试题
名校
5 . 可闻声波诱导液体振动产生的法拉第波可以调节氧气分子在水中的溶解,从而诱导有差别的时空分布,有的区域呈氧化性,而同时有的区域呈还原性。研究人员选择了如图所示的氧化还原平衡体系。已知:声波频率提高可促进氧气的溶解。

下列说法错误的是

下列说法错误的是
A.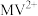 被 被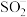 还原形成自由基阳离子 还原形成自由基阳离子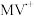 的过程伴随着颜色的改变 的过程伴随着颜色的改变 |
B.开启可闻声波能够促进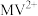 再生 再生 |
C.持续补充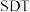 才能维持蓝色 才能维持蓝色 |
D.向体系中加入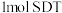 ,转移电子为 ,转移电子为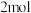 |
您最近一年使用:0次
2021-09-09更新
|
1304次组卷
|
10卷引用:湖南省常德市桃源县第一中学2022届高三下学期第二次模拟化学试题
湖南省常德市桃源县第一中学2022届高三下学期第二次模拟化学试题湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题全国2022届高三上学期第一次学业质量联合检测化学试题(已下线)2022年新高考化学时事热点情境化考题---物质循环图陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题江西省丰城中学2021-2022学年上学期高三创新实验班第四次月考化学试题(已下线)专题09反应速率、化学平衡-2022年高考真题+模拟题汇编(全国卷)(已下线)专题09反应速率、化学平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题09反应速率、化学平衡-五年(2018~2022)高考真题汇编(全国卷)辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题
名校
6 . 下列关于硝酸的说法中正确的是
| A.硝酸和活泼金属反应生成氢气和相应的硝酸盐 |
| B.硝酸的浓度越大,其氧化性越强 |
| C.稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水 |
| D.王水是浓硝酸和浓盐酸体积比为3∶1的混合物,能溶解金和铂 |
您最近一年使用:0次
2021-09-08更新
|
342次组卷
|
4卷引用:湖南省邵东县第三中学2020-2021学年高一下学期第一次月考化学试题
湖南省邵东县第三中学2020-2021学年高一下学期第一次月考化学试题(已下线)章末培优 第5章 化工生产中的重要非金属元素-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省深圳市南头中学2021-2022学年高一下学期期中考试选考科目化学试题(已下线)第02练 氮及其化合物-2022年【暑假分层作业】高一化学(人教版2019必修第二册)
7 . 近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误 的是
| A.北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 |
| B.奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 |
| C.长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 |
| D.天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料 |
您最近一年使用:0次
2021-09-07更新
|
7530次组卷
|
20卷引用:湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题
湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题湖南省岳阳市第一中学2022-2023高二上学期期末考试化学试题2021年新高考天津化学高考真题贵州省毕节市威宁第四中学2022届高三第一次月考化学试题山东省菏泽市单县第五中学希望部2021-2022学年高三上学期第一次月考化学试题天津市第三中学2021-2022学年高三上学期10月阶段性检测化学试题2021年天津高考化学试题变式题1-12(已下线)秘籍02 化学与STSE-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷03 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点01 化学与STSE与传统文化-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题天津市西青区杨柳青第一中学2021-2022学年高二下学期期末适应性测试(实验班)化学试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)易错点02 化学与STSE-备战2023年高考化学考试易错题(已下线)易错点08 金属材料-备战2023年高考化学考试易错题(已下线)专题01 STSE 物质的分类、性质与变化(练)-2023年高考化学二轮复习讲练测(新高考专用)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)江苏省南通市如皋市2022-2023学年高三上学期期末考试化学试题(已下线)考点01 物质的分类及转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆阿克苏市实验中学2023-2024学年高三上学期第一次月考化学试题
名校
解题方法
8 . 某化学兴趣小组为探究酸性高锰酸钾与铜的反应,设计实验如下,在培养皿中加入足量的酸性高锰酸钾溶液,放入铜珠,实验结果如下:
已知: 在酸性溶液中不能稳定存在:
在酸性溶液中不能稳定存在: ,下列说法正确的是
,下列说法正确的是
| 实验 | 现象 |
 | 一段时间后,培养皿中由铜珠向外侧依次呈现: Ⅰ区澄清且紫色褪色明显 Ⅱ区底部覆盖棕黑色固体 Ⅲ区澄清且紫色变浅 |
 在酸性溶液中不能稳定存在:
在酸性溶液中不能稳定存在: ,下列说法正确的是
,下列说法正确的是A.Ⅰ区铜反应后的主要产物,可能是 、也可能是 、也可能是 |
B.Ⅱ区棕黑色固体是 ,由铜和酸性高锰酸钾反应产生 ,由铜和酸性高锰酸钾反应产生 |
C.Ⅲ区紫色变浅说明在Ⅲ区 也发生了氧化还原反应 也发生了氧化还原反应 |
D.如果酸性高锰酸钾大大过量,所有反应完全后,产物中可能没有 |
您最近一年使用:0次
2021-08-23更新
|
1788次组卷
|
10卷引用:湖南省长沙市第一中学2021-2022高一上学期第一次月考化学试卷
湖南省长沙市第一中学2021-2022高一上学期第一次月考化学试卷(已下线)2022年湖南卷高考真题变式题(11-14)北京市十一学校2022 届高三上学期开学考试(暑期学习检测)化学试题河南省濮阳市第一高级中学2021-2022学年高一上学期期中化学(B)试题河北省衡水市2021-2022学年高三上学期三调化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)甘肃省张掖市高台县第一中学2022-2023学年高三上学期第三次检测化学试题湖北省武汉市洪山高级中学2021-2022高一上学期9月月考化学试题(已下线)易错点3对实验原理分析不透彻而出错福建省厦门第六中学2023-2024学年高一上学期1月月考化学试题
名校
解题方法
9 . 研究发现:塑料经过特殊改造后能够像金属一样具有导电性能。以聚乙炔为例,要使其能导电,必须用I2和Na等作掺杂处理,它们的掺杂过程可用通式表示如下:
①[CH]n+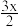 I2→[CH]
I2→[CH]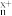 +x
+x ,
,
②[CH]n+xNa→[CH] +xNa+
+xNa+
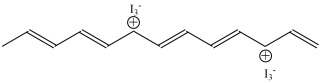
其中,用I2掺杂后的聚乙炔结构式如下图:
下列说法正确的是
①[CH]n+
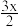 I2→[CH]
I2→[CH]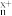 +x
+x ,
,②[CH]n+xNa→[CH]
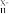 +xNa+
+xNa+其中,用I2掺杂后的聚乙炔结构式如下图:

下列说法正确的是
| A.掺杂前的聚乙炔结构中,单双键交替存在 |
| B.掺杂后的聚乙炔结构中,单双键交替形式与掺杂前一致 |
| C.在掺杂反应①②中,转移电子数都为xe- |
| D.掺杂反应①中,聚乙炔被还原;掺杂反应②中,聚乙炔被氧化 |
您最近一年使用:0次
2021-08-13更新
|
293次组卷
|
2卷引用:湖南师范大学附属中学2021-2022学年高三下学期第六次月考化学试题
解题方法
10 . 氙和氟气反应,生成含有XeF2和XeF4的固体混合物,现用两份等质量的此种固体混合物,分别做下面的化学分析:
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数___________ 。(提示:XeF2与H2O仅发生氧化还原反应;XeF4与H2O反应时,有一半的XeF4与水发生氧化还原反应,另一半的XeF4则发生歧化反应。)
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数
您最近一年使用:0次



