1 . 铁的化合物在生产生活中有极其重要的作用。请回答下列有关问题:
(1)七水硫酸亚铁可作木材防火剂、磁性材料等。某课外活动小组配制100mL 溶液,需要用到的主要玻璃仪器有玻璃棒、烧杯、胶头滴管、量筒和
溶液,需要用到的主要玻璃仪器有玻璃棒、烧杯、胶头滴管、量筒和_______ ;需要称取_______ g 晶体;一天后,小组同学发现溶液变为黄色,其原因是
晶体;一天后,小组同学发现溶液变为黄色,其原因是_______ ;为了防止溶液变黄,在配制时需要加入少量_______ ; 在高温和隔绝空气条件下可以分解生成
在高温和隔绝空气条件下可以分解生成 ,其化学方程式为
,其化学方程式为_______ 。
(2)高铁酸钾( )是一种新型高效的水处理剂,
)是一种新型高效的水处理剂, 中铁元素的化合价为
中铁元素的化合价为_______ ;用 溶液、KClO溶液和KOH溶液反应可生成
溶液、KClO溶液和KOH溶液反应可生成 ,其离子方程式为
,其离子方程式为_______ 。
(3)用 作催化剂,在废水中加入
作催化剂,在废水中加入 可以去除废水中的有机物(TOC)。在酸性条件下,
可以去除废水中的有机物(TOC)。在酸性条件下, 的加入量对TOC的去除效果如图所示,则
的加入量对TOC的去除效果如图所示,则 的浓度为
的浓度为_______  时,废水中TOC去除效果最好。(保留三位有效数字)
时,废水中TOC去除效果最好。(保留三位有效数字)

(1)七水硫酸亚铁可作木材防火剂、磁性材料等。某课外活动小组配制100mL
 溶液,需要用到的主要玻璃仪器有玻璃棒、烧杯、胶头滴管、量筒和
溶液,需要用到的主要玻璃仪器有玻璃棒、烧杯、胶头滴管、量筒和 晶体;一天后,小组同学发现溶液变为黄色,其原因是
晶体;一天后,小组同学发现溶液变为黄色,其原因是 在高温和隔绝空气条件下可以分解生成
在高温和隔绝空气条件下可以分解生成 ,其化学方程式为
,其化学方程式为(2)高铁酸钾(
 )是一种新型高效的水处理剂,
)是一种新型高效的水处理剂, 中铁元素的化合价为
中铁元素的化合价为 溶液、KClO溶液和KOH溶液反应可生成
溶液、KClO溶液和KOH溶液反应可生成 ,其离子方程式为
,其离子方程式为(3)用
 作催化剂,在废水中加入
作催化剂,在废水中加入 可以去除废水中的有机物(TOC)。在酸性条件下,
可以去除废水中的有机物(TOC)。在酸性条件下, 的加入量对TOC的去除效果如图所示,则
的加入量对TOC的去除效果如图所示,则 的浓度为
的浓度为 时,废水中TOC去除效果最好。(保留三位有效数字)
时,废水中TOC去除效果最好。(保留三位有效数字)
您最近一年使用:0次
名校
解题方法
2 . 乳酸亚铁是一种很好的补铁剂,制备乳酸亚铁晶体的方法之一是用新制的碳酸亚铁与乳酸溶液反应,下图为制备的具体流程:
(1)小组成员按上图连接好装置,检查装置气密性后加入药品,打开K1和K3,关闭K2。
①仪器B中产生的实验现象为___________ 。
②反应一段时间后,关闭___________ (填“K1”、“K2”或“K3”,下同),打开___________ ,观察到B中的溶液会流入C中,同时C中析出 沉淀。
沉淀。
③B中产生的气体除了把B中溶液压进C外,还有什么作用?___________ 。
④仪器C中生成 的离子方程式为
的离子方程式为___________ 。
(2)反应Ⅰ结束后,小组成员将仪器C中的浊液过滤得到 沉淀,若在空气中过滤时间过长会发现沉淀表面部分呈红褐色,请用化学方程式说明原因
沉淀,若在空气中过滤时间过长会发现沉淀表面部分呈红褐色,请用化学方程式说明原因___________ 。
(3)反应Ⅱ结束后,小组成员继续加入乳酸调节溶液pH至5.8左右,目的是___________ ,结晶时加入乙醇可以提高乳酸亚铁的析出率,其原因是___________ 。
(4)实验结束后,小组成员用0.1000 mol/L 酸性KMnO4标准溶液进行滴定,通过测定产品中Fe2+的量来计算产品的纯度,测定原理为: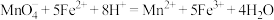 ,实验若干次后,发现每次的计算结果总是大于100%,其主要原因是
,实验若干次后,发现每次的计算结果总是大于100%,其主要原因是___________ (不考虑操作不当引起的误差)。


(1)小组成员按上图连接好装置,检查装置气密性后加入药品,打开K1和K3,关闭K2。
①仪器B中产生的实验现象为
②反应一段时间后,关闭
 沉淀。
沉淀。③B中产生的气体除了把B中溶液压进C外,还有什么作用?
④仪器C中生成
 的离子方程式为
的离子方程式为(2)反应Ⅰ结束后,小组成员将仪器C中的浊液过滤得到
 沉淀,若在空气中过滤时间过长会发现沉淀表面部分呈红褐色,请用化学方程式说明原因
沉淀,若在空气中过滤时间过长会发现沉淀表面部分呈红褐色,请用化学方程式说明原因(3)反应Ⅱ结束后,小组成员继续加入乳酸调节溶液pH至5.8左右,目的是
(4)实验结束后,小组成员用0.1000 mol/L 酸性KMnO4标准溶液进行滴定,通过测定产品中Fe2+的量来计算产品的纯度,测定原理为:
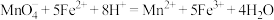 ,实验若干次后,发现每次的计算结果总是大于100%,其主要原因是
,实验若干次后,发现每次的计算结果总是大于100%,其主要原因是
您最近一年使用:0次
3 .  、
、 都是大气污染物。请回答下列有关问题:
都是大气污染物。请回答下列有关问题:
(1)碘循环工艺能吸收 ,降低环境污染,同时又能制得氢气,反应过程如下图:
,降低环境污染,同时又能制得氢气,反应过程如下图:_______ ,氧化剂与还原剂的物质的量之比为_______ ,反应温度控制在20~100℃的原因是_______ 。
②若有196g 生成,理论上产生氢气的体积为
生成,理论上产生氢气的体积为_______ L(标准状况)。
(2)工业上用 溶液吸收
溶液吸收 ,生成等物质的量的两种钠盐,其中一种为
,生成等物质的量的两种钠盐,其中一种为 ,同时还有一种气体生成,则该反应的离子方程式为
,同时还有一种气体生成,则该反应的离子方程式为_______ 。
(3)工业上脱出 ,也可以在加热和催化剂作用下用
,也可以在加热和催化剂作用下用 还原生成
还原生成 和
和 ,实验测得温度高于400℃时,
,实验测得温度高于400℃时, 脱出率减小,其原因可能是
脱出率减小,其原因可能是_______ 。
(4)工业上可用 吸收含
吸收含 的烟气得到
的烟气得到 ,将50.7g
,将50.7g 受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。
受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。_______ 。
②1160℃时,所得固体的化学式为_______ 。
 、
、 都是大气污染物。请回答下列有关问题:
都是大气污染物。请回答下列有关问题:(1)碘循环工艺能吸收
 ,降低环境污染,同时又能制得氢气,反应过程如下图:
,降低环境污染,同时又能制得氢气,反应过程如下图: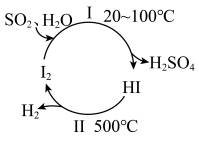
②若有196g
 生成,理论上产生氢气的体积为
生成,理论上产生氢气的体积为(2)工业上用
 溶液吸收
溶液吸收 ,生成等物质的量的两种钠盐,其中一种为
,生成等物质的量的两种钠盐,其中一种为 ,同时还有一种气体生成,则该反应的离子方程式为
,同时还有一种气体生成,则该反应的离子方程式为(3)工业上脱出
 ,也可以在加热和催化剂作用下用
,也可以在加热和催化剂作用下用 还原生成
还原生成 和
和 ,实验测得温度高于400℃时,
,实验测得温度高于400℃时, 脱出率减小,其原因可能是
脱出率减小,其原因可能是(4)工业上可用
 吸收含
吸收含 的烟气得到
的烟气得到 ,将50.7g
,将50.7g 受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。
受热分解,分解过程中的热重曲线(固体质量随温度变化的曲线)如图所示。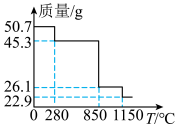
②1160℃时,所得固体的化学式为
您最近一年使用:0次
2023-11-05更新
|
142次组卷
|
2卷引用:重庆市2023-2024学年高三上学期11月调研测试化学试题
名校
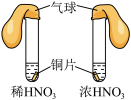
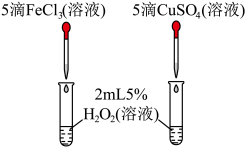
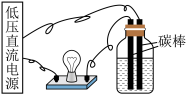
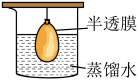
4 . 通过以下实验装置,不能达到实验目的的是
|
|
| A.通过气球膨胀速率比较浓硝酸和稀硝酸的氧化性强弱 | B.通过试管中气泡产生速率比较 和 和 的催化效率高低 的催化效率高低 |
|
|
| C.通过小灯泡亮度判断不同浓度NaCl溶液的导电性强弱 | D.通过以上装置分离NaCl溶液和 胶体 胶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-01更新
|
201次组卷
|
3卷引用:重庆市育才中学校 西南大学附属中学校2023-2024学年高一上学期拔尖强基联合定时测试(一)化学试题
名校
解题方法
5 . 下列说法错误的是
| A.战国青铜器属于金属材料 |
| B.脲醛树脂可用于生产电器开关 |
| C.氢氟酸具有弱酸性,因此可刻蚀玻璃 |
| D.同服补铁剂与维生素C可提高补铁效果 |
您最近一年使用:0次
名校
解题方法
6 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
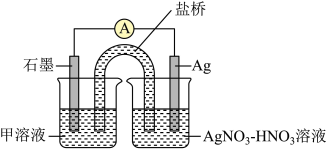
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为
您最近一年使用:0次
2023-10-26更新
|
612次组卷
|
7卷引用:重庆市百师联盟2024届高三一轮复习联考(二)
名校
7 . Ⅰ.铝、铁、铜及其化合物广泛应用于日常生活中,根据所学知识,回答下列问题:
(1)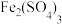 具有净水作用,用离子方程式解释
具有净水作用,用离子方程式解释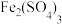 净水的原理:
净水的原理:___________ 。
(2)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它与胃酸反应的化学方程式为___________ 。
(3)铜器表面有时会生成铜绿[主要成分为Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的离子方程式___________ 。
II.氯的许多化合物是高效广谱的消毒剂,回答下列问题:
(4)“84消毒液”可用于杀菌消毒漂白,其有效成分为___________ 。(填化学式)其在空气中能漂白的原理为___________ 。(写离子方程式)
(5)ClO2是一种广谱杀菌剂,能用于水的消毒。可以以亚氯酸钠和稀盐酸为原料制备,该过程中氧化剂与还原剂的物质的量之比为___________ ;
III.机动车尾气中的NOx会造成环境问题,尿素水溶液热解产生的NH3可去除汽车尾气中的NOx,流程如下:

(6)写出“催化反应”过程中NH3还原NO2的化学方程式___________ 。
(7)“催化反应”过程中需控制温度在 之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和___________ 。
(1)
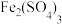 具有净水作用,用离子方程式解释
具有净水作用,用离子方程式解释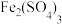 净水的原理:
净水的原理:(2)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它与胃酸反应的化学方程式为
(3)铜器表面有时会生成铜绿[主要成分为Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的离子方程式
II.氯的许多化合物是高效广谱的消毒剂,回答下列问题:
(4)“84消毒液”可用于杀菌消毒漂白,其有效成分为
(5)ClO2是一种广谱杀菌剂,能用于水的消毒。可以以亚氯酸钠和稀盐酸为原料制备,该过程中氧化剂与还原剂的物质的量之比为
III.机动车尾气中的NOx会造成环境问题,尿素水溶液热解产生的NH3可去除汽车尾气中的NOx,流程如下:

(6)写出“催化反应”过程中NH3还原NO2的化学方程式
(7)“催化反应”过程中需控制温度在
 之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
您最近一年使用:0次
解题方法
8 . 已知: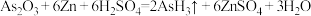 ,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是
,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是
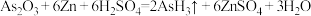 ,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是
,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是| A.转移电子的数目为6NA | B.标准状况下,生成H2O27g |
| C.生成还原产物的分子数为1NA | D.产物AsH3为平面三角形 |
您最近一年使用:0次
名校
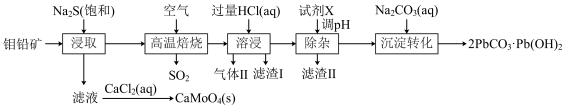
9 . 碱式碳酸铅 是一种重要的白色工业颜料,可由钼铅矿(主要成分
是一种重要的白色工业颜料,可由钼铅矿(主要成分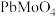 ,含
,含 、
、 等杂质)通过如下工艺流程制备:
等杂质)通过如下工艺流程制备:
已知:①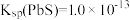 、
、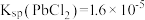 、
、 ;
;
② ;
;
③ 具有强氧化性。
具有强氧化性。
回答下列问题:
(1)“浸取”时,若要提高浸取率,可采取的措施有_______ 。(任答2条)
(2)已知“高温焙烧”铅转化为 ,则产生气体Ⅱ的离子反应方程式为
,则产生气体Ⅱ的离子反应方程式为_______ ,滤渣Ⅱ的成分是_______ 。
(3)“溶浸”过程中,若未加入过量的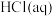 ,则会导致的后果是
,则会导致的后果是_______ 。除杂时,若要保证不引入新杂质,则试剂X最好为_______ (填序号)。
A. B.
B. C.
C. D.
D.
(4)生成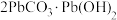 的离子反应方程式为
的离子反应方程式为_______ ,若对提纯后的产品进行热重分析,加热分解后得到如下曲线,则B点对应的物质的化学式为_______ 。

 是一种重要的白色工业颜料,可由钼铅矿(主要成分
是一种重要的白色工业颜料,可由钼铅矿(主要成分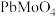 ,含
,含 、
、 等杂质)通过如下工艺流程制备:
等杂质)通过如下工艺流程制备:
已知:①
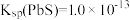 、
、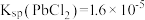 、
、 ;
;②
 ;
;③
 具有强氧化性。
具有强氧化性。回答下列问题:
(1)“浸取”时,若要提高浸取率,可采取的措施有
(2)已知“高温焙烧”铅转化为
 ,则产生气体Ⅱ的离子反应方程式为
,则产生气体Ⅱ的离子反应方程式为(3)“溶浸”过程中,若未加入过量的
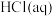 ,则会导致的后果是
,则会导致的后果是A.
 B.
B. C.
C. D.
D.
(4)生成
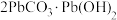 的离子反应方程式为
的离子反应方程式为
您最近一年使用:0次
名校
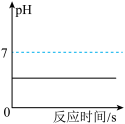
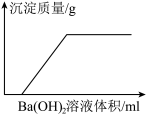
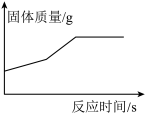
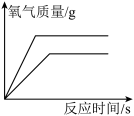
10 . 下列图像能够正确体现对应操作的是
|
|
|
|
| 图甲 | 图乙 | 图丙 | 图丁 |
| A.图甲:在稀盐酸中加入少量硝酸银固体 |
| B.图乙:在混有少量硫酸的硫酸钠溶液中加入氢氧化钡溶液 |
| C.图丙:在铜、铁固体混合物中加入足量的硝酸银溶液 |
| D.图丁:在质量相等、浓度相同的两份双氧水中,向其中一份加入适量二氧化锰 |
您最近一年使用:0次
2023-10-02更新
|
180次组卷
|
4卷引用:重庆市第十八中学2023-2024学年高一上学期第一次月考化学试题