名校
1 . 完成下列问题。
(1)为了证明Ag+能将Fe2+氧化为Fe3+,某同学设计了如下图所示装置:
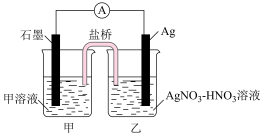
①其中甲溶液是_______ 。
②Ag电极为该电池的______ 极(填“阴或阳”或者“正或负”)
③该电池的总反应方程式为________ 。
(2)铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将 转化为N2而脱氮的影响因素和反应机理。电解法脱氮的原理可能如下:
转化为N2而脱氮的影响因素和反应机理。电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,阳极的电极反应式为______ 。
②间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化 的离子方程式
的离子方程式_____ 。25℃时,反应进行10min时,溶液的pH由6变为2时,其NH4+的平均反应速率为____ mol∙L−1∙min−1。
(1)为了证明Ag+能将Fe2+氧化为Fe3+,某同学设计了如下图所示装置:

①其中甲溶液是
②Ag电极为该电池的
③该电池的总反应方程式为
(2)铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将
 转化为N2而脱氮的影响因素和反应机理。电解法脱氮的原理可能如下:
转化为N2而脱氮的影响因素和反应机理。电解法脱氮的原理可能如下:①直接电氧化
在碱性条件下,阳极的电极反应式为
②间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化
 的离子方程式
的离子方程式
您最近一年使用:0次
名校
2 . 二氧化铅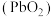 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
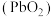 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是A.X是 ,Y是 ,Y是 |
B.还原产物与氧化产物的物质的量之比为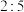 |
C.当生成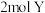 时,转移 时,转移 电子 电子 |
D.根据上述反应推测 不能氧化 不能氧化 |
您最近一年使用:0次
2024-02-27更新
|
227次组卷
|
3卷引用:重庆市巴蜀中学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
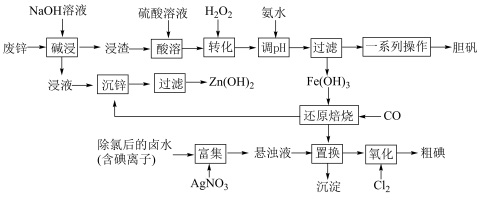
3 . 某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: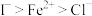
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为___________ 。
(2)“转化”中,加入足量 的目的是
的目的是___________ 。
(3)“调pH”时需控制该溶液的pH范围为___________ 之间。“调pH”之后,需要加热煮沸10min,冷却后再“过滤”。煮沸10min的作用是___________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为___________ 。
(5)“置换”反应的离子方程式为___________ 。
(6)“氧化”过程中若反应物用量比 时,氧化产物为
时,氧化产物为___________ (填化学式):当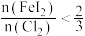 时,单质碘的收率会降低,原因是
时,单质碘的收率会降低,原因是 会将碘氧化为
会将碘氧化为 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。采用升华法可精制粗碘,该过程需选择下列仪器中的___________ (填序号,夹持装置略)。
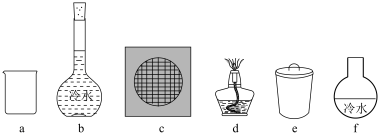
(7)胆矾结晶水测定:
①称量干燥坩埚的质量为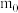 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为___________ (写表达式)。
②下列操作中,会导致结晶水数目测定值偏低的是___________ (填标号)。
a.实验前胆矾未充分干燥
b.加热时有少量胆矾迸溅出来
c.加热时部分样品由白色变为黑色
d.加热后的 放在空气中冷却后称量
放在空气中冷却后称量
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
| 沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
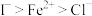
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量
 的目的是
的目的是(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“置换”反应的离子方程式为
(6)“氧化”过程中若反应物用量比
 时,氧化产物为
时,氧化产物为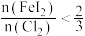 时,单质碘的收率会降低,原因是
时,单质碘的收率会降低,原因是 会将碘氧化为
会将碘氧化为 ,写出该反应的化学方程式
,写出该反应的化学方程式
(7)胆矾结晶水测定:
①称量干燥坩埚的质量为
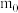 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为②下列操作中,会导致结晶水数目测定值偏低的是
a.实验前胆矾未充分干燥
b.加热时有少量胆矾迸溅出来
c.加热时部分样品由白色变为黑色
d.加热后的
 放在空气中冷却后称量
放在空气中冷却后称量
您最近一年使用:0次
4 .  是一种重要的无机功能材料,将粗
是一种重要的无机功能材料,将粗 (含较多
(含较多 和
和 杂质)样品提纯的工艺路线如下。
杂质)样品提纯的工艺路线如下。
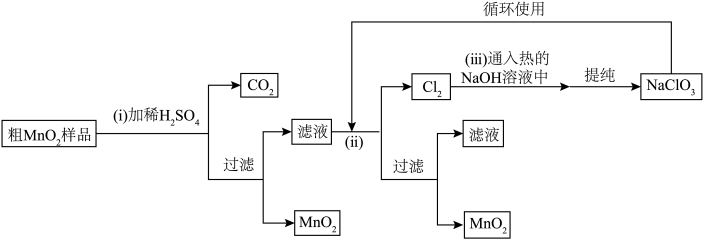
按要求回答下列问题:
(1)本实验第(ⅰ)步需要用 的稀
的稀 ,现采用市售浓硫酸来配制该溶液。
,现采用市售浓硫酸来配制该溶液。
①配制该溶液时,除烧杯、量筒、玻璃棒外,还缺少的玻璃仪器是___________ (填写名称)。
②如图为市售浓硫酸试剂瓶上所贴标签的部分内容。经计算,本配制实验需要用量筒量取该浓硫酸的体积为___________  。
。
③下列操作会使配得的硫酸溶液浓度偏低的是___________ (填标号)。
a.量取浓硫酸时俯视量筒的刻度线
b.定容时俯视容量瓶的度线
c.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
d.转移洗涤液时酒到容量瓶外,继续用该未清洗的容量瓶重新配制
④使用浓硫酸时,存在一定的安全风险。实验方案中出现的图标 和
和 ,前者提示实验者结束实验后需清洗双手,后者要求实验者
,前者提示实验者结束实验后需清洗双手,后者要求实验者___________ (填防护措施)。关于实验操作及实验室突发事件的应对措施,下列说法正确的是___________ (填标号)。
a.稀释浓硫酸时,应将水缓慢注入浓硫酸中,并不断搅拌
b.皮肤溅上酸液,先用大量水冲洗,再涂上3%~5%的硼酸溶液
c.眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗
d.少量酸滴到实验桌上,应立即用湿抹布擦净,然后用水冲洗抹布
(2)第(ⅰ)步加稀 时,粗
时,粗 样品中的
样品中的___________ (写出化学式)转化为可溶性物质。
(3)第一次过滤后,所得 需要洗涤,判断其已洗涤干净的方法是
需要洗涤,判断其已洗涤干净的方法是___________ 。
(4)完成第(ⅱ)步相关的离子反应:_________

(5)第(ⅲ)步主要发生的反应为歧化反应(氧化剂和还原剂为同一种物质的反应),该反应中,氧化剂和还原剂的物质的量之比为___________ 。
 是一种重要的无机功能材料,将粗
是一种重要的无机功能材料,将粗 (含较多
(含较多 和
和 杂质)样品提纯的工艺路线如下。
杂质)样品提纯的工艺路线如下。
按要求回答下列问题:
(1)本实验第(ⅰ)步需要用
 的稀
的稀 ,现采用市售浓硫酸来配制该溶液。
,现采用市售浓硫酸来配制该溶液。①配制该溶液时,除烧杯、量筒、玻璃棒外,还缺少的玻璃仪器是
②如图为市售浓硫酸试剂瓶上所贴标签的部分内容。经计算,本配制实验需要用量筒量取该浓硫酸的体积为
 。
。| 硫酸(化学纯) 分子式:  相对分子质量:98 密度:  质量分数:98% |
a.量取浓硫酸时俯视量筒的刻度线
b.定容时俯视容量瓶的度线
c.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
d.转移洗涤液时酒到容量瓶外,继续用该未清洗的容量瓶重新配制
④使用浓硫酸时,存在一定的安全风险。实验方案中出现的图标
 和
和 ,前者提示实验者结束实验后需清洗双手,后者要求实验者
,前者提示实验者结束实验后需清洗双手,后者要求实验者a.稀释浓硫酸时,应将水缓慢注入浓硫酸中,并不断搅拌
b.皮肤溅上酸液,先用大量水冲洗,再涂上3%~5%的硼酸溶液
c.眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗
d.少量酸滴到实验桌上,应立即用湿抹布擦净,然后用水冲洗抹布
(2)第(ⅰ)步加稀
 时,粗
时,粗 样品中的
样品中的(3)第一次过滤后,所得
 需要洗涤,判断其已洗涤干净的方法是
需要洗涤,判断其已洗涤干净的方法是(4)完成第(ⅱ)步相关的离子反应:

(5)第(ⅲ)步主要发生的反应为歧化反应(氧化剂和还原剂为同一种物质的反应),该反应中,氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
名校
5 . 下列关于物质的性质对应用途的说法错误的是
A.高铁酸钾 具有强氧化性,能杀菌消毒,所以可以用作消毒剂 具有强氧化性,能杀菌消毒,所以可以用作消毒剂 |
B. 具有很强的毒性,所以不能用于自来水的杀菌消毒 具有很强的毒性,所以不能用于自来水的杀菌消毒 |
C. 溶液显血红色,所以可以在影视剧中用作替代血液的道具 溶液显血红色,所以可以在影视剧中用作替代血液的道具 |
| D.钛合金因为其生物相容性好,所以可以用作人造骨骼 |
您最近一年使用:0次
2024-02-20更新
|
145次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一上学期1月期末化学试题
6 . KMnO4具有强氧化性,实验室可用其与浓盐酸反应制备氯气。
(1)配平下列有关反应的化学方程式____ ,___KMnO4+___HCl(浓)= __MnCl2 +__ KCl+___Cl2↑+__H2O。
(2)反应中,氧化剂是________ (填化学式,下同),氧化产物是________ 。元素化合价升高的元素是________ ,氧化剂与还原剂的个数之比为_______ 。
(3)盐酸在上述反应中体现出的性质有_______ (填序号)
①氧化性 ②还原性 ③碱性 ④酸性
(4)湿法制备高铁酸钾( K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、 、Cl-、H2O,写出该反应的离子方程式:
、Cl-、H2O,写出该反应的离子方程式:_______ 。
(1)配平下列有关反应的化学方程式
(2)反应中,氧化剂是
(3)盐酸在上述反应中体现出的性质有
①氧化性 ②还原性 ③碱性 ④酸性
(4)湿法制备高铁酸钾( K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O,写出该反应的离子方程式:
、Cl-、H2O,写出该反应的离子方程式:
您最近一年使用:0次
名校
7 . 实验室制备 的原理是用
的原理是用 (亚氯酸钠)固体与氯气反应:
(亚氯酸钠)固体与氯气反应: 。下图是实验室用于制备和收集一定量纯净的
。下图是实验室用于制备和收集一定量纯净的 的装置(某些夹持装置省略)。其中E中盛有
的装置(某些夹持装置省略)。其中E中盛有 液体。已知:
液体。已知: 易溶于
易溶于 ;
; 易溶于水,难溶于
易溶于水,难溶于 。
。
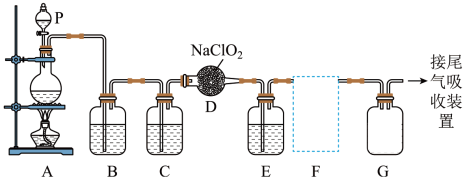
(1)仪器P的名称是___________ , 装置中所盛试剂是
装置中所盛试剂是___________ 。
(2)写出装置A中烧瓶内发生反应的离方程式:___________ 。
(3)F为 收集装置,应选用的装置是
收集装置,应选用的装置是___________ (填序号)。E装置的作用为___________ 。

(4)工业上采用盐酸或双氧水与 反应制备
反应制备 。配平下列化学方程式。
。配平下列化学方程式。_________
___________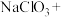 ___________
___________ ___________
___________ ___________
___________ ___________
___________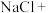 ___________
___________ 。
。
(5)若快速制备氯气时,有以下两种方法,① 与浓盐酸;②
与浓盐酸;② 与浓盐酸。若产生等量的
与浓盐酸。若产生等量的 ,则①与②转移的电子数之比为
,则①与②转移的电子数之比为___________ 。通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的高低。 和
和 在消毒时自身均被还原
在消毒时自身均被还原 ,则
,则 的消毒效率是
的消毒效率是 的
的___________ 倍(保留两位小数)。
 的原理是用
的原理是用 (亚氯酸钠)固体与氯气反应:
(亚氯酸钠)固体与氯气反应: 。下图是实验室用于制备和收集一定量纯净的
。下图是实验室用于制备和收集一定量纯净的 的装置(某些夹持装置省略)。其中E中盛有
的装置(某些夹持装置省略)。其中E中盛有 液体。已知:
液体。已知: 易溶于
易溶于 ;
; 易溶于水,难溶于
易溶于水,难溶于 。
。
(1)仪器P的名称是
 装置中所盛试剂是
装置中所盛试剂是(2)写出装置A中烧瓶内发生反应的离方程式:
(3)F为
 收集装置,应选用的装置是
收集装置,应选用的装置是
(4)工业上采用盐酸或双氧水与
 反应制备
反应制备 。配平下列化学方程式。
。配平下列化学方程式。___________
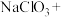 ___________
___________ ___________
___________ ___________
___________ ___________
___________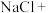 ___________
___________ 。
。(5)若快速制备氯气时,有以下两种方法,①
 与浓盐酸;②
与浓盐酸;② 与浓盐酸。若产生等量的
与浓盐酸。若产生等量的 ,则①与②转移的电子数之比为
,则①与②转移的电子数之比为 和
和 在消毒时自身均被还原
在消毒时自身均被还原 ,则
,则 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次
名校
解题方法
8 . 高铁酸钠( )通过强烈的氧化作用杀灭细菌,同时产生有强吸附性的
)通过强烈的氧化作用杀灭细菌,同时产生有强吸附性的 胶体。
胶体。 常用于生活用水的净化和消毒杀菌,制备
常用于生活用水的净化和消毒杀菌,制备 的方法主要有两种。
的方法主要有两种。
Ⅰ.湿法制备原理:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 。 在水中电离的方程式为
在水中电离的方程式为___________ 。
(2) 净水产生
净水产生 胶体,其微粒的粒径大小范围为
胶体,其微粒的粒径大小范围为___________ ,分离 胶体和
胶体和 溶液的实验名称为
溶液的实验名称为___________ 。
Ⅱ.干法制备原理: 。
。
(3) 溶液的保存需要添加铁粉,其作用为
溶液的保存需要添加铁粉,其作用为___________ (用离子方程式解释)。
(4)上述反应中的氧化产物有___________ 。该反应中 作氧化剂和还原剂的个数比为
作氧化剂和还原剂的个数比为___________ 。每生成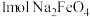 转移电子的数目为
转移电子的数目为___________ 。
 )通过强烈的氧化作用杀灭细菌,同时产生有强吸附性的
)通过强烈的氧化作用杀灭细菌,同时产生有强吸附性的 胶体。
胶体。 常用于生活用水的净化和消毒杀菌,制备
常用于生活用水的净化和消毒杀菌,制备 的方法主要有两种。
的方法主要有两种。Ⅰ.湿法制备原理:

(1)
 中铁元素的化合价为
中铁元素的化合价为 在水中电离的方程式为
在水中电离的方程式为(2)
 净水产生
净水产生 胶体,其微粒的粒径大小范围为
胶体,其微粒的粒径大小范围为 胶体和
胶体和 溶液的实验名称为
溶液的实验名称为Ⅱ.干法制备原理:
 。
。(3)
 溶液的保存需要添加铁粉,其作用为
溶液的保存需要添加铁粉,其作用为(4)上述反应中的氧化产物有
 作氧化剂和还原剂的个数比为
作氧化剂和还原剂的个数比为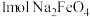 转移电子的数目为
转移电子的数目为
您最近一年使用:0次
名校
9 .  (相对分子质量为:168.5)微溶于水、不潮解、相对稳定,是一种无机抗菌剂。以菱镁矿(主要成分为
(相对分子质量为:168.5)微溶于水、不潮解、相对稳定,是一种无机抗菌剂。以菱镁矿(主要成分为 ,还含有少量
,还含有少量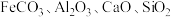 )为主要原料,制备
)为主要原料,制备 的工业流程如下图所示,请回答下列问题:
的工业流程如下图所示,请回答下列问题:

已知:①该工艺条件下,有关金属离子开始沉淀和沉淀完全的 见下表
见下表
②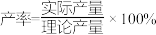
(1) 所属物质类别为
所属物质类别为___________ 盐(填“酸式”或“碱式”或“正”),该物质在稀硫酸溶液中具有杀菌、漂白作用,其原因是___________ (用离子方程式解释)。
(2)滤渣①的成分为___________ 。
(3)“氧化”时,不能在较高温度下进行,可能的原因是________ , 的作用是
的作用是_________ (用离子方程式表示)。
(4)“调 ”时,加入物质X将该溶液的
”时,加入物质X将该溶液的 范围应调节为
范围应调节为___________ ~9.5之间,最适宜使用的X是___________ (填标号)
A. B.
B. C.
C.
(5)“沉镁”后,得到的 产品还需洗涤,证明产品已洗涤干净的方法是
产品还需洗涤,证明产品已洗涤干净的方法是___________ 。
(6)某工厂用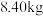 菱镁矿(
菱镁矿( 的质量分数为
的质量分数为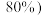 制备
制备 ,最终得到产品
,最终得到产品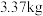 ,产率为
,产率为___________ 。
 (相对分子质量为:168.5)微溶于水、不潮解、相对稳定,是一种无机抗菌剂。以菱镁矿(主要成分为
(相对分子质量为:168.5)微溶于水、不潮解、相对稳定,是一种无机抗菌剂。以菱镁矿(主要成分为 ,还含有少量
,还含有少量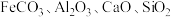 )为主要原料,制备
)为主要原料,制备 的工业流程如下图所示,请回答下列问题:
的工业流程如下图所示,请回答下列问题:
已知:①该工艺条件下,有关金属离子开始沉淀和沉淀完全的
 见下表
见下表| 金属氢氧化物 | 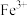 | 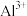 | 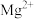 |
开始沉淀的 | 2.3 | 3.5 | 9.5 |
完全沉淀的 | 3.2 | 4.6 | 11.1 |
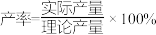
(1)
 所属物质类别为
所属物质类别为(2)滤渣①的成分为
(3)“氧化”时,不能在较高温度下进行,可能的原因是
 的作用是
的作用是(4)“调
 ”时,加入物质X将该溶液的
”时,加入物质X将该溶液的 范围应调节为
范围应调节为A.
 B.
B. C.
C.
(5)“沉镁”后,得到的
 产品还需洗涤,证明产品已洗涤干净的方法是
产品还需洗涤,证明产品已洗涤干净的方法是(6)某工厂用
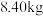 菱镁矿(
菱镁矿( 的质量分数为
的质量分数为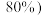 制备
制备 ,最终得到产品
,最终得到产品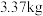 ,产率为
,产率为
您最近一年使用:0次
名校
10 . 钠及其化合物在生活和生产中有重要用途。
(1) 因外观和食盐相似,有咸味,容易使人误食中毒。已知
因外观和食盐相似,有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: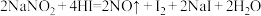 。请回答:
。请回答:
①上述反应中,氧化产物是___________ (填化学式),其中HI在反应中体现出的性质为___________ (填字母)。
A.酸性 B.氧化性 C.碱性 D.还原性
②某厂废液中含有3%~6%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是___________ (填字母)。
A.NaClO B. C.
C. D.
D.
(2) 是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
①写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
②将二氧化碳和水蒸气组成的混合气体8.0g通过足量的 粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为
粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为___________ 。
③将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,完全反应后,溶液中上述离子数目几乎不变的是
,完全反应后,溶液中上述离子数目几乎不变的是___________ (填离子符号)。
(3) 是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
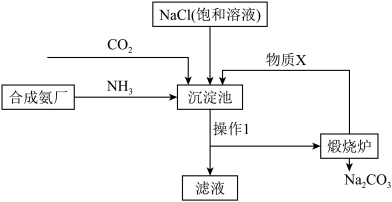
①上述流程中,物质X是___________ (填化学式)。
②写出沉淀池的化学反应方程式___________ 。
③下列关于侯德榜“联合制碱法”说法错误的是___________ (填字母)。
A.上述流程中滤液中可分离得到一种氮肥
B.上述流程应在饱和NaCl溶液中先通 ,再通
,再通
C.沉淀池中析出晶体利用了相同条件下物质溶解度的差异
D.该工艺的碳原子利用率理论上为100%
(1)
 因外观和食盐相似,有咸味,容易使人误食中毒。已知
因外观和食盐相似,有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: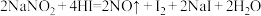 。请回答:
。请回答:①上述反应中,氧化产物是
A.酸性 B.氧化性 C.碱性 D.还原性
②某厂废液中含有3%~6%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是A.NaClO B.
 C.
C. D.
D.
(2)
 是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。①写出
 与
与 反应的化学方程式
反应的化学方程式②将二氧化碳和水蒸气组成的混合气体8.0g通过足量的
 粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为
粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为③将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,完全反应后,溶液中上述离子数目几乎不变的是
,完全反应后,溶液中上述离子数目几乎不变的是(3)
 是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
①上述流程中,物质X是
②写出沉淀池的化学反应方程式
③下列关于侯德榜“联合制碱法”说法错误的是
A.上述流程中滤液中可分离得到一种氮肥
B.上述流程应在饱和NaCl溶液中先通
 ,再通
,再通
C.沉淀池中析出晶体利用了相同条件下物质溶解度的差异
D.该工艺的碳原子利用率理论上为100%
您最近一年使用:0次



