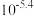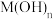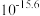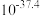名校
解题方法
1 . 硫的氟化物通常是无色、无臭、无毒的气体,性质稳定且有优良绝缘性能,常用作高压发电机的绝缘气体。制备 的反应为:
的反应为: ,若生成11.2L
,若生成11.2L  气体(标准状况下),则下列说法正确的是(已知阿伏加德罗常数的值为
气体(标准状况下),则下列说法正确的是(已知阿伏加德罗常数的值为 )
)
 的反应为:
的反应为: ,若生成11.2L
,若生成11.2L  气体(标准状况下),则下列说法正确的是(已知阿伏加德罗常数的值为
气体(标准状况下),则下列说法正确的是(已知阿伏加德罗常数的值为 )
)A.反应中转移电子的数目为1.5 |
| B.还原产物的质量为67.5克 |
C. 分子中的σ键与π键的数目之比为2∶1 分子中的σ键与π键的数目之比为2∶1 |
D.加入 能降低该反应的反应热 能降低该反应的反应热 |
您最近一年使用:0次
名校
解题方法
2 .  沸点为-87.5℃,可与
沸点为-87.5℃,可与 浴液反应:
浴液反应: ,
, 为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是
 沸点为-87.5℃,可与
沸点为-87.5℃,可与 浴液反应:
浴液反应: ,
, 为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是A.生成1mol ,转移的电子数为2 ,转移的电子数为2 |
B.生成2mol ,断裂的P-H键与O-H键数目比为3∶4 ,断裂的P-H键与O-H键数目比为3∶4 |
C.消耗标准状况下11.2L ,生成2molCu ,生成2molCu |
D.消耗含有孤电子对数4 的 的 ,生成2mol ,生成2mol |
您最近一年使用:0次
名校
解题方法
3 .  纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为
纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为 ,含有少量CaO、MgO、FeO、
,含有少量CaO、MgO、FeO、 、
、 等)制备
等)制备 纳米材料的工艺流程如图所示。
纳米材料的工艺流程如图所示。 如表所示。
如表所示。
回答下列问题:
(1)“酸浸”中提高反应速率的可行措施有___________ (任答一条);酸浸渣的主要成分是___________ (填化学式)。
(2)加入 的目的是氧化
的目的是氧化___________ (填离子符号),写出该离子被氧化生成沉淀的离子方程式:___________ 。
(3)回收的沉淀可与浓硫酸反应生成能腐蚀玻璃的气体, 与浓硫酸在加热的条件下反应的化学方程式为
与浓硫酸在加热的条件下反应的化学方程式为___________ ;25℃时,沉淀后的滤液中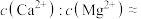
___________ (写最简整数比)。
(4)用去离子水多次洗涤 纳米材料,检验沉淀是否洗涤干净的操作为
纳米材料,检验沉淀是否洗涤干净的操作为___________ 。
(5)“高压釜水热反应”溶液pH应调节为中性,而不能过高的原因是___________ 。
 纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为
纳米材料是一种很有发展前景的储能材料,用菱锰矿(主要成分为 ,含有少量CaO、MgO、FeO、
,含有少量CaO、MgO、FeO、 、
、 等)制备
等)制备 纳米材料的工艺流程如图所示。
纳米材料的工艺流程如图所示。
 如表所示。
如表所示。| 物质 |  |  |  |  |
 | 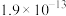 |  | 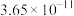 | 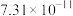 |
| 物质 |  |  |  | |
 | 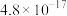 | 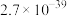 |  |
(1)“酸浸”中提高反应速率的可行措施有
(2)加入
 的目的是氧化
的目的是氧化(3)回收的沉淀可与浓硫酸反应生成能腐蚀玻璃的气体,
 与浓硫酸在加热的条件下反应的化学方程式为
与浓硫酸在加热的条件下反应的化学方程式为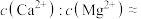
(4)用去离子水多次洗涤
 纳米材料,检验沉淀是否洗涤干净的操作为
纳米材料,检验沉淀是否洗涤干净的操作为(5)“高压釜水热反应”溶液pH应调节为中性,而不能过高的原因是
您最近一年使用:0次
2024-05-26更新
|
162次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
名校
4 . 硫酸亚铁铵[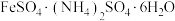 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为___________ 。
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为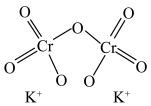 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。
(3)圆底烧瓶中生成 的离子方程式为
的离子方程式为___________ 。
(4)第二步中需要称量剩余铁屑质量的原因为___________ ,写出制备硫酸亚铁铵晶体的化学方程式:___________ 。
(5)试剂N是___________ 。
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。
①重铬酸钾在酸性条件下的还原产物为 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:___________ 。
②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为___________ (写出含M的表达式)。
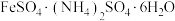 ,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:
,相对分子质量为M]为浅绿色晶体,在空气中能稳定存在,不易被氧化,溶于水,不溶于乙醇、实验室制备过程如下:第一步:在圆底烧瓶中称取mg铁屑,再用量筒量取15mL
 的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。
的稀硫酸,实验装置如图所示,在80℃条件下电磁搅拌反应3min。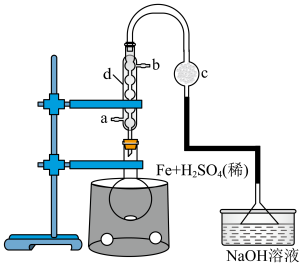
 溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。
溶液的蒸发皿中,水浴加热搅拌至硫酸铵全部溶解,停止搅拌,继续蒸发浓缩直至表面有晶膜出现。第三步:冷却至室温,待有大量晶体析出时,减压过滤,用试剂N少量多次洗涤,干燥后,称得晶体质量为11.8g。计算产率。
回答下列问题:
(1)硫酸亚铁铵中组成元素的原子半径由大到小的顺序为
(2)已知:Cr的3d比4p能量低得多,重铬酸钾具有二聚结构,它由两个通过氧原子键合在一起的铬原子组成,中心Cr为正四面体形,结构为
 ,其中Cr原子的杂化方式为___________(填标号)。
,其中Cr原子的杂化方式为___________(填标号)。A. | B. | C. | D.sp |
(3)圆底烧瓶中生成
 的离子方程式为
的离子方程式为(4)第二步中需要称量剩余铁屑质量的原因为
(5)试剂N是
(6)准确称取0.8g硫酸亚铁铵晶体三份,分别放入三个250mL锥形瓶中,加入100mL水,20mL
 的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用
的硫酸。1g氟化铵固体(不参与反应,有利于滴定终点的判断)。6~8滴二苯胺磺酸钠指示剂,用 重铬酸钾标准液进行滴定。
重铬酸钾标准液进行滴定。①重铬酸钾在酸性条件下的还原产物为
 ,写出该滴定反应的离子方程式:
,写出该滴定反应的离子方程式:②三次实验消耗标准液的体积分别是16.75mL、16.80mL、16.85mL,则硫酸亚铁铵晶体的纯度为
您最近一年使用:0次
2024-05-26更新
|
124次组卷
|
2卷引用:2024届重庆市渝西中学高三下学期模拟预测化学试题
名校
5 . 下列说法错误的是
| A.维生素C具有还原性,是水果罐头中常用的抗氧化剂 |
| B.六六六等有机氯杀虫剂对人体的毒性较低被广泛使用 |
| C.氮肥的使用给农业带来丰收,对人类作出了巨大贡献 |
| D.燃料脱硫、脱硝的目的是减少空气污染和酸雨的产生 |
您最近一年使用:0次
6 . 已知: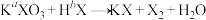 (未配平),下列说法不正确的是
(未配平),下列说法不正确的是
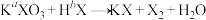 (未配平),下列说法不正确的是
(未配平),下列说法不正确的是A.基态X原子的价层电子排布式为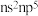 |
| B.HX的水溶液呈强酸性 |
| C.AgX一定是难溶于水的沉淀 |
D.若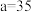 , ,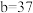 ,则 ,则 的相对分子质量为72 的相对分子质量为72 |
您最近一年使用:0次
名校
7 . 利用高压氨浸法从黄铜矿中提取铜具有提取率高、污染小等优点,被广泛使用。一种由黄铜矿(主要成分为 ,含少量
,含少量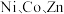 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下:
I.“固液分离”后溶液中主要离子为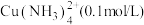 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为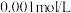 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为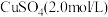 。
。
Ⅱ.不稳定常数对 ,不稳定常数
,不稳定常数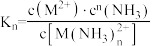
Ⅲ.溶度积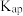
(1)基态 原子的价电子排布式为
原子的价电子排布式为________________ , 中氮原子的杂化方式为
中氮原子的杂化方式为_______________ 。
(2)①浸出前“粉碎磨矿”的目的是_______________ ,②“固液分离”用到的操作是_______________ 。
(3)①“搅拌浸出”主要成分反应的化学方程式为______________ 。(已知:硫元素变成最高价,铁元素变成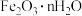 );
);
②铁元素没有以配合物离子存在的原因是__________________ 。
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为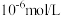 ],需调节
],需调节 至
至___________ ,“萃取”和“反萃取”的作用为________________ 。
 ,含少量
,含少量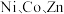 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下: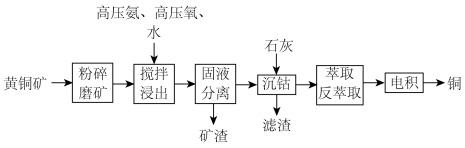
I.“固液分离”后溶液中主要离子为
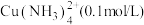 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为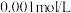 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为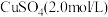 。
。Ⅱ.不稳定常数对
 ,不稳定常数
,不稳定常数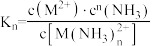
|
|
|
不稳定常数 |
| 0.2 |
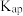
|
|
|
溶度积 |
|
|
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 中氮原子的杂化方式为
中氮原子的杂化方式为(2)①浸出前“粉碎磨矿”的目的是
(3)①“搅拌浸出”主要成分反应的化学方程式为
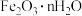 );
);②铁元素没有以配合物离子存在的原因是
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为
 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为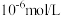 ],需调节
],需调节 至
至
您最近一年使用:0次
名校
解题方法
8 . 电解产生羟基自由基( )可用于处理酸性废水中的苯酚,原理如图,下列说法错误的是
)可用于处理酸性废水中的苯酚,原理如图,下列说法错误的是
 )可用于处理酸性废水中的苯酚,原理如图,下列说法错误的是
)可用于处理酸性废水中的苯酚,原理如图,下列说法错误的是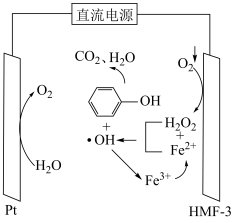
A.过氧化氢与 的反应中, 的反应中, 是还原产物 是还原产物 |
B.电流方向:电极 →电解质→电极 →电解质→电极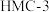 |
C.得到 的电极反应为 的电极反应为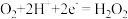 |
D.每处理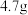 苯酚,需 苯酚,需 的物质的量为 的物质的量为 |
您最近一年使用:0次
名校
9 . 氮化铍可用于新型的耐火陶瓷材料和反应堆材料,可由铍粉和干燥氮气在无氧气氛中于700~1400℃的温度下加热制得。以绿柱石(主要组成是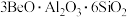 ,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。 如表所示。
如表所示。
回答下列问题:
(1)“酸浸”时绿柱石要进行粉碎,其目的是_______ 。
(2)“转化”时加入 的目的是
的目的是_______ (用离子方程式表示)。
(3)“调 ”时加入适量
”时加入适量 细粉除去
细粉除去 和
和 ,调节溶液
,调节溶液 的范围是
的范围是_______ ,其中沉淀 的离子方程式为
的离子方程式为_______ ,“滤渣2”的主要成分是_______ (填化学式)。
(4)“沉铍”时所加试剂 是
是_______ (填“氨水”或“ 溶液”)。
溶液”)。
(5)生成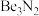 的化学方程式为
的化学方程式为_______ 。
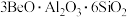 ,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
,还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。
 如表所示。
如表所示。| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.3 | 1.8 | 3.1 | 5.6 | 12.4 |
| 沉淀完全pH | 8.3 | 3.2 | 4.8 | 8.5 | 13.8 |
(1)“酸浸”时绿柱石要进行粉碎,其目的是
(2)“转化”时加入
 的目的是
的目的是(3)“调
 ”时加入适量
”时加入适量 细粉除去
细粉除去 和
和 ,调节溶液
,调节溶液 的范围是
的范围是 的离子方程式为
的离子方程式为(4)“沉铍”时所加试剂
 是
是 溶液”)。
溶液”)。(5)生成
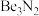 的化学方程式为
的化学方程式为
您最近一年使用:0次
2024-05-16更新
|
27次组卷
|
2卷引用:重庆市荣昌永荣中学校2024届高三下学期模拟预测化学试题2
名校
10 . 利用废电池材料 (含炭黑及少量
(含炭黑及少量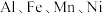 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下: 如下表:
如下表:
②电极电位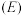 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应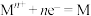 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。
酸性条件: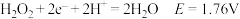 ;
;
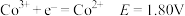
碱性条件: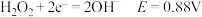 ;
;
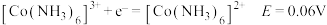
③丁二酮肟是不溶于水的固体,溶于乙醇后可与 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为______ ,滤渣1为______ 。
(2)“氧化调 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有______ ,调节 范围为
范围为______ 。
(3)“转化”时,加入浓氨水将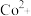 转化为
转化为 的原因是
的原因是______ ,加 目的是
目的是______ 。
(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是______ 。
(5)由 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式______ 。
(6)由 制备得一种锂离子电池材料
制备得一种锂离子电池材料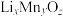 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则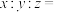
______ 。
 (含炭黑及少量
(含炭黑及少量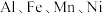 等元素)回收金属资源的工艺流程如下:
等元素)回收金属资源的工艺流程如下:
 如下表:
如下表:氢氧化物 |
|
|
|
|
完全沉淀 | 9.2 | 1.3 | 4.7 | 3.1 |
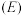 表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应
表示溶液中某微粒获得电子被还原的趋势(即氧化性);如电极反应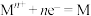 的
的 越大,表示
越大,表示 的氧化性越强。
的氧化性越强。酸性条件:
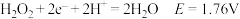 ;
;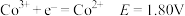
碱性条件:
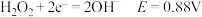 ;
;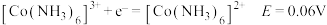
③丁二酮肟是不溶于水的固体,溶于乙醇后可与
 反应生成丁二酮肟镍。
反应生成丁二酮肟镍。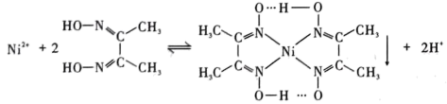
 转化后的钴离子价电子排布式为
转化后的钴离子价电子排布式为(2)“氧化调
 "中,
"中, 转化为
转化为 ,滤渣2中还有
,滤渣2中还有 范围为
范围为(3)“转化”时,加入浓氨水将
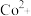 转化为
转化为 的原因是
的原因是 目的是
目的是(4)“沉镍”后,从滤渣3中回收丁二酮肟固体的操作是
(5)由
 溶液制备催化剂
溶液制备催化剂 的步骤为:第一步加入尿素
的步骤为:第一步加入尿素 生成
生成 沉淀(有
沉淀(有 气体产生),第二步焙烧得到
气体产生),第二步焙烧得到 。写出第一步的离子方程式
。写出第一步的离子方程式(6)由
 制备得一种锂离子电池材料
制备得一种锂离子电池材料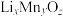 ,其晶胞分别由4个
,其晶胞分别由4个 个
个 立方单元构成。则
立方单元构成。则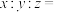

您最近一年使用:0次
2024-05-16更新
|
169次组卷
|
2卷引用:2024届重庆市南开中学校高三下学期5月月考化学试题



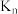 (常温)
(常温)