1 . 从高碳钼精矿(主要含有MoS2、NiS、CaCO3和石墨)中提取镍和钼的化合物,其主要工艺流程如图所示:
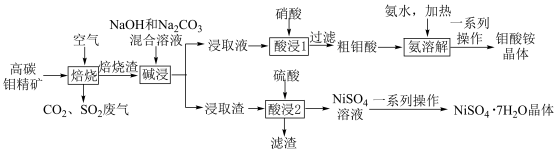
已知:焙烧渣的主要成分为MoO3、CaMoO4、NiMoO4、CaSO4。回答下列问题:
(1)Mo与Cr同族,原子序数为42,则基态Mo原子的价电子排布式为___________ 。
(2)“焙烧”过程中 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
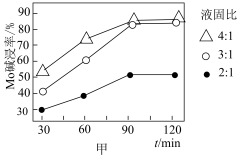
(3)“碱浸”过程中,液固比(NaOH和 混合溶液的体积与焙烧渣的质量比)与碱浸率之间的关系如图甲所示,则“碱浸”时应选用的最佳液固比为
混合溶液的体积与焙烧渣的质量比)与碱浸率之间的关系如图甲所示,则“碱浸”时应选用的最佳液固比为___________ 。
(4)已知常温下相关物质的Ksp如下表,则浸取渣的主要成分是___________ (填化学式)。
(5)“氨溶解”过程中需要控制温度在70℃左右,温度不宜过高的原因是___________ 。
(6)取一定量的NiSO4·7H2O样品进行热重分析,样品在受热过程中的固体残留率随温度变化的曲线如图乙所示。
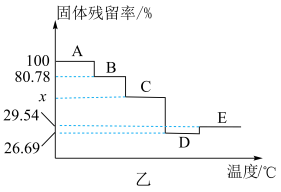
①已知C时失掉全部结晶水,则C时的固体残留率为___________ %(保留两位小数),E时残留固体的化学式为___________ 。
②镍可以形成多种氧化物,其中一种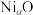 晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为
晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为 、
、 ,则晶体中
,则晶体中 与
与 的最简整数比为
的最简整数比为___________ ,晶胞参数为428pm,则晶体密度为___________  (
( 表示阿伏加德罗常数的值,列出计算式即可)。
表示阿伏加德罗常数的值,列出计算式即可)。

已知:焙烧渣的主要成分为MoO3、CaMoO4、NiMoO4、CaSO4。回答下列问题:
(1)Mo与Cr同族,原子序数为42,则基态Mo原子的价电子排布式为
(2)“焙烧”过程中
 转化为
转化为 的化学方程式为
的化学方程式为(3)“碱浸”过程中,液固比(NaOH和
 混合溶液的体积与焙烧渣的质量比)与碱浸率之间的关系如图甲所示,则“碱浸”时应选用的最佳液固比为
混合溶液的体积与焙烧渣的质量比)与碱浸率之间的关系如图甲所示,则“碱浸”时应选用的最佳液固比为
(4)已知常温下相关物质的Ksp如下表,则浸取渣的主要成分是
| 物质 | 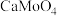 |  |  |  |
 | 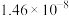 | 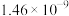 | 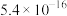 |  |
(5)“氨溶解”过程中需要控制温度在70℃左右,温度不宜过高的原因是
(6)取一定量的NiSO4·7H2O样品进行热重分析,样品在受热过程中的固体残留率随温度变化的曲线如图乙所示。

①已知C时失掉全部结晶水,则C时的固体残留率为
②镍可以形成多种氧化物,其中一种
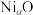 晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为
晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为 、
、 ,则晶体中
,则晶体中 与
与 的最简整数比为
的最简整数比为 (
( 表示阿伏加德罗常数的值,列出计算式即可)。
表示阿伏加德罗常数的值,列出计算式即可)。
您最近一年使用:0次
2023-11-27更新
|
350次组卷
|
2卷引用:重庆市第八中学2024届高三上学期高考适应性月考卷(三)化学试题
2 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,受热易分解,遇水和酸易变质。重庆八中某学习小组欲在实验室制备高铁酸钾并检验产品的纯度。回答下列问题:
(1)高铁酸钾的制备。
【步骤一】制备Na2FeO4,装置如图所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应。

【步骤二】由b向a中反应后液体中加入饱和KOH溶液;
【步骤三】将a中所得浊液移出,分离提纯。
①仪器a的名称为___________ ,a中制备Na2FeO4反应的离子方程式为___________ 。
②步骤二中,能得到K2FeO4悬浊液的原因为___________ 。
③K2FeO4悬浊液经过滤、洗涤、干燥,可得产品。相比用蒸馏水洗涤,选用乙醇作为洗涤剂的优点有:防止K2FeO4遇水变质、K2FeO4在乙醇中的溶解损失更小、___________ 。
(2)学习小组查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
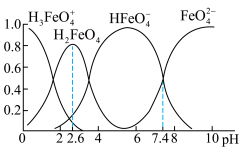
①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②已知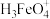 的电离常数分别为
的电离常数分别为 ,
,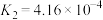 ,
, ,当pH=4时,溶液中
,当pH=4时,溶液中
___________ 。
(3)检测产品纯度的原理如图所示:K2FeO4样品溶液 滴定
滴定
具体步骤:准确称取1.98g高铁酸钾粗品配成100mL溶液,取10.00mL该待测液于锥形瓶中,加入浓碱性溶液和过量的三价铬盐;再加稀硫酸和指示剂二苯胺磺酸钠,用0.1000mol/L的硫酸亚铁铵标准液滴定至终点,重复以上步骤2~3次,平均消耗硫酸亚铁铵溶液27.00mL(假设杂质不参与反应),则该粗品中高铁酸钾的质量分数为___________ 。
(1)高铁酸钾的制备。
【步骤一】制备Na2FeO4,装置如图所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应。

【步骤二】由b向a中反应后液体中加入饱和KOH溶液;
【步骤三】将a中所得浊液移出,分离提纯。
①仪器a的名称为
②步骤二中,能得到K2FeO4悬浊液的原因为
③K2FeO4悬浊液经过滤、洗涤、干燥,可得产品。相比用蒸馏水洗涤,选用乙醇作为洗涤剂的优点有:防止K2FeO4遇水变质、K2FeO4在乙醇中的溶解损失更小、
(2)学习小组查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

①为获得尽可能纯净的高铁酸盐,pH应控制在
②已知
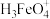 的电离常数分别为
的电离常数分别为 ,
,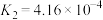 ,
, ,当pH=4时,溶液中
,当pH=4时,溶液中
(3)检测产品纯度的原理如图所示:K2FeO4样品溶液
 滴定
滴定具体步骤:准确称取1.98g高铁酸钾粗品配成100mL溶液,取10.00mL该待测液于锥形瓶中,加入浓碱性溶液和过量的三价铬盐;再加稀硫酸和指示剂二苯胺磺酸钠,用0.1000mol/L的硫酸亚铁铵标准液滴定至终点,重复以上步骤2~3次,平均消耗硫酸亚铁铵溶液27.00mL(假设杂质不参与反应),则该粗品中高铁酸钾的质量分数为
您最近一年使用:0次
2023-11-27更新
|
399次组卷
|
2卷引用:重庆市第八中学2024届高三上学期高考适应性月考卷(三)化学试题
名校
3 . 钴配合物[Co(NH3)6]Cl3溶于热水,在冷水中微溶,实验室中可由金属钴及其他原料制备。
(一) 的制备
的制备
 易潮解、实验室中利用如图所示装置(连接用橡胶管省略)进行制备。
易潮解、实验室中利用如图所示装置(连接用橡胶管省略)进行制备。

(1)仪器A的名称为
___________ 。
(2)用图中的装置组合制备CoCl2,连接顺序为
___________ 。装置丙的作用是
___________ 。
(3)装置甲中发生反应的离子方程式为
___________ 。
(二)[Co(NH3)6]Cl3的制备
步骤如下:
Ⅰ.将NH4Cl溶解。
Ⅱ.分批加入CoCl3,后,将溶液温度降至10℃以下,加入活性炭、浓氨水,搅拌下逐滴加入6%的双氧水。
Ⅲ.加热至55~60℃反应,20min。冷却、过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,进行操作X。
V.将滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体[Co(NH3)6]Cl3(M=267.5g/mol)
(4)步骤Ⅱ中,将温度降至10℃以下的原因是
___________ 。
(5)步骤Ⅳ中操作X为
___________ ,制备[Co(NH3)6]Cl3的总反应的化学方程式为
___________ 。
(6)取0.2000g[Co(NH3)6]Cl3样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴K2Cr2O4溶液做指示剂,用0.0600mol/L的AgNO3,溶液滴定至终点时,消耗AgNO3溶液的体积为10.00mL,样品的纯度为
___________ 。
(一)
 的制备
的制备 易潮解、实验室中利用如图所示装置(连接用橡胶管省略)进行制备。
易潮解、实验室中利用如图所示装置(连接用橡胶管省略)进行制备。
(1)仪器A的名称为
(2)用图中的装置组合制备CoCl2,连接顺序为
(3)装置甲中发生反应的离子方程式为
(二)[Co(NH3)6]Cl3的制备
步骤如下:
Ⅰ.将NH4Cl溶解。
Ⅱ.分批加入CoCl3,后,将溶液温度降至10℃以下,加入活性炭、浓氨水,搅拌下逐滴加入6%的双氧水。
Ⅲ.加热至55~60℃反应,20min。冷却、过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,进行操作X。
V.将滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体[Co(NH3)6]Cl3(M=267.5g/mol)
(4)步骤Ⅱ中,将温度降至10℃以下的原因是
(5)步骤Ⅳ中操作X为
(6)取0.2000g[Co(NH3)6]Cl3样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴K2Cr2O4溶液做指示剂,用0.0600mol/L的AgNO3,溶液滴定至终点时,消耗AgNO3溶液的体积为10.00mL,样品的纯度为
您最近一年使用:0次
4 . 三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种经典的光敏剂,为翠绿色的单斜晶体,溶于水而不溶于乙醇。
I.K3[Fe(C2O4)3]·3H2O 制备步骤如下:
①H2O2氧化:向FeC2O4·2H2O晶体中加入12mL饱和K2C2O4溶液,控制温度为40℃ 加热并搅拌,然后向其中缓慢滴加12mL 6%H2O2溶液,继续加热,得到K3[Fe(C2O4)3]溶液,同时有红褐色沉淀生成。
加热并搅拌,然后向其中缓慢滴加12mL 6%H2O2溶液,继续加热,得到K3[Fe(C2O4)3]溶液,同时有红褐色沉淀生成。
② 酸溶:冷却至室温后,边搅拌边向其中缓慢加入饱和H2C2O4溶液,调节pH为3~3.5, 得到翠绿色透明溶液。
③ 结晶:析出晶体
回答下列问题:
(1)FeC2O4·2H2O中Fe元素的化合价为___________ 。
(2)步骤①中采用的加热方式最好为___________ 。
(3)步骤①中发生反应的化学方程式为___________ 。
(4)步骤③中需向所得溶液中加入乙醇并用冰水浴冷却,其目的是___________ 。
Ⅱ.为探究K3[Fe(C2O4)3]·3H2O的热分解产物,按下图所示装置进行实验。

(5)通入氮气的目的是___________ 。
(6)实验中观察到装置B、F中澄清石灰水均变浑浊, 装置E中固体变为红色, 由此判断样品热分解产物中一定含有___________ 、___________ 。
(7)为防止倒吸,停止实验时应进行的操作是___________ 。
I.K3[Fe(C2O4)3]·3H2O 制备步骤如下:
①H2O2氧化:向FeC2O4·2H2O晶体中加入12mL饱和K2C2O4溶液,控制温度为40℃
 加热并搅拌,然后向其中缓慢滴加12mL 6%H2O2溶液,继续加热,得到K3[Fe(C2O4)3]溶液,同时有红褐色沉淀生成。
加热并搅拌,然后向其中缓慢滴加12mL 6%H2O2溶液,继续加热,得到K3[Fe(C2O4)3]溶液,同时有红褐色沉淀生成。② 酸溶:冷却至室温后,边搅拌边向其中缓慢加入饱和H2C2O4溶液,调节pH为3~3.5, 得到翠绿色透明溶液。
③ 结晶:析出晶体
回答下列问题:
(1)FeC2O4·2H2O中Fe元素的化合价为
(2)步骤①中采用的加热方式最好为
(3)步骤①中发生反应的化学方程式为
(4)步骤③中需向所得溶液中加入乙醇并用冰水浴冷却,其目的是
Ⅱ.为探究K3[Fe(C2O4)3]·3H2O的热分解产物,按下图所示装置进行实验。

(5)通入氮气的目的是
(6)实验中观察到装置B、F中澄清石灰水均变浑浊, 装置E中固体变为红色, 由此判断样品热分解产物中一定含有
(7)为防止倒吸,停止实验时应进行的操作是
您最近一年使用:0次
名校
解题方法
5 . 钛铁矿的主要成分为FeTiO3,含少量SiO2、Sc2O3等氧化物,某实验室利用钛铁矿制取ScF3的流程如图所示。
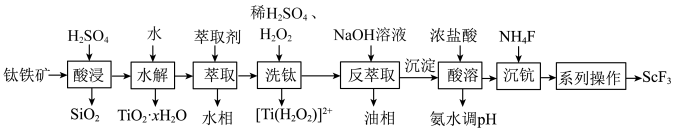
已知:①“酸浸”时FeTiO3转化为T1O2+,[TiO(H2O2)]2+为橘黄色的稳定离子,易溶于水。
②室温下,溶液中离子沉淀完全的pH如表所示。
回答下列问题:
(1)“酸浸”前将钛铁矿粉碎目的是___________ ;
(2)“水解”中生成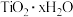 沉淀的离子方程式为
沉淀的离子方程式为___________ ,
(3)“萃取”操作之前,需要检漏的玻璃仪器是___________
(4)“洗钛”时H2O2有两个作用,其一是氧化Fe2+,离子方程式为___________ ,另一作用是___________ 。
(5)“酸溶”所得溶液中含有 、
、 等。若此溶液中
等。若此溶液中 的浓度为
的浓度为 ,“氨水调pH”时应控制的pH范围是
,“氨水调pH”时应控制的pH范围是___________ (已知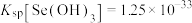 ,lg2=0.3)。
,lg2=0.3)。
(6)制取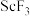 的“系列操作”包括
的“系列操作”包括___________ 、___________ 、干燥。

已知:①“酸浸”时FeTiO3转化为T1O2+,[TiO(H2O2)]2+为橘黄色的稳定离子,易溶于水。
②室温下,溶液中离子沉淀完全的pH如表所示。
| 离子 | Fe3+ | Fe2+ | TiO2- |
| 沉淀完全的pH | 3.2 | 9.0 | 1.05 |
(1)“酸浸”前将钛铁矿粉碎目的是
(2)“水解”中生成
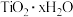 沉淀的离子方程式为
沉淀的离子方程式为(3)“萃取”操作之前,需要检漏的玻璃仪器是
(4)“洗钛”时H2O2有两个作用,其一是氧化Fe2+,离子方程式为
(5)“酸溶”所得溶液中含有
 、
、 等。若此溶液中
等。若此溶液中 的浓度为
的浓度为 ,“氨水调pH”时应控制的pH范围是
,“氨水调pH”时应控制的pH范围是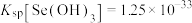 ,lg2=0.3)。
,lg2=0.3)。(6)制取
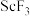 的“系列操作”包括
的“系列操作”包括
您最近一年使用:0次
名校
解题方法
6 . 化学与生产生活密切相关,请根据要求回答下列问题:
(1)纯净的液态硫酸___________ (填“能”或“几乎不能”)导电,在硫酸不断稀释的过程中,溶液导电能力的变化情况为___________ 。
(2)传统蒸馒头常采用酵头发面,再用 调节面团酸度。查阅资料得知,酵头可使面团在微生物作用下产生
调节面团酸度。查阅资料得知,酵头可使面团在微生物作用下产生 气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
①与等质量的碳酸钠和碳酸氢钠完全反应,消耗酸更多的物质的名称是___________ 。
②若面团发得不好,面团内的气孔少,略有酸味。可不用 而用
而用 ,继续揉面,上锅蒸后也能蒸出松软的馒头。用化学方程式解释
,继续揉面,上锅蒸后也能蒸出松软的馒头。用化学方程式解释 的作用
的作用___________ 。
(3)无土栽培需要配制一定组成的植物营养液。已知某植物营养液的配方为: 0.7mol⋅L
0.7mol⋅L ,
, 0.3mol⋅L
0.3mol⋅L 、
、 0.1mol⋅L
0.1mol⋅L 。若以KCl、
。若以KCl、 、
、 和
和 为原料配制1L该营养液,使用托盘天平称量KCl的质量为
为原料配制1L该营养液,使用托盘天平称量KCl的质量为___________ 。
(4)在工业上次磷酸( )常用于化学镀银,发生的反应如下:
)常用于化学镀银,发生的反应如下:
_______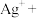 _______
_______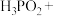 _____
_____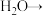 ______
______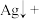 _______
_______ ______
______
① 中,P元素的化合价为
中,P元素的化合价为_______ ;该反应中, 被
被________ (填“氧化”或“还原”)。
②配平该离子方程式:___________ 。
③ 与过量NaOH溶液反应的方程式为
与过量NaOH溶液反应的方程式为 ,则
,则 是
是___________ 元酸(填“一”或“二”或“三”)。
(1)纯净的液态硫酸
(2)传统蒸馒头常采用酵头发面,再用
 调节面团酸度。查阅资料得知,酵头可使面团在微生物作用下产生
调节面团酸度。查阅资料得知,酵头可使面团在微生物作用下产生 气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。①与等质量的碳酸钠和碳酸氢钠完全反应,消耗酸更多的物质的名称是
②若面团发得不好,面团内的气孔少,略有酸味。可不用
 而用
而用 ,继续揉面,上锅蒸后也能蒸出松软的馒头。用化学方程式解释
,继续揉面,上锅蒸后也能蒸出松软的馒头。用化学方程式解释 的作用
的作用(3)无土栽培需要配制一定组成的植物营养液。已知某植物营养液的配方为:
 0.7mol⋅L
0.7mol⋅L ,
, 0.3mol⋅L
0.3mol⋅L 、
、 0.1mol⋅L
0.1mol⋅L 。若以KCl、
。若以KCl、 、
、 和
和 为原料配制1L该营养液,使用托盘天平称量KCl的质量为
为原料配制1L该营养液,使用托盘天平称量KCl的质量为(4)在工业上次磷酸(
 )常用于化学镀银,发生的反应如下:
)常用于化学镀银,发生的反应如下:_______
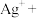 _______
_______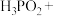 _____
_____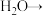 ______
______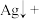 _______
_______ ______
______
①
 中,P元素的化合价为
中,P元素的化合价为 被
被②配平该离子方程式:
③
 与过量NaOH溶液反应的方程式为
与过量NaOH溶液反应的方程式为 ,则
,则 是
是
您最近一年使用:0次
2023-11-11更新
|
211次组卷
|
3卷引用:重庆市缙云联盟2023-2024学年高一上学期12月月考化学试题
7 . 化学与生产、生活密切相关,下列说法错误的是
| A.小苏打既是制作糕点的膨松剂,又是治疗胃酸过多的一种药剂 |
B.二氧化氯( )臭氧( )臭氧( )具有强氧化性,可以用于自来水消毒 )具有强氧化性,可以用于自来水消毒 |
| C.当火灾现场存放有大量活泼金属时,可以用水来灭火 |
D.维生素C具有还原性,能帮助人体将食物中摄取的 转化为 转化为 而吸收 而吸收 |
您最近一年使用:0次
2023-11-10更新
|
166次组卷
|
2卷引用:重庆市三峡名校联盟2023-2024学年高一上学期秋季联考 化学试题
名校
解题方法
8 . 现有下列10种物质:①铁② ③
③ 溶液④浓盐酸⑤氨气⑥
溶液④浓盐酸⑤氨气⑥ 固体⑦熔融的
固体⑦熔融的 ⑧
⑧ 固体⑨高锰酸钾粉末⑩氢氧化铁胶体。回答下列问题:
固体⑨高锰酸钾粉末⑩氢氧化铁胶体。回答下列问题:
(1)上述物质中能导电的有___________ (填序号,下同);属于电解质的有___________ 。
(2) 不但是日常生活中的调味品,也是一种重要的工业原料;工业上常采用电解饱和食盐水的方法生产
不但是日常生活中的调味品,也是一种重要的工业原料;工业上常采用电解饱和食盐水的方法生产 ,同时得到两种副产品
,同时得到两种副产品 和
和 ,写出电解饱和食盐水的离子方程式:
,写出电解饱和食盐水的离子方程式:___________ 。
(3) 在熔融时的电离方程式为:
在熔融时的电离方程式为:___________ 。将 溶液逐滴加入
溶液逐滴加入 溶液中至溶液呈中性,反应的离子方程式为
溶液中至溶液呈中性,反应的离子方程式为___________ 。
(4) 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:
和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为: ,
,
①请用“双线桥”表示上述反应电子转移的方向和数目___________ 。
②浓盐酸在反应中显示出来的性质是___________ 。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(5) 是三元弱酸,磷还有一种含氧酸叫亚磷酸
是三元弱酸,磷还有一种含氧酸叫亚磷酸 ,它是一种二元弱酸,则
,它是一种二元弱酸,则 为
为________ (填“正盐”或“酸式盐”),写出 与足量
与足量 溶液反应的化学方程式
溶液反应的化学方程式________ 。
 ③
③ 溶液④浓盐酸⑤氨气⑥
溶液④浓盐酸⑤氨气⑥ 固体⑦熔融的
固体⑦熔融的 ⑧
⑧ 固体⑨高锰酸钾粉末⑩氢氧化铁胶体。回答下列问题:
固体⑨高锰酸钾粉末⑩氢氧化铁胶体。回答下列问题:(1)上述物质中能导电的有
(2)
 不但是日常生活中的调味品,也是一种重要的工业原料;工业上常采用电解饱和食盐水的方法生产
不但是日常生活中的调味品,也是一种重要的工业原料;工业上常采用电解饱和食盐水的方法生产 ,同时得到两种副产品
,同时得到两种副产品 和
和 ,写出电解饱和食盐水的离子方程式:
,写出电解饱和食盐水的离子方程式:(3)
 在熔融时的电离方程式为:
在熔融时的电离方程式为: 溶液逐滴加入
溶液逐滴加入 溶液中至溶液呈中性,反应的离子方程式为
溶液中至溶液呈中性,反应的离子方程式为(4)
 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:
和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为: ,
,①请用“双线桥”表示上述反应电子转移的方向和数目
②浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(5)
 是三元弱酸,磷还有一种含氧酸叫亚磷酸
是三元弱酸,磷还有一种含氧酸叫亚磷酸 ,它是一种二元弱酸,则
,它是一种二元弱酸,则 为
为 与足量
与足量 溶液反应的化学方程式
溶液反应的化学方程式
您最近一年使用:0次
名校
9 . 二氧化铈( ,相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈
,相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈 一种工艺流程如图所示:
一种工艺流程如图所示:

(1)稀土化合物 中
中 的化合价为
的化合价为___________ 。
(2)在反应①中 体现
体现___________ (填“氧化性”或“还原性”),写出稀硫酸、 与
与 反应的化学方程式
反应的化学方程式___________ 。
(3)由反应②可知氧化性:
___________  (填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为
(填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为___________ ,当消耗 转移电子的物质的量为
转移电子的物质的量为___________ mol。
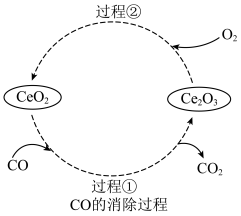
(4) 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式___________ 。
(5)取上述流程中得到的精 产品
产品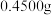 ,加硫酸溶解,经
,加硫酸溶解,经 标准溶液测定以后,产品中含
标准溶液测定以后,产品中含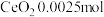 。该产品中
。该产品中 的质量分数为
的质量分数为___________ (保留一位小数)。
 ,相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈
,相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈 一种工艺流程如图所示:
一种工艺流程如图所示:
(1)稀土化合物
 中
中 的化合价为
的化合价为(2)在反应①中
 体现
体现 与
与 反应的化学方程式
反应的化学方程式(3)由反应②可知氧化性:

 (填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为
(填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为 转移电子的物质的量为
转移电子的物质的量为(4)
 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
(5)取上述流程中得到的精
 产品
产品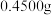 ,加硫酸溶解,经
,加硫酸溶解,经 标准溶液测定以后,产品中含
标准溶液测定以后,产品中含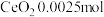 。该产品中
。该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2023-11-08更新
|
168次组卷
|
4卷引用:重庆市名校联盟2023-2024学年高一上学期11月期中联合考试化学试题
名校
解题方法
10 . 将一定量的铁粉与稀 混合恰好完全反应后,产物有
混合恰好完全反应后,产物有 、
、 、
、 气体、
气体、 ,其中当
,其中当 、
、 的物质的量之比为
的物质的量之比为 时。下列判断正确的是
时。下列判断正确的是
 混合恰好完全反应后,产物有
混合恰好完全反应后,产物有 、
、 、
、 气体、
气体、 ,其中当
,其中当 、
、 的物质的量之比为
的物质的量之比为 时。下列判断正确的是
时。下列判断正确的是A.反应产生的 的质量为 的质量为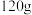 |
B.反应后溶液中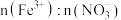 为 为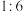 |
C.若反应中转移的电子为 ,则会产生 ,则会产生 为 为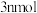 |
D.若 为 为 时,该反应也可发生 时,该反应也可发生 |
您最近一年使用:0次
2023-11-08更新
|
284次组卷
|
4卷引用:重庆市名校联盟2023-2024学年高一上学期11月期中联合考试化学试题



