名校
1 . 某无色透明的溶液中可能大量含有以下离子中的几种: 、
、 、
、 、
、 、
、 、
、 、
、 、
、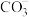 、
、 、
、 ,且每种离子的数目相等。为确定其组成,分别取原溶液进行了如下四组实验:
,且每种离子的数目相等。为确定其组成,分别取原溶液进行了如下四组实验:
①取少量溶液于试管中,滴入石蕊试液,溶液变红;
②取少量溶液做焰色试验,透过蓝色钴玻璃片观察,焰色为紫色;
③取少量溶液于试管中,滴入硝酸钡溶液,产生白色沉淀;
④取少量溶液于试管中,滴入过量氢氧化钠溶液,产生白色沉淀;
(1)由步骤①可以判断溶液中存在的离子为___________ (填离子符号,下同),由步骤②可以判断溶液中存在的离子为___________ 。
(2)写出步骤③发生反应的离子方程式___________ ;写出步骤④产生白色沉淀的离子方程式___________ ;
(3)综合以上实验分析,该溶液中一定存在的阴离子是___________ (填离子符号)。
(4)取一定量的原溶液,逐滴滴入 溶液,恰好使溶液中的沉淀量达到最大值,此时溶液呈
溶液,恰好使溶液中的沉淀量达到最大值,此时溶液呈___________ 性(填“酸”、“中”、“碱”),此时溶液中还大量存在的阳离子为___________ (填离子符号)。
(5)取一定量的原溶液,加入铜片,观察到铜片溶解,同时产生气泡(经测定该气体为NO),溶液最终变为蓝色。写出该反应的离子方程式___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、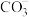 、
、 、
、 ,且每种离子的数目相等。为确定其组成,分别取原溶液进行了如下四组实验:
,且每种离子的数目相等。为确定其组成,分别取原溶液进行了如下四组实验:①取少量溶液于试管中,滴入石蕊试液,溶液变红;
②取少量溶液做焰色试验,透过蓝色钴玻璃片观察,焰色为紫色;
③取少量溶液于试管中,滴入硝酸钡溶液,产生白色沉淀;
④取少量溶液于试管中,滴入过量氢氧化钠溶液,产生白色沉淀;
(1)由步骤①可以判断溶液中存在的离子为
(2)写出步骤③发生反应的离子方程式
(3)综合以上实验分析,该溶液中一定存在的阴离子是
(4)取一定量的原溶液,逐滴滴入
 溶液,恰好使溶液中的沉淀量达到最大值,此时溶液呈
溶液,恰好使溶液中的沉淀量达到最大值,此时溶液呈(5)取一定量的原溶液,加入铜片,观察到铜片溶解,同时产生气泡(经测定该气体为NO),溶液最终变为蓝色。写出该反应的离子方程式
您最近一年使用:0次
名校
2 . 钠及其化合物在日常生活和化工生产中应用广泛。
(1)实验室中少量的钠通常保存在___________ 中。钠在实验室中常用作强除水剂,将钠块加入正己烷中可除去其中微量的水,该反应的化学方程式为___________ 。
(2)“神舟号”载人航天器的返回舱内,为防止CO2浓度过大引起宇航员困乏,用过氧化钠降低CO2的浓度,有关反应的化学方程式是___________ 。
(3)工业通过电解 产生金属钠:
产生金属钠: ,过程如下:
,过程如下:
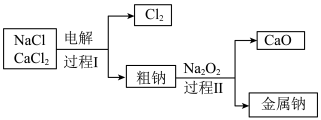
已知:电解时需要将 加热至熔融状态。
加热至熔融状态。 熔点为801℃,为降低能耗,通常加入
熔点为801℃,为降低能耗,通常加入 ,从而把熔点降至约580℃。
,从而把熔点降至约580℃。
①把 固体加热至熔融状态,目的是
固体加热至熔融状态,目的是___________ (用电离方程式表示)。
②过程I, 能发生像
能发生像 那样的电解反应而被消耗。但在过程I中
那样的电解反应而被消耗。但在过程I中 却不断地被重新生成,原因是
却不断地被重新生成,原因是___________ 。
(4)以碳酸氢铵和氯化钠为原料制备碳酸钠,其步骤如下:

①生成晶体A的化学方程式为___________ 。
②“300℃加热”时,用到的实验仪器除酒精灯、玻璃棒、泥三角、坩埚钳、三角架外,还必须使用的仪器有___________ (填名称)。
(1)实验室中少量的钠通常保存在
(2)“神舟号”载人航天器的返回舱内,为防止CO2浓度过大引起宇航员困乏,用过氧化钠降低CO2的浓度,有关反应的化学方程式是
(3)工业通过电解
 产生金属钠:
产生金属钠: ,过程如下:
,过程如下:
已知:电解时需要将
 加热至熔融状态。
加热至熔融状态。 熔点为801℃,为降低能耗,通常加入
熔点为801℃,为降低能耗,通常加入 ,从而把熔点降至约580℃。
,从而把熔点降至约580℃。①把
 固体加热至熔融状态,目的是
固体加热至熔融状态,目的是②过程I,
 能发生像
能发生像 那样的电解反应而被消耗。但在过程I中
那样的电解反应而被消耗。但在过程I中 却不断地被重新生成,原因是
却不断地被重新生成,原因是(4)以碳酸氢铵和氯化钠为原料制备碳酸钠,其步骤如下:

①生成晶体A的化学方程式为
②“300℃加热”时,用到的实验仪器除酒精灯、玻璃棒、泥三角、坩埚钳、三角架外,还必须使用的仪器有
您最近一年使用:0次
名校
3 . ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。回答下列问题:
I.ClO2的制备,生产流程如下图所示:
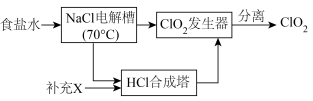
(1)用于电解的食盐水需先除去其中的 等杂质。向粗盐水中依次中加入过量的
等杂质。向粗盐水中依次中加入过量的___________ (填化学式)溶液、过量的 溶液和过量的
溶液和过量的___________ (填化学式)溶液,过滤后向滤液中加入盐酸至溶液呈中性。
(2)将经过净化后的食盐水加入电解槽中,70℃左右电解得到 和一种气体,则
和一种气体,则 合成塔中还需要补充的物质X为
合成塔中还需要补充的物质X为___________ (填化学式)。
(3)ClO2发生器中发生的反应为: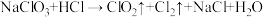 (反应未配平)。
(反应未配平)。
① 在该反应中表现的性质是
在该反应中表现的性质是___________ 。
②配平该反应的化学方程式,并用单线桥法标出电子转移的数目 ___________ 。
II.探究ClO2的某些性质,装置如下图所示:
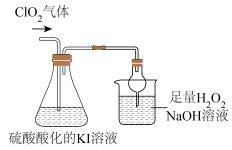
已知:①ClO2是极易溶于水的气体:②I2遇淀粉溶液变为蓝色
(4)反应结束后,往锥形瓶内滴加淀粉溶液,溶液变为蓝色,写出ClO2通入锥形瓶中反应的离子方程式___________ 。
(5)上图装置中,球形干燥管的作用是___________ 。烧杯内液体用于吸收未反应的CO2,若反应的氧化产物是 ,且氧化剂与还原剂的个数之比是
,且氧化剂与还原剂的个数之比是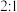 ,则还原产物是
,则还原产物是___________ (填化学式)。
I.ClO2的制备,生产流程如下图所示:

(1)用于电解的食盐水需先除去其中的
 等杂质。向粗盐水中依次中加入过量的
等杂质。向粗盐水中依次中加入过量的 溶液和过量的
溶液和过量的(2)将经过净化后的食盐水加入电解槽中,70℃左右电解得到
 和一种气体,则
和一种气体,则 合成塔中还需要补充的物质X为
合成塔中还需要补充的物质X为(3)ClO2发生器中发生的反应为:
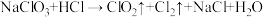 (反应未配平)。
(反应未配平)。①
 在该反应中表现的性质是
在该反应中表现的性质是②配平该反应的化学方程式,
II.探究ClO2的某些性质,装置如下图所示:

已知:①ClO2是极易溶于水的气体:②I2遇淀粉溶液变为蓝色
(4)反应结束后,往锥形瓶内滴加淀粉溶液,溶液变为蓝色,写出ClO2通入锥形瓶中反应的离子方程式
(5)上图装置中,球形干燥管的作用是
 ,且氧化剂与还原剂的个数之比是
,且氧化剂与还原剂的个数之比是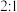 ,则还原产物是
,则还原产物是
您最近一年使用:0次
名校
4 . 高纯度硝酸高铈铵主要用作有机合成的催化剂和氧化剂、集成电路的腐蚀剂等。它的化学式为(NH4)2Ce(NO3)6,易溶于水,几乎不溶于浓硝酸。实验室用CeCl3溶液制备硝酸高铈铵的主要步骤如下:
Ⅰ.CeCl3与NH4HCO3反应制备Ce2(CO3)3。
制备Ce2(CO3)3的装置如图所示:

将装置A和D中所产生的气体通入B装置一段时间,再将CeCl3溶液滴入下方反应后的溶液中,从而制备Ce2(CO3)3固体。
已知:Ce3+易被空气氧化成Ce4+。
回答下列问题:
(1)装置D中盛放稀盐酸的实验仪器名称为___________ ,装置C的作用是___________ 。
(2)若装置A和装置D中所产生的气体体积比超过1:1,则B中会产生一种含铈的沉淀杂质,其化学式为___________ 。
(3)装置B中制备Ce2(CO3)3反应的离子方程式为___________ 。
(4)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品Ce2(CO3)3.检验是否洗涤干净的方法为___________ 。
Ⅱ.制备硝酸高铈铵。
取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黄色难溶物)。将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体从而生成硝酸高铈铵沉淀,经过悲、洗涤、(自然烘无后得到产异。
(5)①写出生成Ce(OH)4的离子方程式___________ 。
②“氧化沉淀”时,加热的温度不宜过高,原因是___________ 。
Ⅰ.CeCl3与NH4HCO3反应制备Ce2(CO3)3。
制备Ce2(CO3)3的装置如图所示:

将装置A和D中所产生的气体通入B装置一段时间,再将CeCl3溶液滴入下方反应后的溶液中,从而制备Ce2(CO3)3固体。
已知:Ce3+易被空气氧化成Ce4+。
回答下列问题:
(1)装置D中盛放稀盐酸的实验仪器名称为
(2)若装置A和装置D中所产生的气体体积比超过1:1,则B中会产生一种含铈的沉淀杂质,其化学式为
(3)装置B中制备Ce2(CO3)3反应的离子方程式为
(4)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品Ce2(CO3)3.检验是否洗涤干净的方法为
Ⅱ.制备硝酸高铈铵。
取适量碳酸铈[Ce2(CO3)3]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入双氧水、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到Ce(OH)4(黄色难溶物)。将Ce(OH)4于一定温度下加入硝酸加热至浆状,生成H2[Ce(NO3)6],再加入稍过量的NH4NO3晶体从而生成硝酸高铈铵沉淀,经过悲、洗涤、(自然烘无后得到产异。
(5)①写出生成Ce(OH)4的离子方程式
②“氧化沉淀”时,加热的温度不宜过高,原因是
您最近一年使用:0次
2024-01-03更新
|
344次组卷
|
4卷引用:重庆市巴蜀中学校2023-2024学年高三上学期11月期中化学试题
名校
解题方法
5 . 锡基轴承合金的主要成分是锡(Sn)、铅(Pb)、锑(Sb)、铜(Cu),某工厂采用如下工艺实现成分金属的回收。

已知:“浸出液”中主要溶质为Na2SnO3、Na3SbO4、Na2PbO2均为强电解质。
回答下列问题:
(1)Sn与C同主族,则基态Sn原子的价层电子排布式为___________ 。
(2)“浸出渣”的主要成分为___________ 。
(3)“沉铅”时,该反应只有Na2PbO2与H2S等物质的量发生反应,___________ (填“是”或“不是”) 氧化还原反应; “沉铅”后溶液的 pH 值___________ (填“增大”“减小” 或 “不变” )。
(4)“沉锑”时发生反应的离子方程式为___________ ;(沉锑后主要溶质为Na2SnO3、NaOH)。
(5)“还原”时发生的反应类似于工业制粗硅,写出还原过程发生反应的化学方程式:___________ 。
(6)制得的粗锡中含有少量金属Pb、Sb,常采用电解法精炼。其中SnSO4溶液作为电解液,精锡连接电源的___________ 极。阳极泥中含有 Sb、PbSO4,则阳极的电极反应式为___________ 。

已知:“浸出液”中主要溶质为Na2SnO3、Na3SbO4、Na2PbO2均为强电解质。
回答下列问题:
(1)Sn与C同主族,则基态Sn原子的价层电子排布式为
(2)“浸出渣”的主要成分为
(3)“沉铅”时,该反应只有Na2PbO2与H2S等物质的量发生反应,
(4)“沉锑”时发生反应的离子方程式为
(5)“还原”时发生的反应类似于工业制粗硅,写出还原过程发生反应的化学方程式:
(6)制得的粗锡中含有少量金属Pb、Sb,常采用电解法精炼。其中SnSO4溶液作为电解液,精锡连接电源的
您最近一年使用:0次
名校
6 . 根据实验目的、操作及现象,得出的结论都正确的是
| 选项 | 实验目的 | 操作及现象 | 结论 |
| A | 比较酸性 | 向 溶液中通入 溶液中通入 气体,产生黑色沉淀 气体,产生黑色沉淀 | 酸性: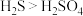 |
| B | 探究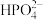 在水中的变化 在水中的变化 | 向 溶液中滴加 溶液中滴加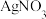 溶液产生淡黄色沉淀 溶液产生淡黄色沉淀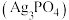 | 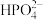 在水中发生了电离 在水中发生了电离 |
| C | 比较离子的氧化性 | 向含有KSCN的 溶液中滴加酸化的 溶液中滴加酸化的 溶液,溶液变红 溶液,溶液变红 | 氧化性: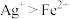 |
| D | 探究浓硫酸的性质 | 将浓硫酸、氯化钠固体、 混合加热,产生黄绿色气体 混合加热,产生黄绿色气体 | 浓硫酸具有强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-30更新
|
219次组卷
|
2卷引用:重庆市荣昌中学校2023-2024学年高三上学期12月月考化学试题
7 . 一种以铬铁矿【主要含有Fe(CrO2)2,同时含有Al2O3、SiO2】为主要原料制备K2Cr2O7的工艺流程如图所示:

(1)基态铬原子的单电子数为________ ,铬铁矿中元素第一电离能Al________ Si(填“大于”、“小于”或“等于”)。
(2)焙烧时Fe(CrO2)2转化为Na2CrO4,同时杂质A12O3、SiO2转化为可溶性钠盐,焙烧时Fe(CrO2)2发生反应的的化学方程式为________ 。
(3)滤渣a中除A1(OH)3外还有________ 。(填化学式)
(4)已知,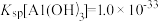 ,酸化时发生
,酸化时发生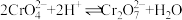 ,
,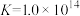 ,测得滤液2中pH=5,含铬微粒只有
,测得滤液2中pH=5,含铬微粒只有 和
和 ,其中c(
,其中c( )=1.0mol/L,则滤液2中c(Al3+)=
)=1.0mol/L,则滤液2中c(Al3+)=________ mol/L, 的转化率为
的转化率为_______ 。(结果保留3位有效数字)
(5)已知相同温度下Na2Cr2O7的溶解度显著高于K2Cr2O7,可利用两者溶解度的不同实现转化,操作X的具体过程为:加热浓缩、_______ 、冷却结晶、过滤、洗涤干燥,得到较纯净的K2Cr2O7晶体。
(6)将15kg铬铁矿按上述流程制得K2Cr2O7产品,假设各步损失铬元素总计9.0%,干燥称量得14kg该产品,滴定分析产品中K2Cr2O7的纯度为99.2%,则铬铁矿中铬元素的质量分数为_______ 。

(1)基态铬原子的单电子数为
(2)焙烧时Fe(CrO2)2转化为Na2CrO4,同时杂质A12O3、SiO2转化为可溶性钠盐,焙烧时Fe(CrO2)2发生反应的的化学方程式为
(3)滤渣a中除A1(OH)3外还有
(4)已知,
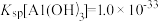 ,酸化时发生
,酸化时发生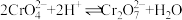 ,
,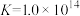 ,测得滤液2中pH=5,含铬微粒只有
,测得滤液2中pH=5,含铬微粒只有 和
和 ,其中c(
,其中c( )=1.0mol/L,则滤液2中c(Al3+)=
)=1.0mol/L,则滤液2中c(Al3+)= 的转化率为
的转化率为(5)已知相同温度下Na2Cr2O7的溶解度显著高于K2Cr2O7,可利用两者溶解度的不同实现转化,操作X的具体过程为:加热浓缩、
(6)将15kg铬铁矿按上述流程制得K2Cr2O7产品,假设各步损失铬元素总计9.0%,干燥称量得14kg该产品,滴定分析产品中K2Cr2O7的纯度为99.2%,则铬铁矿中铬元素的质量分数为
您最近一年使用:0次
名校
8 . 已知反应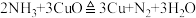 ,若NA为阿伏加德罗常数的值,当固体质量减少0.96g时,下列叙述一定正确的是
,若NA为阿伏加德罗常数的值,当固体质量减少0.96g时,下列叙述一定正确的是
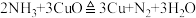 ,若NA为阿伏加德罗常数的值,当固体质量减少0.96g时,下列叙述一定正确的是
,若NA为阿伏加德罗常数的值,当固体质量减少0.96g时,下列叙述一定正确的是| A.转移电子数为0.36NA |
| B.反应后的固体质量为384g |
| C.生成N2的分子数为0.04NA |
| D.消耗的NH3与生成的H2O含有的共用电子对数均为0.12NA |
您最近一年使用:0次
9 . 某厂利用废旧铅蓄电池中的铅膏(主要成分为 、
、 、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:

已知: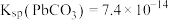 ,
,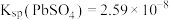 ,
,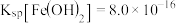 ,
,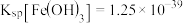 ,
,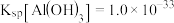 。
。
(1)PbO中O元素的价电子的轨道表示式为_______________________ 。
(2)“脱硫”过程中涉及含Pb沉淀转化的离子方程式为___________ ,反应的平衡常数K的数值为_____________ 。
(3)“酸浸”时, 能使
能使 转化为
转化为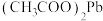 ,写出该反应的化学方程式
,写出该反应的化学方程式_________________ 此外, 还能氧化溶液中的
还能氧化溶液中的_____________ (填化学式或离子符号)。
(4)PbO的溶解度曲线如图甲所示,结合图像分析,为得到高纯PbO固体,需将粗品PbO溶解在__________ (填“10%”或“35%”)浓度的NaOH溶液中,加热至110℃,充分溶解后趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯产品。

(5)常温下,溶液中部分含铅物质的质量分数 与溶液pH变化的关系如图乙所示:
与溶液pH变化的关系如图乙所示:

①若溶液pH由10增大到了11,发生反应的离子方程式为_______________________ 。
②“除杂”时,为了使 、
、 沉淀完全(离子浓度低于
沉淀完全(离子浓度低于 ),结合图乙与已知的信息,需调节溶液pH的理论范围为
),结合图乙与已知的信息,需调节溶液pH的理论范围为____________ 。
 、
、 、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
、PbO和Pb,还有少量铁、铝的氧化物)回收PbO,工艺流程如下:
已知:
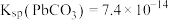 ,
,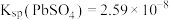 ,
,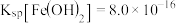 ,
,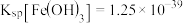 ,
,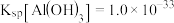 。
。(1)PbO中O元素的价电子的轨道表示式为
(2)“脱硫”过程中涉及含Pb沉淀转化的离子方程式为
(3)“酸浸”时,
 能使
能使 转化为
转化为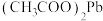 ,写出该反应的化学方程式
,写出该反应的化学方程式 还能氧化溶液中的
还能氧化溶液中的(4)PbO的溶解度曲线如图甲所示,结合图像分析,为得到高纯PbO固体,需将粗品PbO溶解在

(5)常温下,溶液中部分含铅物质的质量分数
 与溶液pH变化的关系如图乙所示:
与溶液pH变化的关系如图乙所示:
①若溶液pH由10增大到了11,发生反应的离子方程式为
②“除杂”时,为了使
 、
、 沉淀完全(离子浓度低于
沉淀完全(离子浓度低于 ),结合图乙与已知的信息,需调节溶液pH的理论范围为
),结合图乙与已知的信息,需调节溶液pH的理论范围为
您最近一年使用:0次
2023-12-12更新
|
306次组卷
|
2卷引用:重庆市育才中学校、西南大学附中、万州中学2023-2024学年高二上学期12月联考化学试题
名校
解题方法
10 . 将CO或 转化为高附加值化学品是颇具前景的合成路线。
转化为高附加值化学品是颇具前景的合成路线。
(1)相比于煤和石油,天然气作为燃料的主要优点有_______ 。
(2)煤的气化可将煤转化为可燃性气体,写出生成水煤气的化学方程式_______ 。
(3)钴系催化剂催化下CO加氢反应的一种路径如下图所示(*表示微粒吸附在催化剂表面的形态): 和
和 反应生成
反应生成 反应的重要中间体有
反应的重要中间体有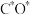 、
、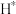 、
、_______ 、 和
和_______ 。
(4) 与二甲醚可发生反应:
与二甲醚可发生反应:
 。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
_______ 0(填“大于”“小于”或“等于”)0,a、b、c的大小关系为_______ 。
②TK下,向恒压密闭容器中充入CO和 ,反应前
,反应前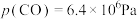 ,
,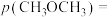
 ;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
_______ 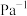 。
。
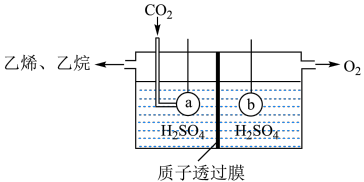
(5)以 为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:
为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:_______ ,当左侧有8.96L(标准状况) 反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差
反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差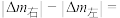
_______ g。
 转化为高附加值化学品是颇具前景的合成路线。
转化为高附加值化学品是颇具前景的合成路线。(1)相比于煤和石油,天然气作为燃料的主要优点有
(2)煤的气化可将煤转化为可燃性气体,写出生成水煤气的化学方程式
(3)钴系催化剂催化下CO加氢反应的一种路径如下图所示(*表示微粒吸附在催化剂表面的形态):
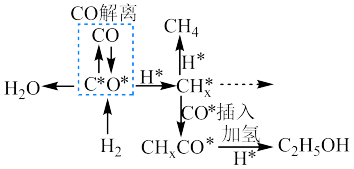
 和
和 反应生成
反应生成 反应的重要中间体有
反应的重要中间体有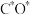 、
、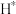 、
、 和
和(4)
 与二甲醚可发生反应:
与二甲醚可发生反应:
 。反应中二甲醚的平衡转化率与温度和压强的关系见下图:
。反应中二甲醚的平衡转化率与温度和压强的关系见下图:

②TK下,向恒压密闭容器中充入CO和
 ,反应前
,反应前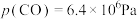 ,
,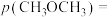
 ;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
;充分反应达到平衡后CO的转化率为25%,则TK下该反应的平衡常数
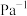 。
。(5)以
 为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为:
为原料,电解法制取乙烯、乙烷的装置如图,生成乙烷的电极反应式为: 反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差
反应时,a极区产品中乙烯的体积分数为50%,此时左右两侧溶液质量变化差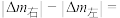
您最近一年使用:0次



