1 . 回答下列问题:
(1)已知H2A在水中发生电离:H2A=H++HA-,HA-⇌H++A2-。
①向H2A稀溶液中加入少量NaHA固体,溶液的pH_______ (填“增大”“减小”或“不变”)。
②常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)。加入少量Na2A固体,c(Ca2+)_______ (填“增大”“减小”或“不变”),原因是_______ 。
(2)含有Cr2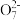 的废水毒性较大。经化学分析,某工厂废水中Cr2
的废水毒性较大。经化学分析,某工厂废水中Cr2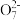 的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2
的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2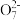
 Cr3+、Fe3+
Cr3+、Fe3+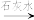 Cr(OH)3、Fe(OH)3。
Cr(OH)3、Fe(OH)3。
①在废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为_______ 。
②已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=7.0×10-31。若处理后的废水中残留的c(Fe3+)=2.0×10-14mol·L-1,则残留的Cr3+的浓度为_______ 。
(1)已知H2A在水中发生电离:H2A=H++HA-,HA-⇌H++A2-。
①向H2A稀溶液中加入少量NaHA固体,溶液的pH
②常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)。加入少量Na2A固体,c(Ca2+)
(2)含有Cr2
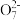 的废水毒性较大。经化学分析,某工厂废水中Cr2
的废水毒性较大。经化学分析,某工厂废水中Cr2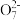 的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2
的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2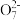
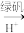 Cr3+、Fe3+
Cr3+、Fe3+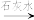 Cr(OH)3、Fe(OH)3。
Cr(OH)3、Fe(OH)3。①在废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为
②已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=7.0×10-31。若处理后的废水中残留的c(Fe3+)=2.0×10-14mol·L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
名校
解题方法
2 . 工业废水中常含有一定量的 ,会危害生态系统,必须进行处理。常将
,会危害生态系统,必须进行处理。常将 转化为纺织印染中的媒染剂
转化为纺织印染中的媒染剂 ,变废为宝。该法用酸性含铬废液(含
,变废为宝。该法用酸性含铬废液(含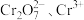 及少量
及少量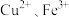 等)制备
等)制备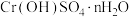 晶体,工艺流程如下:
晶体,工艺流程如下:
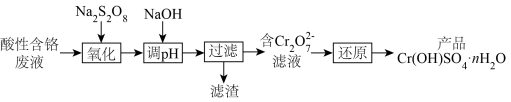
常温下, 金属离子形成氢氧化物沉淀的
金属离子形成氢氧化物沉淀的 范围如表。已知:
范围如表。已知:
回答下列问题
(1)“氧化”时,
①将 先氧化为
先氧化为 的目的是
的目的是_______ 。
②加入的 (
( 为+6价)中,
为+6价)中,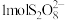 含有过氧键数目为
含有过氧键数目为_______ 。
③完成下列离子方程式:_______ 。

(2)“调 ”时,加入
”时,加入 至溶液呈碱性,但
至溶液呈碱性,但 不能大于9的原因是
不能大于9的原因是_______ ;
(3)“过滤”时,滤渣的主要成分是_______ 。(填化学式)
(4)“还原”时,还原剂将 还原为
还原为 ,最适合的还原剂是_______。
,最适合的还原剂是_______。
(5)从 溶液得到
溶液得到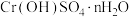 晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
 ,会危害生态系统,必须进行处理。常将
,会危害生态系统,必须进行处理。常将 转化为纺织印染中的媒染剂
转化为纺织印染中的媒染剂 ,变废为宝。该法用酸性含铬废液(含
,变废为宝。该法用酸性含铬废液(含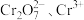 及少量
及少量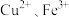 等)制备
等)制备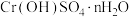 晶体,工艺流程如下:
晶体,工艺流程如下:
常温下,
 金属离子形成氢氧化物沉淀的
金属离子形成氢氧化物沉淀的 范围如表。已知:
范围如表。已知:
| 离子 | 开始沉淀的 | 完全沉淀的 |
 | 1.4 | 3.0 |
 | 4.2 | 6.7 |
 | 4.0 | 6.8 |
(1)“氧化”时,
①将
 先氧化为
先氧化为 的目的是
的目的是②加入的
 (
( 为+6价)中,
为+6价)中,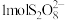 含有过氧键数目为
含有过氧键数目为③完成下列离子方程式:

(2)“调
 ”时,加入
”时,加入 至溶液呈碱性,但
至溶液呈碱性,但 不能大于9的原因是
不能大于9的原因是(3)“过滤”时,滤渣的主要成分是
(4)“还原”时,还原剂将
 还原为
还原为 ,最适合的还原剂是_______。
,最适合的还原剂是_______。A. | B. | C. | D. |
(5)从
 溶液得到
溶液得到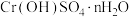 晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
您最近一年使用:0次
解题方法
3 . 尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):
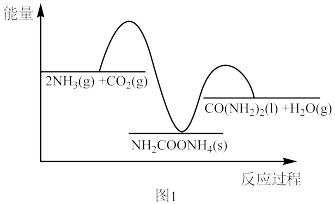
已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施___________ 。
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是___________ 。
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是___________ 。
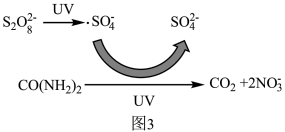
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为___________ 。
(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,
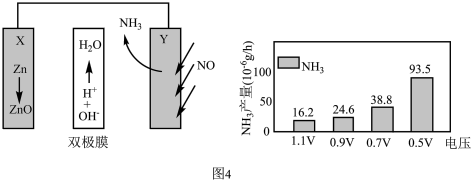
已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率= ×100%
×100%
①写出正极的电极反应式___________ 。
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为___________ 。(保留两位小数)
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):

已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为

(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,

已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率=
 ×100%
×100%①写出正极的电极反应式
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为
您最近一年使用:0次
解题方法
4 . KIO3是常见的食盐加碘剂,某小组制备KIO3晶体的流程如下,请回答下列问题:

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g∙cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为___________ 。
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是___________ (填字母)。
a. b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是___________ 。
(4)步骤⑧后,往滤液中加入一定量___________ ,再次抽滤,可提高产品收率。
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250.00mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol·L−1的Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液28.80mL。已知:I2+2S2O =2I-+S4O
=2I-+S4O
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为___________ 。
②KIO3在酸性条件下氧化KI的离子方程式为___________ 。
③产品的质量分数为___________ (保留4位有效数字)。
④在确认滴定操作无误的情况下,质量分数异常的原因可能是___________ 。

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g∙cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是
a.
 b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是
(4)步骤⑧后,往滤液中加入一定量
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250.00mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol·L−1的Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液28.80mL。已知:I2+2S2O
 =2I-+S4O
=2I-+S4O
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②KIO3在酸性条件下氧化KI的离子方程式为
③产品的质量分数为
④在确认滴定操作无误的情况下,质量分数异常的原因可能是
您最近一年使用:0次
名校
5 . 碳酸锶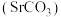 主要用于制造磁性材料、电子元件等。利用锶渣(主要成分
主要用于制造磁性材料、电子元件等。利用锶渣(主要成分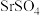 ,含少量
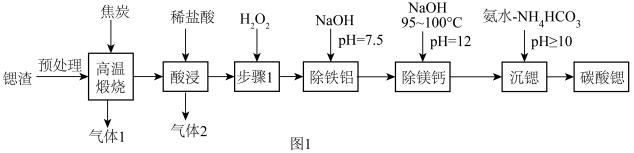
,含少量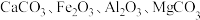 杂质),工业上制备超细碳酸锶的工艺如图1所示:
杂质),工业上制备超细碳酸锶的工艺如图1所示:
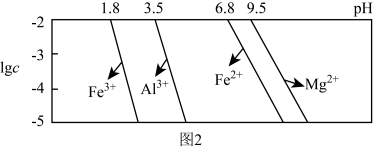
已知:①室温下,溶液中金属离子物质的量浓度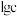 与溶液pH的关系如图2所示:
与溶液pH的关系如图2所示:
② 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:
回答下列问题:
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为____________ 。
(2)“步骤1”的目的是____________ 。
(3)“除铁铝”后溶液温度降至室温,溶液中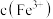 为
为______  。
。
(4)“除镁钙”过程温度控制在95~100℃的目的是_____________________________________________ 。
(5)“沉锶”的离子反应方程式为_________________________ 。
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为_____________________________________
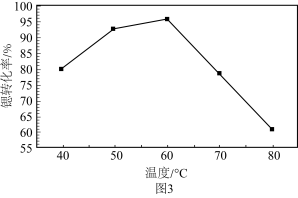
(7)如图为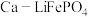 可充放电电池的工作原理示意图,锂离子导体膜只允许
可充放电电池的工作原理示意图,锂离子导体膜只允许 通过,充电时,钙电极为
通过,充电时,钙电极为______ (“阳极”或“阴极”),放电时,正极上发生 的嵌入的电极反应是
的嵌入的电极反应是______ 。
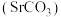 主要用于制造磁性材料、电子元件等。利用锶渣(主要成分
主要用于制造磁性材料、电子元件等。利用锶渣(主要成分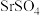 ,含少量
,含少量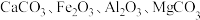 杂质),工业上制备超细碳酸锶的工艺如图1所示:
杂质),工业上制备超细碳酸锶的工艺如图1所示:
已知:①室温下,溶液中金属离子物质的量浓度
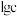 与溶液pH的关系如图2所示:
与溶液pH的关系如图2所示:
②
 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | 0.07 |
 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 | 91.20 |
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为
(2)“步骤1”的目的是
(3)“除铁铝”后溶液温度降至室温,溶液中
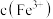 为
为 。
。(4)“除镁钙”过程温度控制在95~100℃的目的是
(5)“沉锶”的离子反应方程式为
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为

(7)如图为
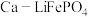 可充放电电池的工作原理示意图,锂离子导体膜只允许
可充放电电池的工作原理示意图,锂离子导体膜只允许 通过,充电时,钙电极为
通过,充电时,钙电极为 的嵌入的电极反应是
的嵌入的电极反应是
您最近一年使用:0次
名校
解题方法
6 . 一种从阳极泥(主要成分为Cu、Ag、Pt、Au、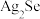 、
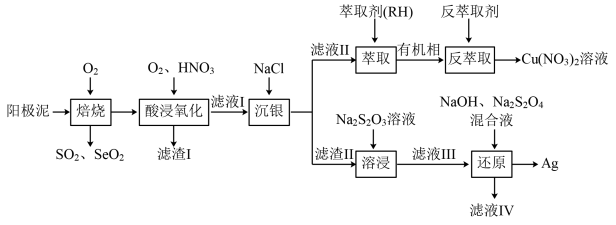
、 等)中回收Se和贵重金属的工艺流程如图所示:
等)中回收Se和贵重金属的工艺流程如图所示:
已知:①该工艺中萃取与反萃取的原理为: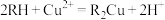 。
。
② 易与
易与 形成配离子:
形成配离子: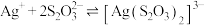 ,上述工艺条件下该反应的平衡常数为
,上述工艺条件下该反应的平衡常数为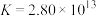 。
。
③上述工艺条件下,AgCl的溶度积常数: 。
。
(1)“焙烧”产生的; 与
与 的混合烟气可用水吸收制得单质Se,该反应的化学方程式为
的混合烟气可用水吸收制得单质Se,该反应的化学方程式为____________ 。
(2)“滤渣Ⅰ”的主要成分是______ (填化学式);“酸浸氧化”中通入氧气,体现了绿色化学的思想,其目的是____________ 。
(3)“反萃取剂”最好选用______ (填化学式)溶液。
(4)“溶浸”过程中滤渣Ⅱ被 溶液溶解,发生反应的平衡常数为
溶液溶解,发生反应的平衡常数为______ 。
(5)“还原”过程中; 没有参与氧化还原过程,“滤液Ⅳ”中还主要含有
没有参与氧化还原过程,“滤液Ⅳ”中还主要含有 。“还原”过程中氧化剂与还原剂的物质的量之比为
。“还原”过程中氧化剂与还原剂的物质的量之比为______ 。
(6)为减少工艺中试剂用量,“滤液Ⅳ”可返回______ (填工序名称)工序循环使用。
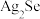 、
、 等)中回收Se和贵重金属的工艺流程如图所示:
等)中回收Se和贵重金属的工艺流程如图所示:
已知:①该工艺中萃取与反萃取的原理为:
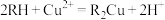 。
。②
 易与
易与 形成配离子:
形成配离子: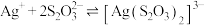 ,上述工艺条件下该反应的平衡常数为
,上述工艺条件下该反应的平衡常数为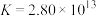 。
。③上述工艺条件下,AgCl的溶度积常数:
 。
。(1)“焙烧”产生的;
 与
与 的混合烟气可用水吸收制得单质Se,该反应的化学方程式为
的混合烟气可用水吸收制得单质Se,该反应的化学方程式为(2)“滤渣Ⅰ”的主要成分是
(3)“反萃取剂”最好选用
(4)“溶浸”过程中滤渣Ⅱ被
 溶液溶解,发生反应的平衡常数为
溶液溶解,发生反应的平衡常数为(5)“还原”过程中;
 没有参与氧化还原过程,“滤液Ⅳ”中还主要含有
没有参与氧化还原过程,“滤液Ⅳ”中还主要含有 。“还原”过程中氧化剂与还原剂的物质的量之比为
。“还原”过程中氧化剂与还原剂的物质的量之比为(6)为减少工艺中试剂用量,“滤液Ⅳ”可返回
您最近一年使用:0次
名校
7 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如下图所示。

已知:最高价铬酸根在酸性介质中以 存在,在碱性介质中以
存在,在碱性介质中以 存在。回答下列问题:
存在。回答下列问题:
(1)“煅烧”过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)“浸取”过程中加快溶解的方法为___________ (写出两种)。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。对应调pH应不低于___________ 。(已知:①常温下,当溶液中离子浓度小于1×10-5mol·L-1时认为沉淀完全;②Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-32)
(4)铬钒渣杂质中同时含有Fe3+和Fe2+,检验其中的Fe2+,反应的离子方程式为___________ 。
(5)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。
(6)全钒液流储能电池是利用不同价态离子发生氧化还原反应来实现化学能和电能相互转化的,其装置原理如图:

充电时若转移的电子数为6.02×1023个,左槽溶液中n(H+)的变化量为___________ 。

已知:最高价铬酸根在酸性介质中以
 存在,在碱性介质中以
存在,在碱性介质中以 存在。回答下列问题:
存在。回答下列问题:(1)“煅烧”过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)“浸取”过程中加快溶解的方法为
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(4)铬钒渣杂质中同时含有Fe3+和Fe2+,检验其中的Fe2+,反应的离子方程式为
(5)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
(6)全钒液流储能电池是利用不同价态离子发生氧化还原反应来实现化学能和电能相互转化的,其装置原理如图:

充电时若转移的电子数为6.02×1023个,左槽溶液中n(H+)的变化量为
您最近一年使用:0次
名校
解题方法
8 . 铈( )的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含
)的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含 、
、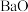 、
、 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图:
(1) 中氟元素对应的氟原子激发态的电子排布式有
中氟元素对应的氟原子激发态的电子排布式有_______ (填序号)。
a. b.
b.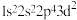 c.
c. d.
d.
(2)“氧化焙烧”后, 元素转化为
元素转化为 和
和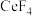 。写出“氧化焙烧”时
。写出“氧化焙烧”时 发生的化学反应方程式:
发生的化学反应方程式:_______ 。
(3)实验室进行操作①所需的玻璃仪器有烧杯、_______ 。
(4)“系列操作”包含下图几个过程: 不能溶于有机物
不能溶于有机物 ;
;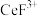 能溶于有机物
能溶于有机物 ,且存在反应
,且存在反应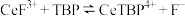 。“滤液
。“滤液 ”中加入有机物
”中加入有机物 后的分离方法是
后的分离方法是_______ ,“有机层B”中发生反应的离子方程式为_______ 。
(5)已知25℃时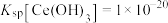 ,“调
,“调 ”时,要使
”时,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制
为沉淀完全),应控制 大于
大于_______ 。
(6) 立方晶胞结构如图所示。
立方晶胞结构如图所示。_______ 。
②阿伏加德罗常数的值为 ,
, 摩尔质量为
摩尔质量为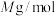 ,晶体密度为
,晶体密度为 ,其晶胞边长的计量表达式为
,其晶胞边长的计量表达式为
_______  。
。
 )的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含
)的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含 、
、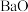 、
、 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图: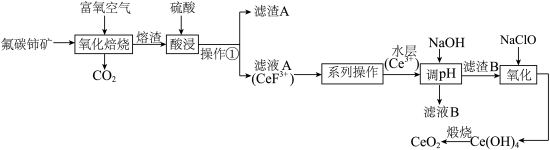
(1)
 中氟元素对应的氟原子激发态的电子排布式有
中氟元素对应的氟原子激发态的电子排布式有a.
 b.
b.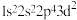 c.
c. d.
d.
(2)“氧化焙烧”后,
 元素转化为
元素转化为 和
和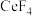 。写出“氧化焙烧”时
。写出“氧化焙烧”时 发生的化学反应方程式:
发生的化学反应方程式:(3)实验室进行操作①所需的玻璃仪器有烧杯、
(4)“系列操作”包含下图几个过程:

 不能溶于有机物
不能溶于有机物 ;
;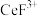 能溶于有机物
能溶于有机物 ,且存在反应
,且存在反应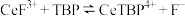 。“滤液
。“滤液 ”中加入有机物
”中加入有机物 后的分离方法是
后的分离方法是(5)已知25℃时
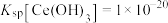 ,“调
,“调 ”时,要使
”时,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制
为沉淀完全),应控制 大于
大于(6)
 立方晶胞结构如图所示。
立方晶胞结构如图所示。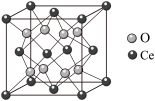
②阿伏加德罗常数的值为
 ,
, 摩尔质量为
摩尔质量为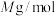 ,晶体密度为
,晶体密度为 ,其晶胞边长的计量表达式为
,其晶胞边长的计量表达式为
 。
。
您最近一年使用:0次
2024-02-25更新
|
436次组卷
|
4卷引用:四川省广安市华蓥中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
9 . 硒被誉为“生命元素”。亚硒酸钙(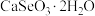 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
①含硒废料的主要成分是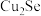 和
和 ;“焙烧”时固体产物为
;“焙烧”时固体产物为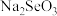 、
、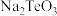 和
和 。
。
② 易溶于水,
易溶于水, 难溶于水。
难溶于水。
(1)“焙烧”时,含硒废料需要粉碎,目的是___________ 。
(2)利用“浸渣”可以制备胆矾,其操作步骤是加入足量稀硫酸溶解,再通入热空气。通入热空气的目的是___________ (用离子方程式表示)。
(3)上述参加反应的双氧水远小于实际消耗的双氧水(反应温度在50℃),其主要原因是___________ 。
(4)硒酸分解制备 的副产物有
的副产物有___________ (填化学式)。
(5)已知 、
、 的熔点分别为315℃、733℃,其熔点差异的主要原因是
的熔点分别为315℃、733℃,其熔点差异的主要原因是___________ 。
(6)测定 产品纯度。称取
产品纯度。称取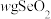 产品溶于水配制成250mL溶液,取25.00mL于锥形瓶中,加入足量
产品溶于水配制成250mL溶液,取25.00mL于锥形瓶中,加入足量 溶液和适量稀硝酸,充分反应后,滴加3滴
溶液和适量稀硝酸,充分反应后,滴加3滴 淀粉溶液,用
淀粉溶液,用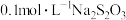 溶液滴定至终点时消耗VmL滴定液。发生有关反应:
溶液滴定至终点时消耗VmL滴定液。发生有关反应:
①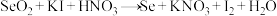 (未配平)
(未配平)
②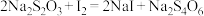
该 产品中硒元素的质量分数为
产品中硒元素的质量分数为___________ %。如果大量空气进入锥形瓶,可能导致测得的结果___________ (填“偏高”“偏低”或“无影响”)。
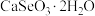 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题: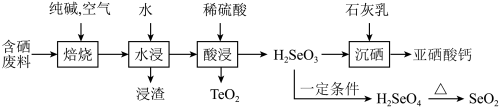
①含硒废料的主要成分是
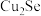 和
和 ;“焙烧”时固体产物为
;“焙烧”时固体产物为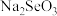 、
、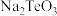 和
和 。
。②
 易溶于水,
易溶于水, 难溶于水。
难溶于水。(1)“焙烧”时,含硒废料需要粉碎,目的是
(2)利用“浸渣”可以制备胆矾,其操作步骤是加入足量稀硫酸溶解,再通入热空气。通入热空气的目的是
(3)上述参加反应的双氧水远小于实际消耗的双氧水(反应温度在50℃),其主要原因是
(4)硒酸分解制备
 的副产物有
的副产物有(5)已知
 、
、 的熔点分别为315℃、733℃,其熔点差异的主要原因是
的熔点分别为315℃、733℃,其熔点差异的主要原因是(6)测定
 产品纯度。称取
产品纯度。称取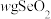 产品溶于水配制成250mL溶液,取25.00mL于锥形瓶中,加入足量
产品溶于水配制成250mL溶液,取25.00mL于锥形瓶中,加入足量 溶液和适量稀硝酸,充分反应后,滴加3滴
溶液和适量稀硝酸,充分反应后,滴加3滴 淀粉溶液,用
淀粉溶液,用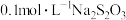 溶液滴定至终点时消耗VmL滴定液。发生有关反应:
溶液滴定至终点时消耗VmL滴定液。发生有关反应:①
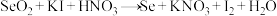 (未配平)
(未配平)②
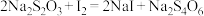
该
 产品中硒元素的质量分数为
产品中硒元素的质量分数为
您最近一年使用:0次
2024-02-25更新
|
585次组卷
|
5卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题(创新部)
江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题(创新部)2024届陕西省安康市高三下学期一模考试理科综合试题-高中化学(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)T27-工业流程题2024届陕西省西安博爱国际学校高三下学期第一次模拟考试理科综合试卷-高中化学
名校
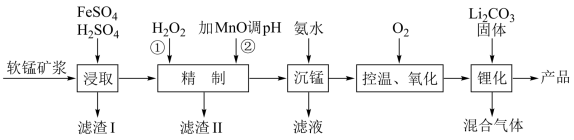
10 . 锰酸锂离子电池是第二代锂离子动力电池,性能优良。工业上以软锰矿浆(主要成分为 ,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂
,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂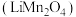 ,工业流程如下图所示:
,工业流程如下图所示:
(1)基态 原子的价电子排布式为
原子的价电子排布式为______ 。
(2)“精制”过程中,实际加入 的量比理论用量多,主要原因是
的量比理论用量多,主要原因是______ ; 是含有
是含有______ 键(填“极性”或“非极性”,下同)和______ 键的______ 分子: 能与水混溶,却不能溶于
能与水混溶,却不能溶于 ,请予以解释
,请予以解释______ 。
(3)“沉锰”过程得到的是 和
和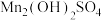 ,二者均可以被氧化为
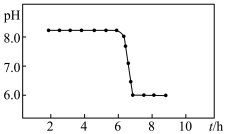
,二者均可以被氧化为 ,若“控温、氧化”过程中溶液的
,若“控温、氧化”过程中溶液的 随时间变化关系如下图所示,其中溶液的
随时间变化关系如下图所示,其中溶液的 明显下降的原因是
明显下降的原因是______ (用化学方程式表示)。
(4)“锂化”过程是将 和
和 按
按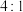 的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是______ 。
 ,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂
,还有少量铁、铝、及硅的氧化物)为原料制备锰酸锂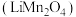 ,工业流程如下图所示:
,工业流程如下图所示:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“精制”过程中,实际加入
 的量比理论用量多,主要原因是
的量比理论用量多,主要原因是 是含有
是含有 能与水混溶,却不能溶于
能与水混溶,却不能溶于 ,请予以解释
,请予以解释(3)“沉锰”过程得到的是
 和
和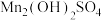 ,二者均可以被氧化为
,二者均可以被氧化为 ,若“控温、氧化”过程中溶液的
,若“控温、氧化”过程中溶液的 随时间变化关系如下图所示,其中溶液的
随时间变化关系如下图所示,其中溶液的 明显下降的原因是
明显下降的原因是
(4)“锂化”过程是将
 和
和 按
按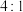 的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
的物质的量之比配料,反应3-5小时,然后升温至600-750℃,保温24小时,自然冷却至室温得到产品。该过程所得混合气体的成分是
您最近一年使用:0次



