名校
解题方法
1 . 化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价—类”二维图。铁元素的“价—类”二维图如图所示,下列说法正确的是
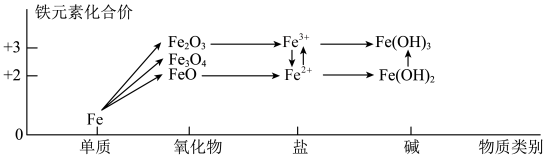
| A.高温条件下Fe和水蒸气反应生成Fe(OH)2和H2,该反应为置换反应 |
| B.FeO在加热的条件下能被氧气氧化成Fe3O4 |
| C.将饱和的FeCl3溶液加热煮沸可制得氢氧化铁胶体 |
| D.Fe(OH)2浊液露置于空气中,由白色立即变为红褐色 |
您最近半年使用:0次
2024-04-26更新
|
81次组卷
|
2卷引用:湖南省常德石门一中2023-2024年上学期高一年级化学期末考试卷(适用湖南地区))
2 . 对Ⅰ~Ⅳ的实验操作现象判断不正确的是
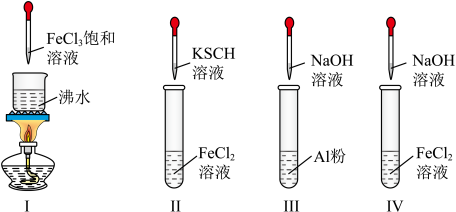
| A.实验Ⅰ:液体变为红褐色 |
| B.实验Ⅱ:溶液颜色变红 |
| C.实验Ⅲ:放出大量气体 |
| D.实验Ⅳ:先出现白色沉淀,迅速变成灰绿色,最后变成红褐色 |
您最近半年使用:0次
名校
解题方法
3 . 下列铁的化合物中,不能通过化合反应得到的是
| A.FeCl2 | B.Fe(OH)2 | C.Fe3O4 | D.Fe(OH)3 |
您最近半年使用:0次
解题方法
4 . 下列说法中不正确的是
| A.赤铁矿的主要成分与铁锈的主要成分相同 |
| B.Fe3O4可由单质直接化合而得到 |
| C.FeCl2、FeCl3、Fe(OH)3都可通过化合反应生成 |
| D.某溶液中滴加氯水,然后滴加KSCN溶液,溶液显红色,该溶液中一定含有Fe2+ |
您最近半年使用:0次
解题方法
5 . 下列各图示中能较长时间看到Fe(OH)2白色沉淀的

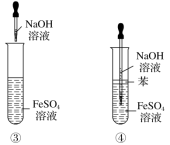
| A.①②③ | B.①②④ |
| C.①②③④ | D.②③④ |
您最近半年使用:0次
6 . 铁是人类较早使用的金属之一,回答下列问题。
(1)下列所含铁元素只有还原性的物质是___________ (填字母)。
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性,能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是___________ (填字母)。
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(4)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:___________ 。
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式___________ ;若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________ mol。
(1)下列所含铁元素只有还原性的物质是
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性,能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(4)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式
您最近半年使用:0次
7 . Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色Fe(OH)2,某实验小组做了如下探究实验。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、___________ 、___________ 。
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是___________ 。
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:___________ 。___________ (用离子方程式表示)。
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:___________ 。
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
①由以上实验可得到的规律是___________ 。
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为___________ (填“1.0”“1.5”或“2.0”)mol/L。
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为___________ (任写一条)。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:

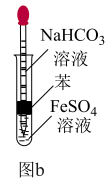
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
c(NaHCO3)/(mol/L) c(FeSO4)/(mol/L) | 1.0 | 1.5 | 2.0 | |
| 1.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 3.5 min | 9 min | 24 min | |
| 1.5 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 13 min | 15 min | 22 min | |
| 2.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率加快 | 常温下无现象,加热后产生白色沉淀 |
| 稳定时间 | 3 min | 8 min | 30 min | |
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为
您最近半年使用:0次
2024-04-16更新
|
266次组卷
|
2卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
名校
解题方法
8 . 下列方程式符合题意的是
A.实验室制备乙酸甲酯: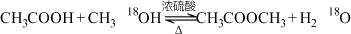 |
B. 溶于HNO3溶液中: 溶于HNO3溶液中: |
C.少量 NaHCO3与澄清石灰水反应:  |
D.Fe(OH)3和NaClO在碱性条件下反应制备 : : |
您最近半年使用:0次
名校
9 . 铁黄(FeOOH)是一种重要的化工产品.由生产钛白粉废渣(主要成分为FeSO4∙H2O,含少量TiOSO4和不溶物)制备铁黄的过程如下:
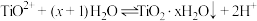
ii)Fe2+生成Fe(OH)2沉淀的pH:开始沉淀时pH=6.3,完全沉淀时pH=8.3;
Fe3+生成FeOOH沉淀的pH;开始沉淀时pH=1.5,完全沉淀时pH=2.8.
(1)纯化:加入过量铁粉的作用有:①__________ ;②__________ .
(2)制备晶种:为制备高品质铁黄产品,需先制备少量铁黄晶种.过程和现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.滴加氨水至pH为6.0时开始通空气并记录pH变化(如图).pH≈4时制得铁黄晶种.__________ .
②0~t2时段,Fe(OH)2和Fe2+转化为FeOOH制得铁黄晶种.
0~t1时段,发生化学反应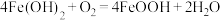 ,pH几乎不变;
,pH几乎不变;
t1~t2时段,pH明显降低.用离子方程式 解释pH明显降低的原因:__________ .
(3)产品纯度测定:铁黄(FeOOH)纯度可以通过产品的耗酸量确定,实验过程如下:
wg铁黄 溶液X
溶液X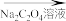 溶液Y
溶液Y 滴定
滴定
资料: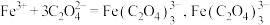 不与稀碱溶液反应;
不与稀碱溶液反应;
①用NaOH标准溶液测定溶解过程中剩余的酸,当溶液中的酸恰好被NaOH完全中和时,酚酞由无色变为浅粉色(pH在8~10范围),消耗b mol∙L-1的NaOH标准溶液V2mL,则所得铁黄样品的纯度为__________ ;(写出必要的计算过程)
②若Na2C2O4过量,会使测定结果__________ (填“偏大”“偏小”或“不受影响”);

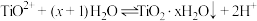
ii)Fe2+生成Fe(OH)2沉淀的pH:开始沉淀时pH=6.3,完全沉淀时pH=8.3;
Fe3+生成FeOOH沉淀的pH;开始沉淀时pH=1.5,完全沉淀时pH=2.8.
(1)纯化:加入过量铁粉的作用有:①
(2)制备晶种:为制备高品质铁黄产品,需先制备少量铁黄晶种.过程和现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.滴加氨水至pH为6.0时开始通空气并记录pH变化(如图).pH≈4时制得铁黄晶种.
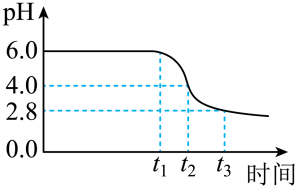
②0~t2时段,Fe(OH)2和Fe2+转化为FeOOH制得铁黄晶种.
0~t1时段,发生化学反应
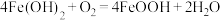 ,pH几乎不变;
,pH几乎不变;t1~t2时段,pH明显降低.用
(3)产品纯度测定:铁黄(FeOOH)纯度可以通过产品的耗酸量确定,实验过程如下:
wg铁黄
 溶液X
溶液X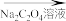 溶液Y
溶液Y 滴定
滴定资料:
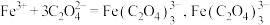 不与稀碱溶液反应;
不与稀碱溶液反应;①用NaOH标准溶液测定溶解过程中剩余的酸,当溶液中的酸恰好被NaOH完全中和时,酚酞由无色变为浅粉色(pH在8~10范围),消耗b mol∙L-1的NaOH标准溶液V2mL,则所得铁黄样品的纯度为
②若Na2C2O4过量,会使测定结果
您最近半年使用:0次
名校
解题方法
10 . 某小组同学为了获取在 制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。

【进行实验】
实验步骤:
I.向瓶中加入饱和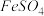 溶液,按图1所示连接装置;
溶液,按图1所示连接装置;
II.打开磁力搅拌器,立即加入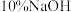 溶液;
溶液;
III.采集瓶内空气中 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:
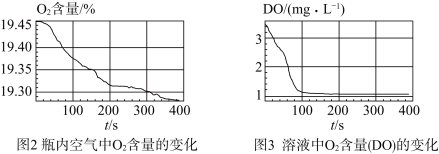
【解释与结论】
(1)盛放 的仪器为
的仪器为_________________ 。
(2)搅拌的目的是_________________ 。
(3)生成白色沉淀的离子方程式是_________________ 。
(4)红褐色沉淀是_________________ 。
(5)通过上述实验,可得到“在 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是_________________ 。
(6)结合上述实验,提出制备 过程中应注意的事项
过程中应注意的事项_________________ (回答一项即可)。
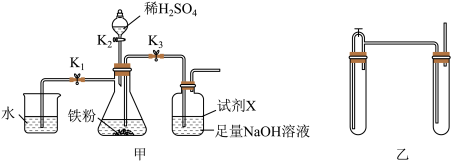
(7)某实验小组用如图甲所示装置制备 。下列说法正确的是( )
。下列说法正确的是( )
 制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
【进行实验】
实验步骤:
I.向瓶中加入饱和
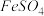 溶液,按图1所示连接装置;
溶液,按图1所示连接装置;II.打开磁力搅拌器,立即加入
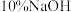 溶液;
溶液;III.采集瓶内空气中
 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:

【解释与结论】
(1)盛放
 的仪器为
的仪器为(2)搅拌的目的是
(3)生成白色沉淀的离子方程式是
(4)红褐色沉淀是
(5)通过上述实验,可得到“在
 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是(6)结合上述实验,提出制备
 过程中应注意的事项
过程中应注意的事项(7)某实验小组用如图甲所示装置制备
 。下列说法正确的是( )
。下列说法正确的是( )
| A.甲装置在使用前需检查气密性 |
B.实验时打开旋塞的顺序依次为 |
| C.试剂X可选用植物油,其主要作用是隔绝空气 |
D.甲选用装置中除水外的药品,可用乙装置代替甲装置制备 |
您最近半年使用:0次



