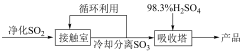
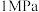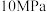1 . 工业制备硫酸的生产过程及相关信息如下。下列有关说法正确的是
温度/℃ | 不同压强下接触室中 | |
|
| |
450 | 99.2 | 99.7 |
550 | 94.9 | 97.7 |
工艺流程 |
| |
A.循环利用的物质是 |
B.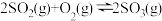 为放热反应 为放热反应 |
C.吸收塔中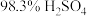 表现强氧化性 表现强氧化性 |
D.实际生产中,接触室中应采用温度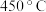 ,压强 ,压强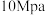 |
您最近半年使用:0次
名校
2 . 下列实验方法或方案能达到目的的是
| 目的 | 实验方法或方案 | |
| A | 探究压强对化学平衡的影响 | 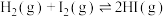  |
| B | 证明碳酸钠水解能力比碳酸氢钠强 | 分别向盛有 饱和 饱和 溶液和饱和 溶液和饱和 溶液的试管中滴加3滴酚酞溶液,观察颜色变化 溶液的试管中滴加3滴酚酞溶液,观察颜色变化 |
| C | 探究浓度对化学平衡移动的影响 | 向两支盛有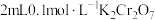 溶液的试管中分别滴入3滴浓硫酸和3滴浓 溶液的试管中分别滴入3滴浓硫酸和3滴浓 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 |
| D | 探究浓度对反应速率的影响 | 分别向两支盛有 溶液的试管中分别加入 溶液的试管中分别加入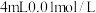 和 和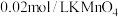 溶液,比较溶液褪色快慢 溶液,比较溶液褪色快慢 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
3 . 在恒温恒容下,在一容器充入2molSO2和1molO2发生反应:2SO2(g)+O2(g)⇌2SO3(g),达到平衡后,SO3的体积分数为p%。在恒温恒容下再充入2molSO2和1molO2,再次达到平衡后,SO3的体积分数为
| A.小于p% | B.等于p% | C.大于p% | D.无法判断 |
您最近半年使用:0次
名校
4 . 反应N2O4(g)=2NO2(g) ΔH=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

| A.A、C两点的反应速率:A>C |
| B.A、B两点气体的颜色:A深,B浅 |
| C.T1>T2 |
| D.A、C两点气体的平均相对分子质量:A>C |
您最近半年使用:0次
2024-02-08更新
|
110次组卷
|
21卷引用:广东省广州市第二中学2022-2023学年高二上学期期中考试化学试题
广东省广州市第二中学2022-2023学年高二上学期期中考试化学试题广西河池市2021-2022学年高二下学期期末考试化学试题(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)2.2.3 化学反应速率与平衡图像专题 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省问津联合体2022-2023学年高二上学期10月质量检测化学试题湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题浙江省金华市横店高中2022-2023学年高二上学期10月份检测化学试题吉林省长春市农安县教师进修学校2022-2023学年高二上学期期末考试化学试题重庆市2022-2023学年高二下学期6月月考化学试题浙江省台州市台州八校联盟2022-2023学年高二上学期11月期中联考化学试题江西省永修县第一中学2023-2024学年高二上学期开学考试化学试题河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题宁夏银川市贺兰县第一中学2023-2024学年高二上学期第一阶段考试化学试题安徽省马鞍山市第二中学2022-2023学年高二上学期11月期中考试化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期10月月考化学试题四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题陕西省西安中学2023-2024学年高二上学期11月期中考试化学试题四川省内江市威远中学2023-2024学年高二上学期第一次月考化学试题山东省济宁市嘉祥县第一中学2023-2024学年高二上学期10月月考化学试题湖北省武汉市育才高级中学等2校2023-2024学年高二上学期化学模拟试卷福建省莆田五中2023-2024学年高二上学期第三次月考化学试卷
5 . 在一定条件下的密闭容器中发生反应 ,当达到平衡时,下列各项措施中,既能提高反应速率又能提高乙烷平衡转化率的是
,当达到平衡时,下列各项措施中,既能提高反应速率又能提高乙烷平衡转化率的是
 ,当达到平衡时,下列各项措施中,既能提高反应速率又能提高乙烷平衡转化率的是
,当达到平衡时,下列各项措施中,既能提高反应速率又能提高乙烷平衡转化率的是| A.减小容器的容积 | B.升高反应的温度 | C.分离出部分氢气 | D.恒容下通入氦气 |
您最近半年使用:0次
名校
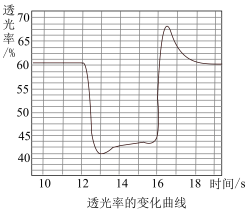
6 . 常温,利用色度计传感器检测透光率的变化以探究压强对反应体系2NO2 N2O4的影响,如图所示。已知:物质颜色越深,对光的吸收程度越大,透光率越小。下列说法错误的是
N2O4的影响,如图所示。已知:物质颜色越深,对光的吸收程度越大,透光率越小。下列说法错误的是
 N2O4的影响,如图所示。已知:物质颜色越深,对光的吸收程度越大,透光率越小。下列说法错误的是
N2O4的影响,如图所示。已知:物质颜色越深,对光的吸收程度越大,透光率越小。下列说法错误的是 
| A.10s时为化学平衡状态 | B.13s~16s的变化说明平衡正向移动 |
| C.16s时改变的操作是增大体系压强 | D.17s~18s中NO2的体积分数增大 |
您最近半年使用:0次
名校
7 . 实验室中常采用测气体密度的方法间接测定物质的相对分子质量,已知醋酸能形成二聚物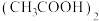 ,反应为
,反应为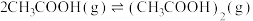
 。为减小误差,测定醋酸气体密度时应采取
。为减小误差,测定醋酸气体密度时应采取
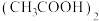 ,反应为
,反应为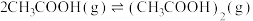
 。为减小误差,测定醋酸气体密度时应采取
。为减小误差,测定醋酸气体密度时应采取| A.低温低压 | B.低温高压 | C.高温高压 | D.高温低压 |
您最近半年使用:0次
名校
8 . 在一密闭容器中,反应aM(g) bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%。下列有关判断正确的是
bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%。下列有关判断正确的是
 bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%。下列有关判断正确的是
bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%。下列有关判断正确的是| A.平衡向逆反应方向移动 | B.反应的化学平衡常数变大 |
| C.物质M的转化率变小 | D.a、b的大小关系是:a < b |
您最近半年使用:0次
名校
9 . 完成下列问题
(1)如图中,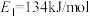 ,
,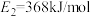 ,根据要求回答问题:
,根据要求回答问题:
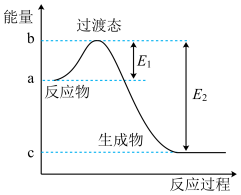
如图是1mol NO2和1molCO反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”“减小”或“不变”),请写出NO2和CO反应的热化学方程式:___________ 。
(2)在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中发生反应H2(g)+I2(g) 2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
 保持容器容积不变,向其中再加入1molH2,反应速率
保持容器容积不变,向其中再加入1molH2,反应速率___________ (填“增大”、“减小”或“不变”),平衡___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
②保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率___________ (填“增大”、“减小”或“不变”),平衡___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
③该反应的化学平衡常数K=___________ 。
(1)如图中,
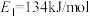 ,
,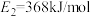 ,根据要求回答问题:
,根据要求回答问题:
如图是1mol NO2和1molCO反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
 的变化是
的变化是(2)在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中发生反应H2(g)+I2(g)
 2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。 保持容器容积不变,向其中再加入1molH2,反应速率
保持容器容积不变,向其中再加入1molH2,反应速率②保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率
③该反应的化学平衡常数K=
您最近半年使用:0次
名校
10 . Ⅰ.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500 ℃时催化剂效果最好
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
(2)分析表格数据,为了使SO2尽可能多地转化为SO3,应选择______ ℃、______ Mpa下进行实验。
(3)在实际生产中,选定的温度为400~500 ℃,原因是___
(4)在实际生产中,采用的压强为常压,原因是______
(5)在实际生产中,通入过量的空气,原因是_____
(6)尾气中SO2必须回收,原因是______
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:

已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为_____ ,CH3CH2OH(g)的体积分数为_____ %(保留一位小数)。
(8)此温度下,该反应的化学平衡常数Kp=_____ MPa-1(用平衡分压代替平衡浓度计算,列出计算式,不要求计算结果)。
 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
| A.SO2的体积分数不再变化 | B.混合物的密度不再变化 |
| C.v(SO2)=2v(O2) | D.气体的压强不再变化 |
(3)在实际生产中,选定的温度为400~500 ℃,原因是
(4)在实际生产中,采用的压强为常压,原因是
(5)在实际生产中,通入过量的空气,原因是
(6)尾气中SO2必须回收,原因是
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为
(8)此温度下,该反应的化学平衡常数Kp=
您最近半年使用:0次

 的平衡转化率/
的平衡转化率/