名校
1 . Ⅰ.在硫酸工业中,通过下列反应使SO2转化为SO3:其中一步反应为2SO2(g)+O2(g)  2SO3(g) ΔH= −196.6kJ·mol-1。
2SO3(g) ΔH= −196.6kJ·mol-1。
(1)利用下表实验数据回答问题:
①应选择的温度是___________ 。
②应采用的压强是___________ ,理由是___________ 。
③实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是___________ 。
Ⅱ.在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2 L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
(2)①该温度下此反应的化学平衡常数为K=___________ 。
②在相同温度下,某容器内c(SO2) = c(O2) = c(SO3) = 1.0 mol·L-1,则此时反应速率 v(正)___________ v(逆) (填“>”、“<”或“=”)。
Ⅲ.下图表示在密闭容器中反应:2SO2+O2 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
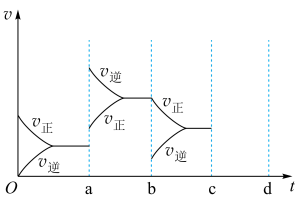
(3)若在c时刻压缩体积增大压强,请在图上将反应速率和化学平衡变化情况画在c~d处(每一时刻只改变浓度、温度、压强、催化剂条件之一)________ 。
 2SO3(g) ΔH= −196.6kJ·mol-1。
2SO3(g) ΔH= −196.6kJ·mol-1。(1)利用下表实验数据回答问题:
| 温度 | 平衡时SO2的转化率(%) | ||||
| 1×105Pa | 5×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
②应采用的压强是
③实际生产中原料气含SO2为7%(体积分数)、O2为11%。O2相对过量的理由是
Ⅱ.在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2 L的密闭容器中发生反应:2SO2(g)+O2(g)
 2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。
2SO3(g),经过2 min达到平衡状态,SO2的平衡转化率90.0%。(2)①该温度下此反应的化学平衡常数为K=
②在相同温度下,某容器内c(SO2) = c(O2) = c(SO3) = 1.0 mol·L-1,则此时反应速率 v(正)
Ⅲ.下图表示在密闭容器中反应:2SO2+O2
 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况。
(3)若在c时刻压缩体积增大压强,请在图上将反应速率和化学平衡变化情况画在c~d处(每一时刻只改变浓度、温度、压强、催化剂条件之一)
您最近半年使用:0次
名校
2 . 200℃时,向真空恒容密闭容器中加入足量草酸锰固体(MnC2O4),发生反应:MnC2O4(s) MnO(s)+CO(g)+CO2(g)。达到平衡时,c(CO)=1mol/L,保持温度不变,将体积缩小至原来的一半且保持不变,达到二次平衡。与第一次平衡相比,第二次平衡时,下列说法错误的是
MnO(s)+CO(g)+CO2(g)。达到平衡时,c(CO)=1mol/L,保持温度不变,将体积缩小至原来的一半且保持不变,达到二次平衡。与第一次平衡相比,第二次平衡时,下列说法错误的是
 MnO(s)+CO(g)+CO2(g)。达到平衡时,c(CO)=1mol/L,保持温度不变,将体积缩小至原来的一半且保持不变,达到二次平衡。与第一次平衡相比,第二次平衡时,下列说法错误的是
MnO(s)+CO(g)+CO2(g)。达到平衡时,c(CO)=1mol/L,保持温度不变,将体积缩小至原来的一半且保持不变,达到二次平衡。与第一次平衡相比,第二次平衡时,下列说法错误的是| A.容器的压强不变 | B. c(CO)不变 |
| C.MnO的质量减小 | D.逆反应速率增大 |
您最近半年使用:0次
2024-01-01更新
|
111次组卷
|
5卷引用:广东省汕头市金山中学2023-2024学年高二上学期期中考试 化学试题
广东省汕头市金山中学2023-2024学年高二上学期期中考试 化学试题黑龙江省大庆实验中学二部2023-2024学年高二上学期10月阶段性考试化学试题(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)河南省驻马店市“逐梦计划”大联考2023-2024学年高二上学期12月期末考试化学试题河北省保定市高碑店市崇德实验中学2023-2024学年高三上学期1月考试化学试题
名校
解题方法
3 . 2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:
i.

ii.
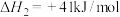
(1)研究表明,CO与 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:___________ 。
(2)上述反应在大型定容密闭容器中进行,下列说法正确的是___________。
(3)其他条件相同,仅改变容器体积,实验测得CO的平衡产率随着压强的增加而减少,可能原因是___________ 。
(4)在催化剂作用下,将 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率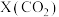 、
、 选择性
选择性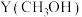 的影响如下。
的影响如下。
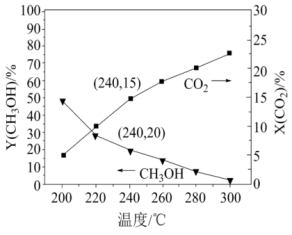
已知: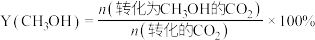
①240℃体系达到平衡时用时为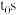 ,则
,则
___________ 
②该温度下反应ⅰ的化学平衡常数为___________ (列出计算式即可,数据用小数表示)
③在240℃达到平衡时,体系___________ (填“吸收”或“放出”)的热量为___________ kJ(除了反应ⅰ和ⅱ不考虑其他反应)。
 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:i.


ii.

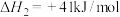
(1)研究表明,CO与
 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(2)上述反应在大型定容密闭容器中进行,下列说法正确的是___________。
| A.反应i的活化能Ea大于反应ii |
| B.容器内压强不变时可以判断反应达到平衡 |
| C.升高温度可以提高甲醇的平衡产率 |
D.使用性能更佳的催化剂有可能提高 单位时间内的转化率 单位时间内的转化率 |
(3)其他条件相同,仅改变容器体积,实验测得CO的平衡产率随着压强的增加而减少,可能原因是
(4)在催化剂作用下,将
 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率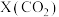 、
、 选择性
选择性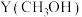 的影响如下。
的影响如下。
已知:
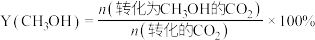
①240℃体系达到平衡时用时为
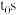 ,则
,则

②该温度下反应ⅰ的化学平衡常数为
③在240℃达到平衡时,体系
您最近半年使用:0次
名校
4 . 下列说法正确的是
A.恒温恒压,N2+3H2 2NH3达平衡时,各物质的物质的量均为1mol。再充3molN2,平衡正向移动 2NH3达平衡时,各物质的物质的量均为1mol。再充3molN2,平衡正向移动 |
| B.常温下,pH=3的醋酸与pH=3的盐酸体积比1:2混合后,混合溶液的pH=3 |
C.一定温度下的密闭容器中,发生反应2Cu2O(s)+O2(g) 4CuO(s),达平衡时压强为P0,将容器体积减小至原来的一半,达到新的平衡时气体压强为P,则P0<P<2P0 4CuO(s),达平衡时压强为P0,将容器体积减小至原来的一半,达到新的平衡时气体压强为P,则P0<P<2P0 |
D.恒温恒体积的容器,对反应2NO2(g) N2O4(g),在一定条件下达到平衡。若增加NO2的物质的量,可使再次平衡时 N2O4(g),在一定条件下达到平衡。若增加NO2的物质的量,可使再次平衡时 的值增大 的值增大 |
您最近半年使用:0次
名校
5 . 研究 之间的转化具有重要意义。
之间的转化具有重要意义。
已知:

将一定量 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。
(1)下列可以作为反应达到平衡的判据是___________(填编号)。
(2)反应温度 时,体系中
时,体系中 、
、 随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为
随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为 ,
, 随t(时间)变化曲线如图虚线所示。
随t(时间)变化曲线如图虚线所示。
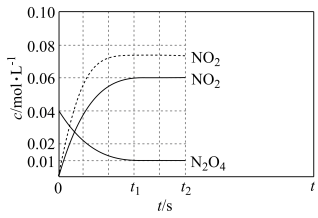
① ,在0~60s时段,反应速率
,在0~60s时段,反应速率 为
为___________ 
②反应温度为
___________ (填“大于”或“小于”) 。
。
③温度 时反应达平衡后,将反应容器的容积减少一半,平衡向
时反应达平衡后,将反应容器的容积减少一半,平衡向___________ (填“正反应”或“逆反应”)方向移动。
④ 时刻反应达到平衡,混合气体平衡总压强为p,
时刻反应达到平衡,混合气体平衡总压强为p, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)NO氧化反应: 分两步进行,其反应过程能量变化示意图如图。
分两步进行,其反应过程能量变化示意图如图。
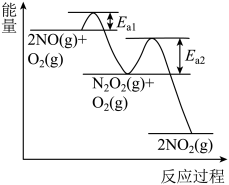
Ⅰ.

Ⅱ.

决定NO氧化反应速率的步骤是___________ (填“Ⅰ”或“Ⅱ”)。
 之间的转化具有重要意义。
之间的转化具有重要意义。已知:


将一定量
 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。(1)下列可以作为反应达到平衡的判据是___________(填编号)。
| A.气体的压强不变 | B. |
| C.K不变 | D.容器内颜色不变 |
(2)反应温度
 时,体系中
时,体系中 、
、 随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为
随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为 ,
, 随t(时间)变化曲线如图虚线所示。
随t(时间)变化曲线如图虚线所示。
①
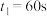 ,在0~60s时段,反应速率
,在0~60s时段,反应速率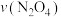 为
为
②反应温度为

 。
。③温度
 时反应达平衡后,将反应容器的容积减少一半,平衡向
时反应达平衡后,将反应容器的容积减少一半,平衡向④
 时刻反应达到平衡,混合气体平衡总压强为p,
时刻反应达到平衡,混合气体平衡总压强为p, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
(3)NO氧化反应:
 分两步进行,其反应过程能量变化示意图如图。
分两步进行,其反应过程能量变化示意图如图。
Ⅰ.


Ⅱ.


决定NO氧化反应速率的步骤是
您最近半年使用:0次
名校
解题方法
6 . 乙烯气相水化法制备乙醇: 。乙烯的平衡转化率随温度、压强的变化关系如下图(起始时,
。乙烯的平衡转化率随温度、压强的变化关系如下图(起始时,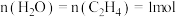 )。
)。
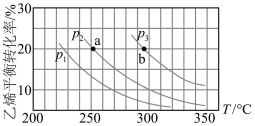
下列分析不正确的是
 。乙烯的平衡转化率随温度、压强的变化关系如下图(起始时,
。乙烯的平衡转化率随温度、压强的变化关系如下图(起始时,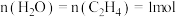 )。
)。
下列分析不正确的是
A.乙烯气相直接水化反应的 |
B.图中压强的大小关系为: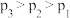 |
| C.图中a、b两点对应的化学平衡常数相等 |
D.达到平衡状态a、b所需要的时间: |
您最近半年使用:0次
名校
解题方法
7 . NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应: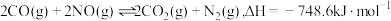 ,
, ,反应速率较小,有关该反应的说法正确的是
,反应速率较小,有关该反应的说法正确的是
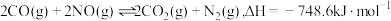 ,
, ,反应速率较小,有关该反应的说法正确的是
,反应速率较小,有关该反应的说法正确的是| A.K很大,说明NO与CO在排入大气之前就已反应完全 |
B.增大压强,反应速率增大,平衡将向右移动,K>2.5 106 106 |
| C.升高温度,既加快反应速率又可以提高有害气体的平衡转化率 |
| D.选用适宜催化剂可以使尾气排放达到标准 |
您最近半年使用:0次
2023-12-22更新
|
71次组卷
|
3卷引用:广东省广州真光中学2021-2022学年高二上学期期中考试化学试题
名校
8 . 如图为某化学反应的反应速率随反应时间的变化示意图,在t1时刻升高温度或增大压强都符合图示变化的反应是


A.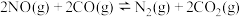  |
B.  |
C.  |
D.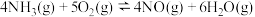  |
您最近半年使用:0次
2023-12-22更新
|
76次组卷
|
3卷引用:广东省广州市黄埔区2022-2023学年高二上学期期末考试化学试题
名校
解题方法
9 . 氮的氧化物是大气污染物之一,研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)碘蒸气的存在能大幅度提高 的分解速率,反应历程为:
的分解速率,反应历程为:
第一步: (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: (快反应)
(快反应)
实验表明,含碘时 分解速率方程
分解速率方程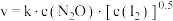 (
( 为速率常数)。下列表述正确的是___________
为速率常数)。下列表述正确的是___________
(2)对反应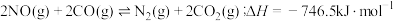 ,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
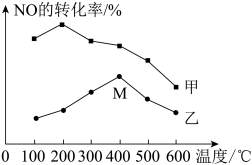
图中M点对应的速率(对应温度 )
)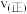
___________ 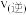 (填“>”、“<”或“=”),温度高于
(填“>”、“<”或“=”),温度高于 ,NO转化率降低的原因可能是
,NO转化率降低的原因可能是___________ 。
(3)在密闭容器中充入 和
和 ,发生反应:
,发生反应: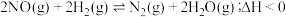 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。

①下列物理量中,图中d点大于b点的是___________ (填字母)。
A.正反应速率 B.逆反应速率
C. 的浓度 D.对应温度的平衡常数
的浓度 D.对应温度的平衡常数
②c点NO的平衡转化率为___________ 。
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的___________ 点。
(4) 时,向容积为2L的恒容容器中充入
时,向容积为2L的恒容容器中充入 、
、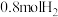 ,发生反应:
,发生反应: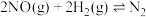
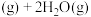 ,体系的总压强P随时间t的变化如下表所示:
,体系的总压强P随时间t的变化如下表所示:
①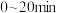 内该反应的平均反应速率
内该反应的平均反应速率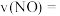
___________  。
。
②该温度下反应的平衡常数
___________  (用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(1)碘蒸气的存在能大幅度提高
 的分解速率,反应历程为:
的分解速率,反应历程为:第一步:
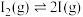 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
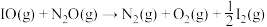 (快反应)
(快反应)实验表明,含碘时
 分解速率方程
分解速率方程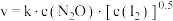 (
( 为速率常数)。下列表述正确的是___________
为速率常数)。下列表述正确的是___________| A.升高温度,第一步向右进行的程度变大 |
| B.第二步的活化能比第三步小 |
C. 为反应的催化剂 为反应的催化剂 |
D. 分解反应的速率与是否含碘蒸气有关 分解反应的速率与是否含碘蒸气有关 |
(2)对反应
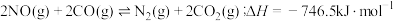 ,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
,分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,在相同时间内测得NO转化率与温度的关系如图所示。
图中M点对应的速率(对应温度
 )
)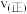
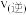 (填“>”、“<”或“=”),温度高于
(填“>”、“<”或“=”),温度高于 ,NO转化率降低的原因可能是
,NO转化率降低的原因可能是(3)在密闭容器中充入
 和
和 ,发生反应:
,发生反应: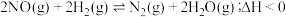 。平衡时NO的体积分数随温度、压强的变化关系如图。
。平衡时NO的体积分数随温度、压强的变化关系如图。
①下列物理量中,图中d点大于b点的是
A.正反应速率 B.逆反应速率
C.
 的浓度 D.对应温度的平衡常数
的浓度 D.对应温度的平衡常数②c点NO的平衡转化率为
③若在M点对反应容器升温的同时扩大容器体积使体系压强减小,重新达到的平衡状态可能是图中a、b、c、d中的
(4)
 时,向容积为2L的恒容容器中充入
时,向容积为2L的恒容容器中充入 、
、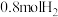 ,发生反应:
,发生反应: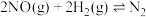
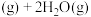 ,体系的总压强P随时间t的变化如下表所示:
,体系的总压强P随时间t的变化如下表所示: | 0 | 10 | 20 | 30 | 40 |
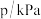 | 240 | 226 | 216 | 210 | 210 |
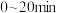 内该反应的平均反应速率
内该反应的平均反应速率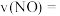
 。
。②该温度下反应的平衡常数

 (用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
(用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数,列出计算式即可)。
您最近半年使用:0次
2023-12-18更新
|
162次组卷
|
2卷引用:广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题
10 . 某恒定温度下,在一个 的密闭容器中充入
的密闭容器中充入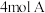 气体、
气体、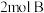 气体,发生如下反应:
气体,发生如下反应: ,已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成
,已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成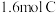 ,且反应前后压强比为
,且反应前后压强比为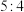 ,则下列说法中正确的是
,则下列说法中正确的是
①该反应的化学平衡常数表达式: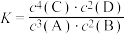
②此时B的转化率为40%
③增大该体系压强,平衡向右移动,化学平衡常数增大
④增加C的量,A、B转化率不变
 的密闭容器中充入
的密闭容器中充入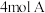 气体、
气体、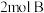 气体,发生如下反应:
气体,发生如下反应: ,已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成
,已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成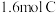 ,且反应前后压强比为
,且反应前后压强比为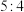 ,则下列说法中正确的是
,则下列说法中正确的是①该反应的化学平衡常数表达式:
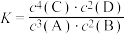
②此时B的转化率为40%
③增大该体系压强,平衡向右移动,化学平衡常数增大
④增加C的量,A、B转化率不变
| A.①②③ | B.②③④ | C.②④ | D.③④ |
您最近半年使用:0次



