名校
1 . 联系生产生活实际,下列说法,不能根据平衡移动原理解释的是
| A.供热公司为了节能减排,将煤块粉碎燃烧 |
| B.可乐瓶开启后,马上泛起大量气泡,并可能将可乐冲出瓶口 |
| C.氯气在饱和食盐水中的溶解度比在水中小 |
| D.将一氧化碳中毒者放入高压氧舱,增大氧气浓度,缓解病情 |
您最近一年使用:0次
2021-12-02更新
|
148次组卷
|
2卷引用:福建省福州外国语学校2021-2022学年高二上学期期中考试化学试题
名校
2 . 将一定量纯净的X置于某10L容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡: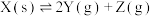 ,实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
,实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
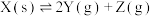 ,实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是
,实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是| 温度(°C) | 15.0 | 25.0 | 30.0 | 35.0 |
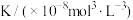 | 0.205 | 1.64 | 4.68 | 10.8 |
A.该反应 |
| B.若气体密度不再随时间变化时表示反应达平衡状态 |
| C.若在恒温下,压缩容器体积,再次达平衡后,X的物质的量比原平衡大 |
| D.35℃时,达平衡时,X分解了0.02mol |
您最近一年使用:0次
名校
3 . 人体内的血红蛋白(Hb)可与O2结合形成HbO2,Hb(aq)也可以与CO结合,人体发生CO中毒的原理为:HbO2(aq)+CO(g) HbCO(aq)+O2(g) ΔH<0.下列说法
HbCO(aq)+O2(g) ΔH<0.下列说法不正确 的是
 HbCO(aq)+O2(g) ΔH<0.下列说法
HbCO(aq)+O2(g) ΔH<0.下列说法| A.海拔较高的地区由于气压较低,所以血红蛋白较难与O2结合,容易产生缺氧现象 |
| B.已知CO中毒为熵减过程,则理论上冬天比夏天可能更容易发生CO中毒现象 |
| C.把CO中毒的人转到高压氧仓中有助于缓解症状 |
D.此反应的平衡常数K=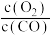 |
您最近一年使用:0次
2021-03-05更新
|
573次组卷
|
8卷引用:考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)重庆市石柱中学校2021-2022学年高二上学期第一次月考化学试题甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题浙江省金华十校2021届高三11月选考化学模拟试卷(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
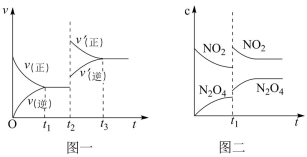
4 . 已知图一表示的是可逆反应C(s)+H2O(g) CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)
CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g) 2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
 CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)
CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g) 2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件是增大压强,则反应的△H增大 |
| C.图二t1时改变的条件可能是升高了温度 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
您最近一年使用:0次
2021-03-04更新
|
905次组卷
|
8卷引用:新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(4-21班)试题
新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(4-21班)试题(已下线)周末培优1 化学反应速率与化学平衡图像问题-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)四川省成都市简阳市阳安中学2021-2022学年高二上学期9月月考化学试卷广东省佛山市南海区桂城中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.4 化学反应的调控(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)广东省徐闻县徐闻中学2022-2023学年高二上学期开学测试化学试题广东省广州市四校联考2022-2023学年高二上学期第一次月考化学试题
5 . 氨是化肥生产工业的重要原料。传统的Haber—Bosch法目前仍是合成氨的主要方式,反应原理为N2(g)+3H2(g) 2NH3(g),其生产条件需要高温高压。近来电催化氮气合成氨因节能、环境友好等优势,受到广泛关注,下列有关Haber-Bosch法合成氨反应的说法正确的是
2NH3(g),其生产条件需要高温高压。近来电催化氮气合成氨因节能、环境友好等优势,受到广泛关注,下列有关Haber-Bosch法合成氨反应的说法正确的是
 2NH3(g),其生产条件需要高温高压。近来电催化氮气合成氨因节能、环境友好等优势,受到广泛关注,下列有关Haber-Bosch法合成氨反应的说法正确的是
2NH3(g),其生产条件需要高温高压。近来电催化氮气合成氨因节能、环境友好等优势,受到广泛关注,下列有关Haber-Bosch法合成氨反应的说法正确的是| A.该反应的ΔH>0、ΔS<0 |
| B.将氨气及时液化分离可加快化学反应速率 |
| C.当2v(H2)正=3v(NH3)逆时,反应达到平衡状态 |
| D.提高体系的压强可增大反应的化学平衡常数 |
您最近一年使用:0次
2021-11-20更新
|
413次组卷
|
6卷引用:江苏省常州市部分重点中学2021-2022学年高三上学期期中考试化学试题
江苏省常州市部分重点中学2021-2022学年高三上学期期中考试化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点06 化学反应速率与化学平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
6 . 在容积恒为1 L的密闭容器中通入一定量N2O4,发生反应 △H>0。假设温度不变,体系中各组分浓度随时间(t)的变化如下表。下列说法错误的是
△H>0。假设温度不变,体系中各组分浓度随时间(t)的变化如下表。下列说法错误的是
 △H>0。假设温度不变,体系中各组分浓度随时间(t)的变化如下表。下列说法错误的是
△H>0。假设温度不变,体系中各组分浓度随时间(t)的变化如下表。下列说法错误的是| t/s | 0 | 20 | 40 | 60 | 80 |
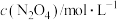 | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
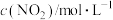 | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
A.0~40 s,N2O4的平均反应速率为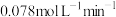 |
| B.80 s时,再充入N2O4、NO2各0.12 mol,平衡移动 |
| C.升高温度,反应的化学平衡常数值增大 |
| D.若压缩容器,达新平衡后,混合气颜色比原平衡时深 |
您最近一年使用:0次
2021-09-12更新
|
402次组卷
|
2卷引用:山东省济南市历城第二中学2021-2022学年(2022届)高三上学期开学考试(B)化学试题
7 . 在一定体积的密闭容器中,可逆反应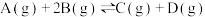 ,有如图所示的反应曲线,下列说法中错误的是
,有如图所示的反应曲线,下列说法中错误的是
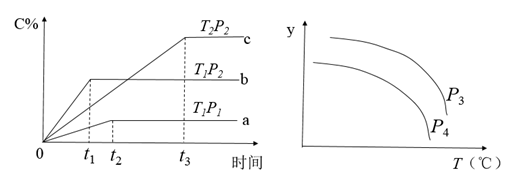
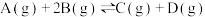 ,有如图所示的反应曲线,下列说法中错误的是
,有如图所示的反应曲线,下列说法中错误的是
| A.正反应是放热反应 | B. |
C.若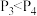 ,y轴可表示A的转化率 ,y轴可表示A的转化率 | D.若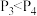 ,y轴可表示D的体积分数 ,y轴可表示D的体积分数 |
您最近一年使用:0次
名校
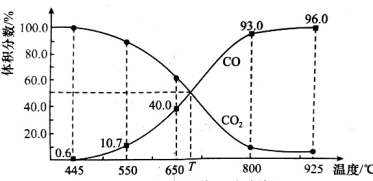
8 . 一定量的 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: 。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压
。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压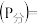 气体总压
气体总压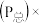 体积分数。下列说法不正确的是
体积分数。下列说法不正确的是
 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: 。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压
。平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压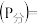 气体总压
气体总压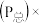 体积分数。下列说法不正确的是
体积分数。下列说法不正确的是
A.该反应 , , |
B.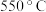 时,若充入惰性气体, 时,若充入惰性气体, , , 均减小,平衡向正反应方向移动 均减小,平衡向正反应方向移动 |
C. 时,若充入等体积的 时,若充入等体积的 和 和 ,平衡向逆反应方向移动 ,平衡向逆反应方向移动 |
D.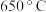 时,反应达平衡后 时,反应达平衡后 的转化率为 的转化率为 |
您最近一年使用:0次
2021-09-10更新
|
263次组卷
|
3卷引用:山西省运城市2022届高三上学期入学摸底测试化学试题
9 . 已知N2(g)+3H2(g) 2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
 2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是| 容器 | 甲(恒温、恒容) | 乙(绝热、恒容) | 丙(恒温、恒压) |
| 反应物投入量 | 1molN2、3molH2 | 1molN2、3molH2 | 1molN2、3molH2 |
| NH3的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应物的转化率 | α1 | α2 | α3 |
| 化学平衡常数 | K1 | K2 | K3 |
| 混合气体的平均相对分子质量 | M1 | M2 | M3 |
| A.c2<c1<c3 | B.α2<α3<α1 |
| C.K2<K1=K3 | D.M2<M1<M3 |
您最近一年使用:0次
名校
10 . 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生如下反应:CO(g)+H2O(g) CO2+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法不正确的是
CO2+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法不正确的是
 CO2+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法不正确的是
CO2+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法不正确的是| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.80 | 0.90 |
| t1 | 1.20 | |
| t2 | 0.30 |
| A.t2后若压缩容器体积至原来一半,再次平衡则c(H2O)=0.30mol/L |
| B.若初始量CO:3.6mol,H2O:1.8mol,则平衡时n(H2O)=0.60mol |
| C.t2后若增加0.9 mol H2O,则再次平衡时,H2的体积分数为25% |
| D.若为绝热容器(容器初始温度仍为700℃),其他条件不变,则平衡时n(H2)>0.60mol |
您最近一年使用:0次
2021-11-15更新
|
201次组卷
|
4卷引用:安徽省A10联盟2021-2022学年高二上学期期中联考化学试题



