名校
解题方法
1 . 工业生产中利用方铅矿(主要成分为 ,含有
,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如图:
晶体的工艺流程如图: ;
; ,
,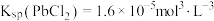 。
。
下列说法错误的是
 ,含有
,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如图:
晶体的工艺流程如图: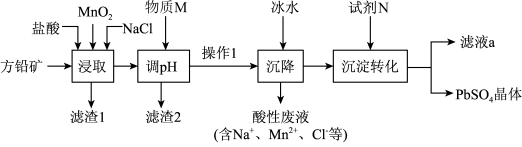
 ;
; ,
,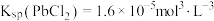 。
。下列说法错误的是
A.“浸取”时发生反应: |
B.物质M可以为 ,试剂N可以为 ,试剂N可以为 |
C.由该工艺可知, 反应放热 反应放热 |
D.“沉淀转化”过程达平衡时,溶液中 |
您最近一年使用:0次
2024-03-01更新
|
865次组卷
|
3卷引用:湖南省长沙市雅礼中学2024届高三下学期模拟考卷(二)化学试题
名校
2 .  作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
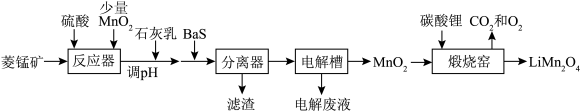
已知常温下部分物质的 如表。
如表。
回答下列问题:
(1)基态Mn原子的价电子轨道表示式为______ 。
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是______ ;若测得溶液中 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于______ 。(已知:离子浓度小于等于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)
(3)加入少量BaS溶液除去 ,生成的沉淀有
,生成的沉淀有______ (填化学式)。
(4)具有强氧化性的过一硫酸( )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ (已知: 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。
(5)煅烧窑中,生成 反应的化学方程式是
反应的化学方程式是______ 。
(6) 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。
由此可以确定,在上述温度范围内,锰元素的平均价态的变化情况是______ 。
 作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的
 如表。
如表。物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)基态Mn原子的价电子轨道表示式为
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是
 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)(3)加入少量BaS溶液除去
 ,生成的沉淀有
,生成的沉淀有(4)具有强氧化性的过一硫酸(
 )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。(5)煅烧窑中,生成
 反应的化学方程式是
反应的化学方程式是(6)
 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。T/℃ |
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 44.40 | 49.38 |
您最近一年使用:0次
2024-02-25更新
|
845次组卷
|
3卷引用:湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题
湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
3 .  在水溶液中主要以
在水溶液中主要以 、
、 的形式存在。方解石(主要成分
的形式存在。方解石(主要成分 )在天然水体中会逐渐溶解并释放
)在天然水体中会逐渐溶解并释放 ,与水体中的
,与水体中的 形成
形成 难溶物。体系中
难溶物。体系中 与
与 关系如下图所示,
关系如下图所示, 为
为 、
、 、
、 、
、 的浓度,单位为
的浓度,单位为 。已知天然水体表面
。已知天然水体表面 的分压保持恒定,
的分压保持恒定, 的电离方程式可写成
的电离方程式可写成 。下列说法错误的是
。下列说法错误的是
 在水溶液中主要以
在水溶液中主要以 、
、 的形式存在。方解石(主要成分
的形式存在。方解石(主要成分 )在天然水体中会逐渐溶解并释放
)在天然水体中会逐渐溶解并释放 ,与水体中的
,与水体中的 形成
形成 难溶物。体系中
难溶物。体系中 与
与 关系如下图所示,
关系如下图所示, 为
为 、
、 、
、 、
、 的浓度,单位为
的浓度,单位为 。已知天然水体表面
。已知天然水体表面 的分压保持恒定,
的分压保持恒定, 的电离方程式可写成
的电离方程式可写成 。下列说法错误的是
。下列说法错误的是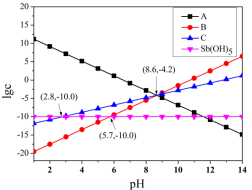
A.直线 代表的粒子为 代表的粒子为 |
B. 难溶物的 难溶物的 的数量级为 的数量级为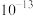 |
C. 的电离平衡常数的数值为 的电离平衡常数的数值为 |
D.溶液中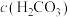 随着 随着 的增大而减小 的增大而减小 |
您最近一年使用:0次
2024-02-23更新
|
121次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2023-2024学年高二下学期第一次大练习化学试题
名校
4 . 常温下,向 和
和 的混合液中加入
的混合液中加入 固体(忽略溶液体积变化),
固体(忽略溶液体积变化), 与
与 的部分关系如图所示。已知:
的部分关系如图所示。已知: 代表
代表 或
或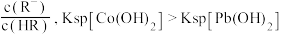 。下列叙述错误的是
。下列叙述错误的是
 和
和 的混合液中加入
的混合液中加入 固体(忽略溶液体积变化),
固体(忽略溶液体积变化), 与
与 的部分关系如图所示。已知:
的部分关系如图所示。已知: 代表
代表 或
或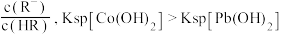 。下列叙述错误的是
。下列叙述错误的是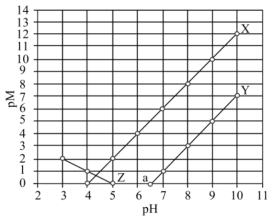
A. 代表 代表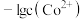 与 与 的关系 的关系 |
B.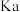 为弱酸 为弱酸 的电离常数,则常温下 的电离常数,则常温下 |
C.常温下, 和 和 共存时: 共存时: |
D.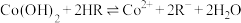 的平衡常数 的平衡常数 |
您最近一年使用:0次
2024-02-21更新
|
415次组卷
|
3卷引用:湖南省长沙市雅礼中学2023-2024学年高三下学期月考(七)化学试题
名校
5 . 根据下列实验操作和现象所得到的实验结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向 溶液中加入 溶液中加入 溶液,有白色沉淀生成 溶液,有白色沉淀生成 |  与 与 发生了双水解反应 发生了双水解反应 |
| B | 向NaOH固体中加入少量稀盐酸,测得温度高于室温 | 盐酸与NaOH反应为放热反应 |
| C | 室温下,测得相同浓度的NaX和NaY溶液的pH分别为8和9 | 酸性: |
| D | 向等浓度的NaCl、KI的混合溶液中滴加少量 溶液,得到黄色沉淀 溶液,得到黄色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-17更新
|
128次组卷
|
3卷引用:湖南省长沙麓山国际实验学校2023-2024学年高二下学期第一次学情检测化学试卷
6 . 工业上常用 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数 与
与 的关系如图所示。已知:
的关系如图所示。已知: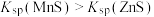 。下列说法错误的是
。下列说法错误的是
 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数 与
与 的关系如图所示。已知:
的关系如图所示。已知: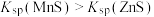 。下列说法错误的是
。下列说法错误的是
A.Ⅱ表示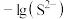 与 与 的关系曲线 的关系曲线 |
B. 点对应 点对应 的数量级为 的数量级为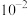 |
C.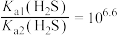 |
D.溶液中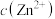 和 和 均为 均为 , , 完全沉淀时溶液的最小 完全沉淀时溶液的最小 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) |
您最近一年使用:0次
2024-02-06更新
|
271次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
7 . 分析化学中以K2CrO4为指示剂,用AgNO3标准溶液滴定溶液中的Cl-,测定c(Cl-)。
已知:ⅰ.K2CrO4溶液中存在平衡:2 +2H+
+2H+
 +H2O
+H2O
ⅱ.25 °C时,Ksp (Ag2CrO4)=2. 0×10-12 (砖红色),Ksp(AgCl)=1.8×10-10(白色),Ksp(Ag2Cr2O7)=2×10-7(深红色);
ⅲ.离子浓度≤10-5mol/L时,认为其完全沉淀。
下列分析不正确的是
已知:ⅰ.K2CrO4溶液中存在平衡:2
 +2H+
+2H+
 +H2O
+H2Oⅱ.25 °C时,Ksp (Ag2CrO4)=2. 0×10-12 (砖红色),Ksp(AgCl)=1.8×10-10(白色),Ksp(Ag2Cr2O7)=2×10-7(深红色);
ⅲ.离子浓度≤10-5mol/L时,认为其完全沉淀。
下列分析不正确的是
| A.实验中先产生白色沉淀,滴定终点时产生砖红色沉淀 |
B.产生白色沉淀时,存在AgCl(s) Ag+ (aq)+C1-(aq)。 Ag+ (aq)+C1-(aq)。 |
C.当产生砖红色沉淀时,如果c( )=5.0×10-3mol/L,则C1-已沉淀完全 )=5.0×10-3mol/L,则C1-已沉淀完全 |
| D.滴定时应控制溶液pH在合适范围内,若pH过低,会导致测定结果偏低 |
您最近一年使用:0次
2024-02-02更新
|
160次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题
名校
解题方法
8 . 水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图甲所示:
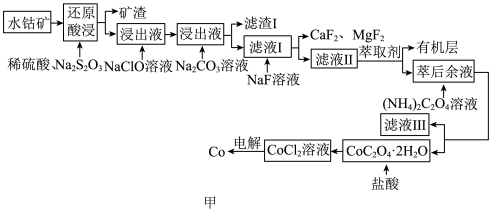
已知部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
请回答下列问题:
(1)基态Co原子的价层电子排布式为___________ 。
(2)“还原酸浸”中发生的氧化还原反应的化学方程式是___________ 。浸出液中加入NaClO溶液的目的:___________ (用离子方程式表示)。
(3)浸出过程中加入Na2CO3调pH的范围是___________ 。
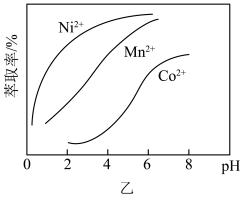
(4)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为___________(填标号)。
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(6)已知:Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10,加入NaF后,所得“滤液Ⅱ”中 =
=___________ 。

已知部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
| 沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)基态Co原子的价层电子排布式为
(2)“还原酸浸”中发生的氧化还原反应的化学方程式是
(3)浸出过程中加入Na2CO3调pH的范围是
(4)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为___________(填标号)。

| A.2~3 | B.3~4 | C.6~7 | D.7~8 |
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是
(6)已知:Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10,加入NaF后,所得“滤液Ⅱ”中
 =
=
您最近一年使用:0次
名校
解题方法
9 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属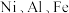 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体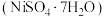 ;
;
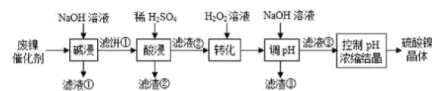
溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1)基态 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为___________ ,基态 原子价层电子排布式
原子价层电子排布式___________ 。
(2)“碱浸”中 有两个作用:除去
有两个作用:除去___________ 和溶解铝及其氧化物,写出 溶液溶解
溶液溶解 的离子方程式
的离子方程式___________ 。
(3)“转化”中可替代 的物质是
的物质是___________ 。若工艺流程改为先“调 ”后“转化”,即
”后“转化”,即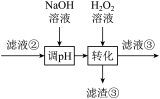 “滤液③”中可能含有的杂质离子为
“滤液③”中可能含有的杂质离子为___________ 。
(4)如果“转化”后的溶液中 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是___________ 。
(5)硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式___________ 。
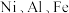 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体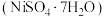 ;
;
溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 的 的 | 8.7 | 4.7 | 3.2 | 9.0 |
(1)基态
 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为 原子价层电子排布式
原子价层电子排布式(2)“碱浸”中
 有两个作用:除去
有两个作用:除去 溶液溶解
溶液溶解 的离子方程式
的离子方程式(3)“转化”中可替代
 的物质是
的物质是 ”后“转化”,即
”后“转化”,即 “滤液③”中可能含有的杂质离子为
“滤液③”中可能含有的杂质离子为(4)如果“转化”后的溶液中
 浓度为
浓度为 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(5)硫酸镍在强碱溶液中用
 氧化,可沉淀出能用作镍镉电池正极材料的
氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
10 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
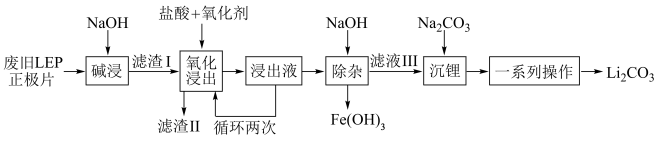
已知: 在水中的溶解度随温度升高而降低。
在水中的溶解度随温度升高而降低。
回答下列问题:
(1)旧电池拆解前进行放电处理有利于锂在正极的回收,其原因是___________ 。
(2)“碱浸”时,为加快浸出速率,可采取的措施是___________ (答出一点即可)。
(3)“氧化浸出”时,实际生产中氧化剂选用 ,不选用
,不选用 的原因是
的原因是___________ 。“氧化浸出”时生成了难溶的 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4)“沉锂”过程中使用水浴加热保持温度在95℃,“一系列操作”具体包括___________ 、___________ 、干燥。
(5)滤液Ⅲ中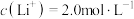 ,“沉锂”结束时溶液中
,“沉锂”结束时溶液中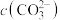 为
为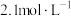 ,则“沉锂”过程中,锂的沉降率为
,则“沉锂”过程中,锂的沉降率为___________ %[已知:浸出液在沉锂过程中溶液体积不变,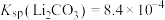 ]。
]。
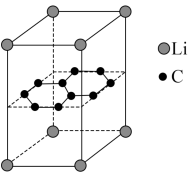
(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间形成的,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为___________ ,该晶体中最近的两个碳原子核间距离为apm,石墨烯层间距离为bpm,则该晶体的密度为___________  (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
已知:
 在水中的溶解度随温度升高而降低。
在水中的溶解度随温度升高而降低。回答下列问题:
(1)旧电池拆解前进行放电处理有利于锂在正极的回收,其原因是
(2)“碱浸”时,为加快浸出速率,可采取的措施是
(3)“氧化浸出”时,实际生产中氧化剂选用
 ,不选用
,不选用 的原因是
的原因是 ,该反应的离子方程式为
,该反应的离子方程式为(4)“沉锂”过程中使用水浴加热保持温度在95℃,“一系列操作”具体包括
(5)滤液Ⅲ中
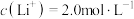 ,“沉锂”结束时溶液中
,“沉锂”结束时溶液中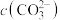 为
为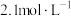 ,则“沉锂”过程中,锂的沉降率为
,则“沉锂”过程中,锂的沉降率为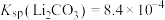 ]。
]。(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间形成的,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为
 (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次







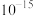

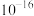
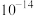
 /%
/% /%
/% /%
/%

