1 . 已知草酸为二元弱酸:H2C2O4
 +H+ , Ka1,
+H+ , Ka1,

 +H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中
+H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中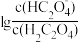 或
或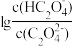 与混合溶液pH关系如图所示。
与混合溶液pH关系如图所示。
(1)常温下,草酸的电离常数Ka1=__________ ,Ka2=__________ 。
(2)如果所得溶液溶质为KHC2O4,则该溶液显________ (填“酸性”“碱性”或“中性”)。
(3)如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为__________ 。
(4)a、b、c三点,水的电离程度的变化趋势是___________ 。
(5)已知电离度 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,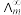 为无限稀释时溶液的摩尔电导率。T=298K,
为无限稀释时溶液的摩尔电导率。T=298K, 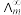 =0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的
=0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的 = 0.002 S·m2·mol-1。
= 0.002 S·m2·mol-1。
①该条件下测定的0.01mol/L乙酸中的c(H+)为_________ mol/L。
②已知摩尔电导率越大,溶液的导电性越好。在298K时,几种离子的摩尔电导率如表所示。在做水的电解实验时,为了增强水溶液的导电性,向水中加入一种盐,请从下表中选择最适宜的盐_______ (填化学式)。

 +H+ , Ka1,
+H+ , Ka1,

 +H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中
+H+ ,Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,草酸溶液中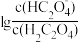 或
或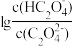 与混合溶液pH关系如图所示。
与混合溶液pH关系如图所示。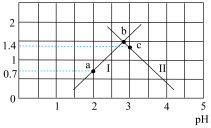
(1)常温下,草酸的电离常数Ka1=
(2)如果所得溶液溶质为KHC2O4,则该溶液显
(3)如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为
(4)a、b、c三点,水的电离程度的变化趋势是
(5)已知电离度
 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,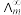 为无限稀释时溶液的摩尔电导率。T=298K,
为无限稀释时溶液的摩尔电导率。T=298K, 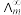 =0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的
=0.040S·m2·mol-1,实验测得,0.01mol/L乙酸的 = 0.002 S·m2·mol-1。
= 0.002 S·m2·mol-1。①该条件下测定的0.01mol/L乙酸中的c(H+)为
②已知摩尔电导率越大,溶液的导电性越好。在298K时,几种离子的摩尔电导率如表所示。在做水的电解实验时,为了增强水溶液的导电性,向水中加入一种盐,请从下表中选择最适宜的盐
| 离子种类 |  | Cl- | CH3COO- | K+ | Na+ |
| 摩尔电导率/(10-4 S·m2·mol-1) . | 79.8 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
2023-12-03更新
|
184次组卷
|
3卷引用:山东省菏泽市2023-2024学年高二上学期11月期中化学试题
名校
解题方法
2 . 已知某温度下,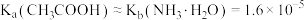 ,向10
,向10 浓度均为0.01
浓度均为0.01 的盐酸和醋酸的混合溶液中逐滴加入0.01
的盐酸和醋酸的混合溶液中逐滴加入0.01 的氨水,测定反应过程中的电导率和
的氨水,测定反应过程中的电导率和 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是
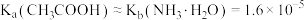 ,向10
,向10 浓度均为0.01
浓度均为0.01 的盐酸和醋酸的混合溶液中逐滴加入0.01
的盐酸和醋酸的混合溶液中逐滴加入0.01 的氨水,测定反应过程中的电导率和
的氨水,测定反应过程中的电导率和 的变化曲线如图所示。下列说法正确的是
的变化曲线如图所示。下列说法正确的是
A.a点溶液中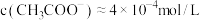 |
B.b点溶液中: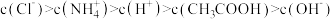 |
| C.d点溶液中:原混合溶液与氨水恰好完全反应 |
| D.a、b、c、d四点对应的溶液中,水的电离程度最大的是c |
您最近一年使用:0次
2022-11-11更新
|
444次组卷
|
2卷引用:山东省菏泽市郓城第一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
3 . 已知水的电离平衡曲线如图所示:
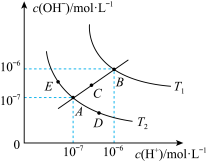
试回答下列问题:
(1)图中
_______  (用“>”、“<”、“=”回答)
(用“>”、“<”、“=”回答)
(2)图中五点的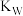 间的关系是
间的关系是_______ 。
(3)若从A点到E点,可采用的措施是_______ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH溶液
(4)点E对应的温度下,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为_______ 。
(5)点B对应的温度下,若100体积 的某强酸溶液与1体积
的某强酸溶液与1体积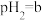 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的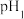 与强碱的
与强碱的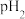 之间应满足的关系是
之间应满足的关系是_______ 。
(6)写出用pH试纸测溶液pH的操作_______ 。

试回答下列问题:
(1)图中

 (用“>”、“<”、“=”回答)
(用“>”、“<”、“=”回答)(2)图中五点的
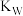 间的关系是
间的关系是(3)若从A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH溶液
(4)点E对应的温度下,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(5)点B对应的温度下,若100体积
 的某强酸溶液与1体积
的某强酸溶液与1体积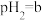 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的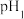 与强碱的
与强碱的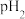 之间应满足的关系是
之间应满足的关系是(6)写出用pH试纸测溶液pH的操作
您最近一年使用:0次
2022-11-10更新
|
385次组卷
|
3卷引用:山东省菏泽市2022-2023学年高二上学期期中考试(B)化学试题
名校
解题方法
4 . 现有下列物质:①熔融的NaCl ②稀硫酸 ③液氯 ④冰醋酸 ⑤铜 ⑥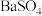 ⑦
⑦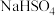 ⑧液氨 ⑨
⑧液氨 ⑨ ⑩
⑩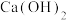 固体
固体
请按要求回答下列问题。
(1)以上物质中属于弱电解质的是_______ (填数字序号,下同);属于非电解质的是_______ 。
(2)可以证明醋酸是弱酸的事实是_______ (填字母序号)
a.醋酸和水能以任意比例混溶
b.在醋酸水溶液中还含有未电离的醋酸分子
c.醋酸与 溶液反应放出
溶液反应放出 气体
气体
d.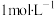 的醋酸水溶液能使紫色石蕊溶液变红色
的醋酸水溶液能使紫色石蕊溶液变红色
e.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(3)某温度时,某水溶液中的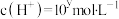 ,
, ,x和y的关系如图所示:
,x和y的关系如图所示: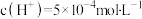 ,则由水电离产生的
,则由水电离产生的
_______  。
。
②该温度下,将pH=a的 溶液
溶液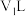 与
与 的
的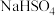 溶液
溶液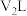 混合(忽略体积变化)。若所得混合溶液呈中性,且a=12,b=3,则
混合(忽略体积变化)。若所得混合溶液呈中性,且a=12,b=3,则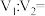
_______ ;若溶液混合后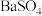 恰好沉淀完全,且a=12,b=3,则混合后溶液的pH为
恰好沉淀完全,且a=12,b=3,则混合后溶液的pH为_______ 。(已知lg3≈0.5)
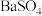 ⑦
⑦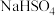 ⑧液氨 ⑨
⑧液氨 ⑨ ⑩
⑩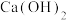 固体
固体请按要求回答下列问题。
(1)以上物质中属于弱电解质的是
(2)可以证明醋酸是弱酸的事实是
a.醋酸和水能以任意比例混溶
b.在醋酸水溶液中还含有未电离的醋酸分子
c.醋酸与
 溶液反应放出
溶液反应放出 气体
气体d.
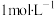 的醋酸水溶液能使紫色石蕊溶液变红色
的醋酸水溶液能使紫色石蕊溶液变红色e.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(3)某温度时,某水溶液中的
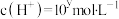 ,
, ,x和y的关系如图所示:
,x和y的关系如图所示: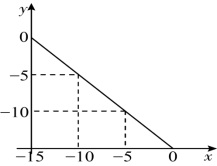
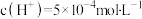 ,则由水电离产生的
,则由水电离产生的
 。
。②该温度下,将pH=a的
 溶液
溶液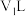 与
与 的
的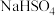 溶液
溶液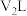 混合(忽略体积变化)。若所得混合溶液呈中性,且a=12,b=3,则
混合(忽略体积变化)。若所得混合溶液呈中性,且a=12,b=3,则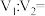
 恰好沉淀完全,且a=12,b=3,则混合后溶液的pH为
恰好沉淀完全,且a=12,b=3,则混合后溶液的pH为
您最近一年使用:0次
名校
解题方法
5 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol•L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH- |
B. =10-12的溶液中:Na+、NO =10-12的溶液中:Na+、NO 、[Al(OH)4]-、CO 、[Al(OH)4]-、CO |
C.水电离的c(H+)=1×10-13mol•L-1溶液中:Na+、K+、NO 、HCO 、HCO |
D.0.1mol•L-1的FeCl3溶液中:K+、Mg2+、SO 、SCN- 、SCN- |
您最近一年使用:0次
解题方法
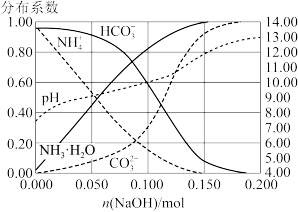
6 . 室温下,向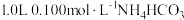 溶液中加入
溶液中加入 稀溶液,溶液中主要微粒的分布系数【如
稀溶液,溶液中主要微粒的分布系数【如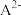 的分布系数
的分布系数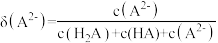 】以及
】以及 随
随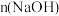 变化如图。
变化如图。
下列叙述错误的是
 溶液中加入
溶液中加入 稀溶液,溶液中主要微粒的分布系数【如
稀溶液,溶液中主要微粒的分布系数【如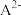 的分布系数
的分布系数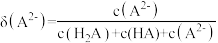 】以及
】以及 随
随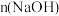 变化如图。
变化如图。
下列叙述错误的是
A.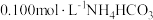 溶液中 溶液中 ,水电离受到促进 ,水电离受到促进 |
B.加入 稀溶液过程中,溶液满足关系式 稀溶液过程中,溶液满足关系式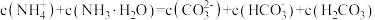 |
C.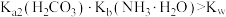 |
D.加入少量 时, 时, 先与 先与 发生主要反应 发生主要反应 |
您最近一年使用:0次
名校
7 . 常温下,向20mL0.2mol/LH2X溶液中滴加0.2mol/LNaOH溶液,溶液中各微粒的物质的量分数随pH的变化如图所示,以下说法不正确的是

| A.由图可推测,H2X为弱酸 |
| B.滴加过程中发生的反应有:H2X+OH-=HX-+H2O,HX-+OH-=X2-+H2O |
| C.水的电离程度:a点与b点大致相等 |
| D.若常温下Ka(HY)=1.1×10-2,HY与少量Na2X发生的反应是:2HY+X2-=H2X+2Y- |
您最近一年使用:0次
2022-05-06更新
|
867次组卷
|
12卷引用:山东省青岛市莱西市2022-2023学年高二上学期12月期末考试化学试题
山东省青岛市莱西市2022-2023学年高二上学期12月期末考试化学试题北京市昌平区2022届高三二模化学试题北京市育才学校2022届高三下学期三模化学试题(已下线)专题13 水溶液中的离子平衡-备战2023年高考化学母题题源解密(全国通用)湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题黑龙江省哈尔滨市实验中学2022-2023学年高三上学期期中考试化学试题黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期期末考试化学试卷天津市重点校2023-2024学年高二上学期期末考试化学试题湖北省沙市中学2023-2024学年高二上学期1月期末化学试题黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学验收考试化学黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学化学试题天津市2023-2024学年高二上学期重点校联考化学试题
名校
解题方法
8 . 常温下,浓度相同的一元弱酸 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是
 稀溶液和一元弱碱
稀溶液和一元弱碱 稀溶液互相滴定,溶液中
稀溶液互相滴定,溶液中 与
与 或
或 的关系如图所示。已知
的关系如图所示。已知 和
和 的电离常数为
的电离常数为 和
和 ,且b和b′点的纵坐标之和为14。下列说法错误的是
,且b和b′点的纵坐标之和为14。下列说法错误的是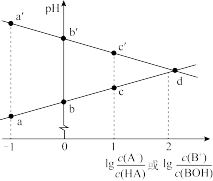
A.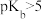 | B.a和a′点的纵坐标之和为14 |
C.水的电离程度: | D.溶液中的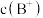 :c点大于c′点 :c点大于c′点 |
您最近一年使用:0次
2022-05-05更新
|
687次组卷
|
4卷引用:山东省济南市2022届高三第二次模拟化学试题
9 . 室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
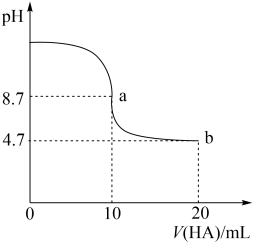
| A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
| B.a、b两点所示溶液中水的电离程度相同 |
| C.pH=7时,c(Na+)=c(A-)+c(HA) |
| D.b点所示溶液中c(A-)>c(HA) |
您最近一年使用:0次
2022-03-22更新
|
3145次组卷
|
82卷引用:2015年全国普通高等学校招生统一考试化学(山东卷)
2015年全国普通高等学校招生统一考试化学(山东卷)山东省曲阜师范大学附属中学2017-2018学年高二上学期期中考试化学试题山东省济南市第一中学2017-2018学年高二上学期期末考试化学试题山东省临沂市第十九中学2017-2018学年高二下学期开学考试化学试题2018-2019学年鲁科版高中化学选修四:第3章检测题山东省济南外国语学校三箭分校2020届高三上学期期中检测化学试题2016届河南省濮阳市油田教育中心高三上第一次市统摸底化学试卷2016届浙江省舟山中学高三上学期期中考试化学试卷2015-2016学年湖南省浏阳一中高二上第三次月考化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2015-2016学年内蒙古赤峰二中高二上学期期末化学试卷2015-2016学年安徽省安庆市怀宁县高河中学高二上期末化学试卷2015-2016学年湖南师大附中高二下入学考试化学试卷2016届山西省平遥中学高三第二轮训练三化学试卷2015-2016学年青海师大附二中高二下期中化学试卷2017届河北省衡水中学高三上学期摸底考试化学试卷2016-2017学年辽宁省沈阳铁路中学高二上第一次月考化学试卷2016-2017学年浙江省诸暨中学高二上期中化学试卷2016-2017学年河北省张家口一中高二12月月考化学卷2016-2017学年陕西省宝鸡中学高二上期中化学卷2016-2017学年江西省南昌市第二中学高二上学期期末考试化学试卷2016-2017学年四川省双流中学高二下学期期中考试化学试卷2018版化学(苏教版)高考总复习专题八对接高考精练--水的电离和溶液的酸碱性辽宁省庄河市高级中学2018届高三上学期开学考试化学试题湖北省沙市中学2017-2018学年高二上学期第四次双周考试化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期期中考试化学(重点、平行班)试题福建省宁德市2017-2018学年高二上学期期末模拟质量检测化学试题北京市西城区重点中学2018届高三上学期期末复习检验化学试题甘肃省兰州市第四中学2017-2018学年高二上学期期末考试化学试题广东省中山市2017-2018学年高二上学期期末考试化学试题黑龙江省大庆铁人中学2017-2018学年高二下学期开学考试(3月)化学试题湖南省师范大学附属中学2016-2017学年高二(理科)上学期期末考试化学试题陕西省榆林市第二中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区石河子二中2018-2019学年高二上学期第二次月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期末考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高二下学期开学考试化学试题甘肃省靖远四中2018-2019学年高二第二学期开学检测化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高二(理)下学期寒假学情检测化学试题宁夏回族自治区宁夏大学附属中学2019届高三上学期第六次月考理科综合化学试题湖北省黄梅国际育才高级中学2018-2019学年高二下学期期中考试化学试题福建省长乐高级中学2018-2019学年高二下学期期末考试化学试题百所名校联考-水溶液中的离子平衡广东省中山市第一中学2019-2020学年高二上学期第二次段考化学试题广东省湛江第一中学2019-2020学年高二12月月考化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——水的电离及溶液的酸碱性(提升练习)备考突破2020高三化学专题强化集训——电解质溶液中的曲线问题湖南省长沙市天心区长郡中学2019—2020学年高二上学期期末考试化学试题上海市六校联考2016届高考模拟试卷(3月份)化学试题上海市六校2016届高三3月综合素养调考化学试题天津市南开翔宇学校2020届高三下学期线上测试化学试题广东省深圳市红岭中学2019-2020学年高二下学期第一次在线考试化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训海南省海南枫叶国际学校2019-2020学年高二上学期期末考试化学试题甘肃省兰州市第十中学、民族中学2019-2020学年高二上学期期末考试化学试题湖南省衡阳市第八中学2019-2020学年高二下学期期中考试化学试题安徽省合肥市庐江县2019-2020学年高二下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 作业帮(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题福建师范大学第二附属中学2019-2020学年高二上学期期末考试化学试题天津市耀华中学2020-2021学年高二上学期第二次段考化学试题黑龙江省鸡东二中2020-2021学年高二上学期期末考试化学试题湖南省常德市芷兰实验中学2020-2021学年高二下学期第一次月考化学试题天津市实验中学滨海学校黄南民族班2020-2021学年高二下学期期中化学试题福建省仙游一中、莆田二中、莆田四中2020-2021学年高二上学期期末联考化学试题安徽省合肥市六校2020-2021学年高二下学期期末联考化学试题河南省南阳市第一中学校2021-2022学年高二上学期第三次月考化学试题广东省湛江市第二十一中学2021-2022学年高二上学期期中考试化学试题内蒙古呼和浩特市2021-2022学年高二上学期期末考试化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题江苏省灌云高级中学2021-2022学年高二上学期12月阶段考试化学试题四川省绵阳市盐亭中学2021-2022学年高二下学期4月月考化学试题四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题天津市河东区2021-2022学年高二上学期期末质量检测化学试题河北省唐山市开滦第一中学2020-2021学年高二上学期期末考试化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)河南省开封高级中学2023-2024学年高三上学期第一次质量检测化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期8月月考化学试题云南省昆明市第一中学2023-2024学年高二上学期12月月考化学试题山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷上海市华东师范大学第二附属中学(紫竹校区)2023-2024学年高三下学期三模考试 化学试题专题8 水溶液中的离子反应与平衡-水的电离和溶液酸碱性
解题方法
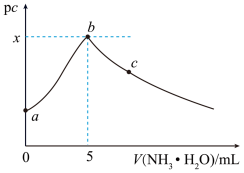
10 . 常温下,向 一定浓度的硫酸铜溶液中逐滴滴入
一定浓度的硫酸铜溶液中逐滴滴入 的氨水,首先析出浅蓝色的
的氨水,首先析出浅蓝色的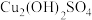 沉淀,氨水过量时此沉淀溶解,形成
沉淀,氨水过量时此沉淀溶解,形成 络离子(假定溶液混合后体积不变)。滴加过程中
络离子(假定溶液混合后体积不变)。滴加过程中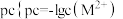 ,
, 为
为 或
或 与氨水体积的关系如图所示。下列说法错误的是
与氨水体积的关系如图所示。下列说法错误的是
 一定浓度的硫酸铜溶液中逐滴滴入
一定浓度的硫酸铜溶液中逐滴滴入 的氨水,首先析出浅蓝色的
的氨水,首先析出浅蓝色的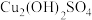 沉淀,氨水过量时此沉淀溶解,形成
沉淀,氨水过量时此沉淀溶解,形成 络离子(假定溶液混合后体积不变)。滴加过程中
络离子(假定溶液混合后体积不变)。滴加过程中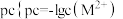 ,
, 为
为 或
或 与氨水体积的关系如图所示。下列说法错误的是
与氨水体积的关系如图所示。下列说法错误的是
A.硫酸铜溶液的浓度为 |
B.常温下, 点溶液中水的电离程度低于纯水的 点溶液中水的电离程度低于纯水的 |
C. 点溶液中存在 点溶液中存在 |
D.常温下,忽略 的影响,可得 的影响,可得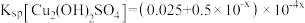 |
您最近一年使用:0次



