1 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的_____(填字母)。
(2)下图为原电池装置示意图:
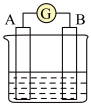
①若A为 片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:
片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:_____ ,反应过程中溶液的酸性_____ (填“增强”、“减弱”或“不变”)。一段时间后,当电池中放出2.24L(标准状况)气体时,电路中有_____ 个电子通过了导线(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
②若A为镁片,B为铝片,电解质为 溶液,则铝片为
溶液,则铝片为_____ (填“正极”或“负极”);写出该电极的电极反应式:_____ 。
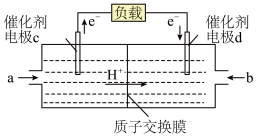
(3)燃料电池是一种具有应用前景的绿色电源, 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是_____ (填“正极”或“负极”),则该燃料电池如下:
(4)为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的_____(填字母)。
A. |
B.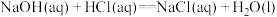 |
C.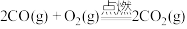 |
D.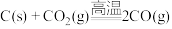 |

①若A为
 片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:
片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式: 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。②若A为镁片,B为铝片,电解质为
 溶液,则铝片为
溶液,则铝片为(3)燃料电池是一种具有应用前景的绿色电源,
 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是
(4)为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
| 方案 | 现象或产物 |
A.将铁片置于 溶液中 溶液中 | 铁片上有亮红色物质析出 |
| B.将铁丝和铜丝分别在氯气燃烧 | 产物分别为 和 和 |
| C.将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| D.将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连 | 铁片溶解,铜片上有气泡产生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . Ⅰ.某实验小组同学进行如图1实验,以检验化学反应中的能量变化。请回答下列问题:
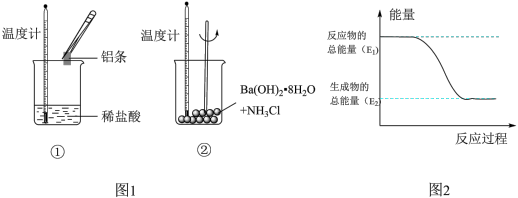
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是________ 热反应。反应过程________ (填“①”或“②”)的能量变化可用图2表示。
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
(2)根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向________ 极(填“A”或“B”)。
②装置乙中正极的电极反应式为________ 。
③装置丙中溶液的pH________ (填“变大”“变小”或“不变”)。
④四种金属活动性由强到弱的顺序是________ 。
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是________ 。
A.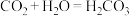 B.
B.
C. D.
D.

(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 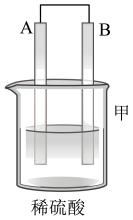 | 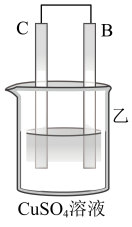 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属活动性由强到弱的顺序是
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
解题方法
3 . 利用所学电化学反应原理,解决以下问题:
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
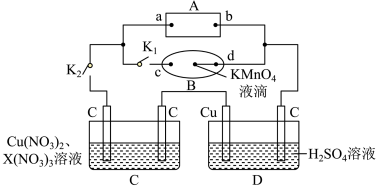
(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为___________ 极,若c、d为惰性电极,检验c端产物的方法为___________ 。滤纸中央KMnO4溶液处发生的现象为___________ 。
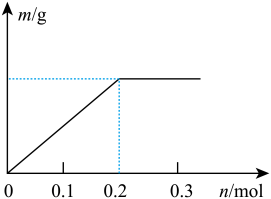
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是___________ 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是___________ 。
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :
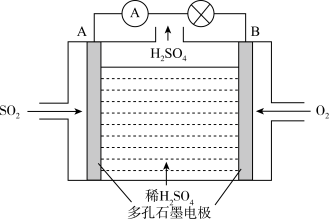
(4)电解质溶液中 离子向
离子向___________ (填“A极”或“B极” )移动。
(5)请写出负极电极反应式___________ 。
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为___________ 。
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。

(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是

(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

(4)电解质溶液中
 离子向
离子向(5)请写出负极电极反应式
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为
您最近一年使用:0次
2023-07-25更新
|
89次组卷
|
2卷引用:甘肃省平凉市2022-2023学年高三上学期11月期中化学试题
4 . 下列有关实验操作、现象和所得结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向2mL0.1mol/LNaCl溶液中加入过量的 溶液后,再加1mL0.1mol/LNaI,出现黄色沉淀。 溶液后,再加1mL0.1mol/LNaI,出现黄色沉淀。 | Ksp(AgCl)>Ksp(AgI) |
| B | 将镁片和铝片用导线连接后插入NaOH溶液中,镁片表面产生气泡 | 该装置构成了原电池,铝片做负极。 |
| C | 向某溶液中加入稀NaOH溶液,用湿润的红色石蕊试纸检验,无明显现象 | 溶液中一定无 |
| D | 向 溶液中通入 溶液中通入 和X气体,产生白色沉淀 和X气体,产生白色沉淀 | 气体X一定具有强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 电能是现代社会应用最广泛的能源之一。
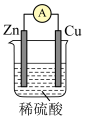
(1)某原电池装置如图所示。其中, 电极为原电池的
电极为原电池的_____ 极(填“正”或“负”),电解质溶液中的阴离子向_____ 极(填“铜”或“锌”)移动,铜极上的现象_____ 。
(2) 电极的电极反应式是
电极的电极反应式是_____ 。
(3) 电极上发生的反应属于
电极上发生的反应属于_____ (填“氧化”或“还原”)反应。
(4)当铜表面析出 氢气(标准状况)时,导线中通过了
氢气(标准状况)时,导线中通过了_____  电子。
电子。
(5)下列反应通过原电池装置,不能实现化学能直接转化为电能的是_____ (填序号)。
①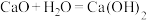 ②
② ③
③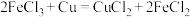

(1)某原电池装置如图所示。其中,
 电极为原电池的
电极为原电池的(2)
 电极的电极反应式是
电极的电极反应式是(3)
 电极上发生的反应属于
电极上发生的反应属于(4)当铜表面析出
 氢气(标准状况)时,导线中通过了
氢气(标准状况)时,导线中通过了 电子。
电子。(5)下列反应通过原电池装置,不能实现化学能直接转化为电能的是
①
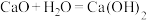 ②
② ③
③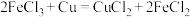
您最近一年使用:0次
6 . A、B、C、D四种金属按下表中装置进行实验,下列说法不正确的是
装置 | 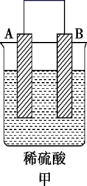 | 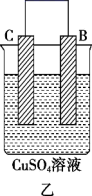 | 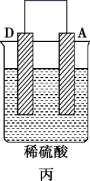 |
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
| A.装置甲溶液中的阴离子移向B极 |
B.装置乙中C极的电极反应式为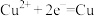 |
| C.装置丙中电流由A→导线→D→电解质溶液→A |
| D.四种金属活动性由强到弱的顺序是D>A>B>C |
您最近一年使用:0次
名校
解题方法
7 . 某小组同学实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:_______ 。
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为_______ 。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(2)采用电化学装置进行验证。
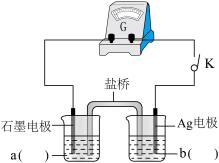
小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为_______ 溶液;b为_______ 溶液;(写a、b化学式)
ii.再向左侧烧杯中滴加较浓的_______ 溶液,产生的现象为_______ 。表明“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为
综合上述实验,证实“Ag++Fe2+
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(2)采用电化学装置进行验证。

小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为
ii.再向左侧烧杯中滴加较浓的
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
您最近一年使用:0次
2023-08-20更新
|
204次组卷
|
2卷引用:福建省福州市八县(市)一中2022-2023学年高二上学期11月期中联考化学试题
名校
8 . I.如图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
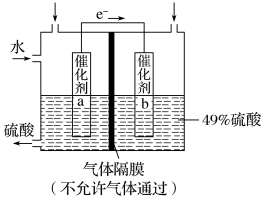
请回答下列问题:
(1)该装置将_______ 能转化为______ 能。
(2)催化剂b表面O2发生_______ 反应,其附近溶液酸性______ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_______ 。
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是______ 。
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是______ 。
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由______ 。
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为______ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为
您最近一年使用:0次
2023-05-19更新
|
702次组卷
|
2卷引用:贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题
解题方法
9 . 在通风橱中进行下列实验:
下列说法不正确的是
| 步骤 | 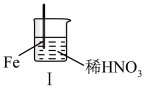 | 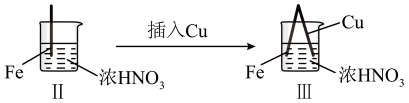 | |
| 现象 | Fe表面产生大量无色气泡,液面上方由无色变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
A.Ⅰ中发生反应的化学方程式: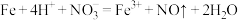 |
| B.将Ⅱ中的铁棒换成铝棒,现象几乎相同 |
| C.对比Ⅰ、Ⅱ中现象,说明物质的浓度不同,其化学性质可能不同 |
D.Ⅲ装置可形成原电池,其中铁为负极,反应式为 |
您最近一年使用:0次
10 . 电化学知识在生活中应用广泛,但形成原电池和电解池均需要一定的条件。
(1)现有下列装置:

其中,能构成原电池的是______ (填字母代号),能构成电解池的是______ (填字母代号)。
(2)下列化学方程式正确且能设计成原电池的有______(填字母代号)。
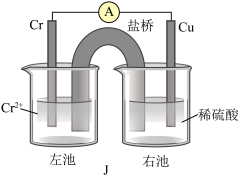
(3)已知Cr比Fe的金属性稍活泼,铜铬构成原电池如装置J所示(盐桥中装的是饱和KCl琼脂溶液)。
则Cr为______ 极(填“正”或“负”),盐桥中 移向
移向______ (填“左池”或“右池”),盛稀硫酸烧杯中的现象为______ 。
(4)甲、乙两同学利用原电池反应检测金属的活动性顺序,设计如下实验装置。
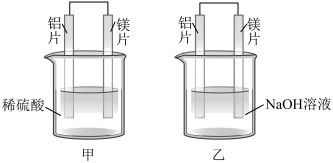
甲装置用______ (填“铝片”或“镁片”)作负极,两同学实验现象的不同之处为______ ,由此得出不能简单根据金属的活动性来判断原电池的正负极的结论,正确的判断方法是______ 。
(1)现有下列装置:

其中,能构成原电池的是
(2)下列化学方程式正确且能设计成原电池的有______(填字母代号)。
A. |
B.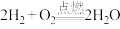 |
C.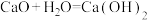 |
D. |
则Cr为
 移向
移向
(4)甲、乙两同学利用原电池反应检测金属的活动性顺序,设计如下实验装置。

甲装置用
您最近一年使用:0次



