名校
解题方法
1 . 由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是
| 实验装置 | 甲 | 乙 | 丙 |
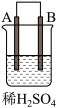 | 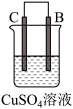 | 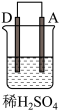 | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A.装置甲中的B金属是原电池的负极 | B.装置乙中电流的流向为B→C |
C.装置丙中溶液里的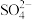 移向A 移向A | D.四种金属的活泼性顺序是D>A>B>C |
您最近一年使用:0次
2 . 回答下列问题
(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知该反应为放热反应,能正确表示该反应中能量变化的是图_______ (填“a”或“b”)。
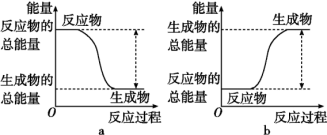
从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示:
则生成1 mol H2O(g)可以放出热量_______ kJ。
(2)下列反应中,属于放热反应的是_______(填字母,下同) 。
(3)A、B、C、D 四种金属按表中装置进行实验。
根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向_______ (填“A”或“B”)极。
②装置乙中正极的电极反应式为_______ 。
③四种金属活动性由强到弱的顺序是_______ 。
(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)=2H2O(g)。已知该反应为放热反应,能正确表示该反应中能量变化的是图

从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示:
| 化学键 | H-H | O=O | H-O |
| 键能/(kJ·mol-1) | 436 | 496 | 463 |
则生成1 mol H2O(g)可以放出热量
(2)下列反应中,属于放热反应的是_______(填字母,下同) 。
| A.盐酸与烧碱溶液反应 |
| B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑ |
| C.氢气在氧气中燃烧生成水 |
| D.高温煅烧石灰石使其分解 |
| 装置 | 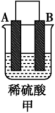 |  | 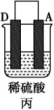 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③四种金属活动性由强到弱的顺序是
您最近一年使用:0次
解题方法
3 . 如图是原电池电解池的组合装置图。
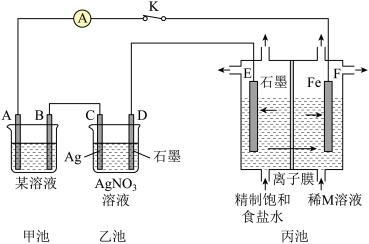
请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为Fe,B为碳棒。则:
①甲池为_______ (填“原电池”或“电解池”);B电极上发生的现象为_______ 。
②乙池中的银电极上的电极反应式为_______ 。
③闭合K一段时间后,稀M溶液的浓度会增加,则M溶液中的溶质是_______ (填化学式);丙池中的离子膜为_______ (填“阳离子交换膜”或“阴离子交换膜”)
(2)若将甲池的某溶液改为FeCl3,电极材料A为Cu、B为碳棒,则甲池的总反应的离子方程式为_______ 。

请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为Fe,B为碳棒。则:
①甲池为
②乙池中的银电极上的电极反应式为
③闭合K一段时间后,稀M溶液的浓度会增加,则M溶液中的溶质是
(2)若将甲池的某溶液改为FeCl3,电极材料A为Cu、B为碳棒,则甲池的总反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 某小组同学为探究 和
和 反应的程度,进行以下实验。已知:相关物质的
反应的程度,进行以下实验。已知:相关物质的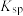 (25℃) AgCl:
(25℃) AgCl: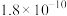
 :
:
(1)甲同学的实验如下:
注:经检验黑色固体为Ag。
①白色沉淀的化学式是___________ 。
②甲同学得出 氧化了
氧化了 的依据是
的依据是___________ 。
(2)乙同学为探究 和
和 反应的程度,进行实验Ⅱ。
反应的程度,进行实验Ⅱ。
a.按下图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。
偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
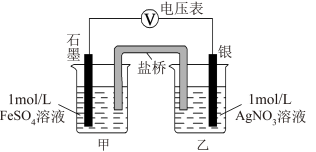
①a中甲烧杯里的电极反应式是___________ 。
②b中电压表指逆向偏移后,银为极___________ (填“正”或“负”)。
③由实验得出 和
和 反应的离子方程式是
反应的离子方程式是___________ 。
 和
和 反应的程度,进行以下实验。已知:相关物质的
反应的程度,进行以下实验。已知:相关物质的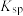 (25℃) AgCl:
(25℃) AgCl: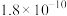
 :
:
(1)甲同学的实验如下:
序号 | 操作 | 现象 |
实验1 | 将2mL | 产生白色沉淀,随后有黑色固体产生 |
取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是
②甲同学得出
 氧化了
氧化了 的依据是
的依据是(2)乙同学为探究
 和
和 反应的程度,进行实验Ⅱ。
反应的程度,进行实验Ⅱ。a.按下图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。
偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓
 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①a中甲烧杯里的电极反应式是
②b中电压表指逆向偏移后,银为极
③由实验得出
 和
和 反应的离子方程式是
反应的离子方程式是
您最近一年使用:0次
2022-12-04更新
|
130次组卷
|
2卷引用:广东省江门市第一中学2022-2023学年高二上学期第二次月考化学试题
解题方法
5 . 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀。下列说法错误的是
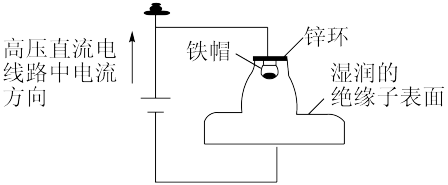

A.断电时,锌环上的电极反应为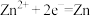 |
| B.断电时,仍能防止铁帽被腐蚀 |
| C.通电时,锌环是阳极,发生氧化反应 |
| D.通电时,该装置为外加电流的阴极保护法 |
您最近一年使用:0次
名校
解题方法
6 . 原电池是直接把化学能转化为电能的装置。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)___________ ;稀硫酸的作用是___________ 。
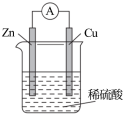
a.负极反应物 b.负极材料 c.正极反应物 d.正极材料 e.离子导体 f.电子导体
(2)在Cu-Zn原电池中,能证明化学能转化为电能的实验现象为___________ 。
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是___________。
(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将___________ ,并通过能导电的物质形成闭合回路,产生电流。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)

a.负极反应物 b.负极材料 c.正极反应物 d.正极材料 e.离子导体 f.电子导体
(2)在Cu-Zn原电池中,能证明化学能转化为电能的实验现象为
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是___________。
A.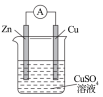 | B.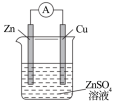 | C.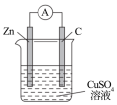 | D.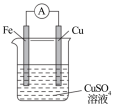 |
您最近一年使用:0次
解题方法
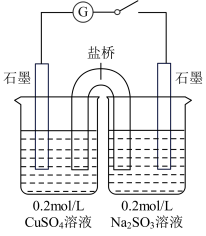
7 . 某实验小组为探究CuSO4与Na2SO3反应后的产物,做如下探究实验。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为_______ 。N、O、S三种元素原子的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:_______ 。
(3)经检验,实验2所得溶液中有大量 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现_______ 性,写出该实验中反应的离子方程式:_______ 。
(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做_______ (填“正”或“负”)极,右侧烧杯中发生反应的电极反应式为_______ 。设计实验检验右侧烧杯中生成的阴离子,写出具体操作、现象和结论:_______ 。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:
(3)经检验,实验2所得溶液中有大量
 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做

您最近一年使用:0次
8 . 下列实验操作、对应的现象及结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | 酸性:苯酚>碳酸 |
| B | 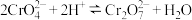 溶液中加入少量 溶液中加入少量 溶液,有砖红色沉淀( 溶液,有砖红色沉淀( )生成 )生成 | 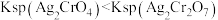 |
| C | 将镁片和铝片用导线连接后插入NaOH溶液中,镁片表面产生气泡 | 该装置构成了原电池,铝片做负极 |
| D | 向某溶液中加入稀NaOH溶液,用湿润的红色石蕊试纸检验,无明显现象 | 溶液中一定无 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_______(填字母)。
(2)下图为原电池装置示意图:
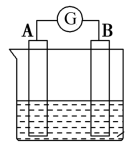
①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式:_______ ,反应过程中溶液的酸性_______ (填“增强”、“减弱”或“不变”)。一段时间后,当电池中放出1.68 L(标准状况)气体时,电路中有_______ 个电子通过了导线(用NA表示阿伏加德罗常数的值)。
②若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为_______ (填“正极”或“负极”);写出该电极的电极反应式:_______ 。
③燃料电池是一种具有应用前景的绿色电源, 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是_______ (填“正极”或“负极”),若线路中转移2 mol电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为_______ L。

④为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是_______ (填序号)。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_______(填字母)。
A. | B. |
C. | D. |

①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式:
②若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为
③燃料电池是一种具有应用前景的绿色电源,
 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是 在标准状况下的体积为
在标准状况下的体积为
④为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
| 方案 | 现象或产物 |
A.将铁片置于 溶液中 溶液中 | 铁片上有亮红色物质析出 |
| B.将铁丝和铜丝分别在氯气燃烧 | 产物分别为 和 和 |
| C.将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| D.将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连 | 铁片溶解,铜片上有气泡产生 |
您最近一年使用:0次
解题方法
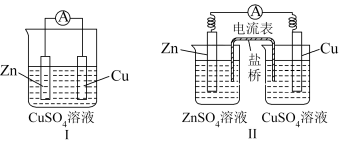
10 . 实验探究:铜锌原电池的构造与工作原理
(1)实验装置示意图如下:盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
(2)【情境问题思考】
①比较铜锌原电池Ⅰ与铜锌原电池Ⅱ构成上的差异,哪一种原电池化学能转化电能的效率高___________ ?说明理由___________ ?
②铜锌原电池Ⅱ中,盐桥的作用是什么___________ ?
(1)实验装置示意图如下:盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。

| 实验现象 | 锌片 | |
| 溶液颜色 | ||
| 取出右侧装置中的盐桥,电流表指针回到 | ||
| 能量转化 | ||
| 原因解释 | 电极名称 电极反应 | 锌电极为 |
| 铜电极为 | ||
| 电池总反应 | ||
| 电子流向 | 导线(电子导体)中,电子从 | |
| 离子移向 | 硫酸锌溶液中的 | |
| 盐桥(内有KCl)中: | ||
①比较铜锌原电池Ⅰ与铜锌原电池Ⅱ构成上的差异,哪一种原电池化学能转化电能的效率高
②铜锌原电池Ⅱ中,盐桥的作用是什么
您最近一年使用:0次

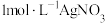 溶液加入到
溶液加入到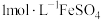 溶液中
溶液中

