解题方法
1 . 原电池是将化学能转化为电能的装置。
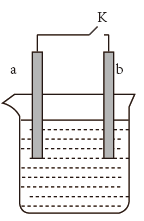
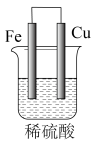
(1)a为铜片,b为铁片,烧杯中是稀硫酸溶液。
①当开关K断开时产生的现象为___________ 。
A.a不断溶解
B.b不断溶解
C.a上产生气泡
D.b上产生气泡
E.溶液逐渐变蓝
②闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述不正确的是___________ 。
A.溶液中H+浓度减小 B.正极附近 浓度逐渐增大
浓度逐渐增大
C.溶液中含有FeSO4 D.溶液中 浓度基本不变
浓度基本不变
(2)FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为___________ 。
(3)下图为氢氧燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:
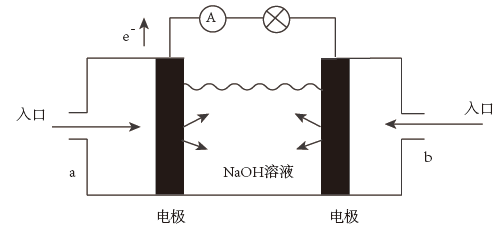
①a极通入的物质为___________ ,电解质溶液中的 移向
移向___________ 极(选填“负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:___________ 。
③当消耗氢气11.2L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为___________ mol。

(1)a为铜片,b为铁片,烧杯中是稀硫酸溶液。
①当开关K断开时产生的现象为
A.a不断溶解
B.b不断溶解
C.a上产生气泡
D.b上产生气泡
E.溶液逐渐变蓝
②闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述不正确的是
A.溶液中H+浓度减小 B.正极附近
 浓度逐渐增大
浓度逐渐增大C.溶液中含有FeSO4 D.溶液中
 浓度基本不变
浓度基本不变(2)FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为
(3)下图为氢氧燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:

①a极通入的物质为
 移向
移向②写出此氢氧燃料电池工作时,负极的电极反应式:
③当消耗氢气11.2L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 把A、B、C、D四种金属按表中装置进行实验。
根据实验现象回答问题:
(1)装置乙中正极的电极反应式是___ 。
(2)装置丙中溶液的酸性___ (填“变大”“变小”或“不变”)。
(3)四种金属活泼性由强到弱的顺序是___ 。
| 装置 | 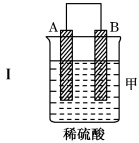 |  | 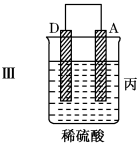 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置乙中正极的电极反应式是
(2)装置丙中溶液的酸性
(3)四种金属活泼性由强到弱的顺序是
您最近一年使用:0次
2021-04-14更新
|
223次组卷
|
3卷引用:湖南省长沙市南雅中学2020-2021学年高一下学期第一次月考化学试题
解题方法
3 . (1)在如图所示的原电池中,___ 是负极,发生___ 反应,正极的现象___ ,电池反应的化学方程式为___ 。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH═K2CO3+3H2O。

①实验测得OH-定向移向B电极,则___ 处电极入口通甲烷(填A或B)。
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___ 。
(3)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是___ ,电极反应式是___ ;
②B电极的材料是__ ,电极反应式是___ 。
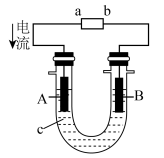

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH═K2CO3+3H2O。

①实验测得OH-定向移向B电极,则
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
(3)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是
②B电极的材料是

您最近一年使用:0次
解题方法
4 . 实验小组的同学们将三种金属按照下表的装置进行实验。回答问题:
(1)装置甲中铁极的电极反应式是____________ ,溶液中H+向_____ 极移动(填“正”或“负”)。
(2)装置乙中铜极发生____________ (填“氧化”或“还原”)反应。
(3)装置丙中M极为______ (填“正极”或“负极”),一段时间后溶液的酸性_____________ (填“增强”“减弱”或“不变”)。
(4)Fe、Cu、M中金属活动性最强的是_____________ 。
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 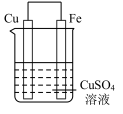 | 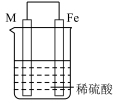 |
| 现象 | 溶液变为浅绿色,Cu极产生大量气泡 | Cu极的质量增加 | M极的质量减少 |
(1)装置甲中铁极的电极反应式是
(2)装置乙中铜极发生
(3)装置丙中M极为
(4)Fe、Cu、M中金属活动性最强的是
您最近一年使用:0次
2020-08-08更新
|
111次组卷
|
3卷引用:青海省西宁市2019-2020学年高一下学期期末调研测试化学试题
解题方法
5 . 如图所示装置:
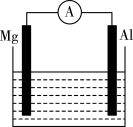
(1)若烧杯中溶液为稀硫酸,则观察到的现象为________ 。两极反应式为:正极________ ;负极________ 。该装置将________ 能转化为________ 能,原电池中的H+向______ (Mg、Al)极移动。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________ ,带_______ (正、负)电;总反应方程式为________ 。

(1)若烧杯中溶液为稀硫酸,则观察到的现象为
(2)若烧杯中溶液为氢氧化钠溶液,则负极为
您最近一年使用:0次
解题方法
6 . 由下列实验操作和现象得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向Co2O3中滴加浓盐酸 | 产生黄绿色气体 | 氧化性:Cl2<Co2O3 |
| B | 在镁、铝为电极,氢氧化钠为电解质的原电池装置 | 镁表面有气泡 | 金属活动性:Al>Mg |
| C | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟 | X可能是浓盐酸 |
| D | 将10mL2mol/L的KI溶液与1mL1mol/LFeCl3溶液混合充分反应后滴加KSCN溶液 | 溶液颜色变红 | KI与FeCl3的反应具有可逆性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-24更新
|
173次组卷
|
2卷引用:湖北省龙泉中学、荆州中学、宜昌一中2021届高三9月联考化学试题
7 . 原电池是将化学能转化为电能的装置,某兴趣小组利用数据采集器和传感器等仪器对原电池进行实验探究。
I.能量变化探究
将上表的现象和结论补充完整
(1)_____________
(2)__________ 、__________
II.原电池电压影响因素的测定
如图所示,在培养皿中进行微型实验,用浸有饱和KNO3溶液的滤纸充当盐桥,在滤纸间隔位置放置金属片,并滴三滴相应溶液,用电压传感器的两个探头分别与不同的金属表面接触形成闭合回路,测定电压。
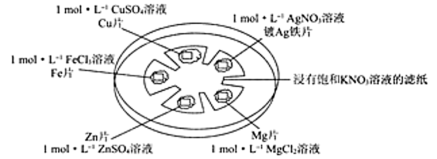
(3)准确配制一定物质的量浓度的溶液时,操作X应在__________ (填字母)之间。
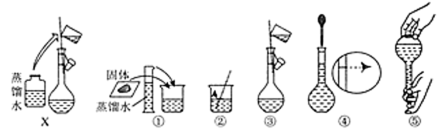
A.②③ B.③④ C.④⑤
(4)以上五种金属的活动性由活泼到不活泼的顺序为_________________ 。
(5)实验条件下,连接不同金属片时所得数据见下表,表中Y极代表__________ (填“正”或“负”)极,预测表中Ag和Zn相连接时,测得电压的数值a可能的范围为____________ ;Fe和Mg相连接时,Z极的电极反应式为__________ ,Y极的电极反应式为____________ 。
I.能量变化探究
| 实验操作 | 数据及图象 | 现象与结论 |
| 将60mL1mol/LCuSO4溶液置于100mL烧杯中,向其中加入1g镁粉 | 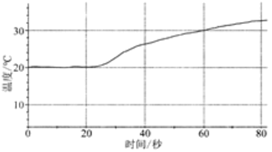 | (1)反应过程中,化学能直接转化为 能; |
| 将60mL1mol/LCuSO4溶液置于100mL烧杯中,平行插入铜片和镁片,与电流传感器形成闭合回路 | 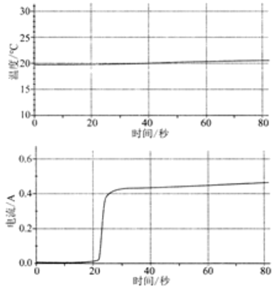 | (2)体系温度变化很小,原因是 ;反应过程中,镁片和铜片的质量变化分别为: ; |
(1)
(2)
II.原电池电压影响因素的测定
如图所示,在培养皿中进行微型实验,用浸有饱和KNO3溶液的滤纸充当盐桥,在滤纸间隔位置放置金属片,并滴三滴相应溶液,用电压传感器的两个探头分别与不同的金属表面接触形成闭合回路,测定电压。

(3)准确配制一定物质的量浓度的溶液时,操作X应在

A.②③ B.③④ C.④⑤
(4)以上五种金属的活动性由活泼到不活泼的顺序为
(5)实验条件下,连接不同金属片时所得数据见下表,表中Y极代表
| Y极 | Z极 | 测得电压/V |
| Ag | Fe | 1.009 |
| Ag | Zn | a |
| Ag | Mg | 2.114 |
| Fe | Zn | 0.473 |
| Fe | Mg | 1.111 |
| Zn | Mg | 0.636 |
您最近一年使用:0次
名校
解题方法
8 . “水”电池是一种利用淡水与海水之间含盐量差别进行发电的电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,如图以“水”电池为电源电解酸性FeCl2溶液,X电极附近溶液先变黄,下列有关分析不正确的是( )
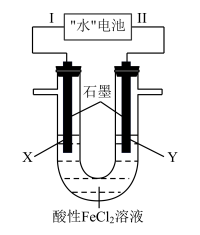

| A.该装置只涉及两种能量之间的转化 |
| B.在线路中安装电压调节装置,可通过现象判断Fe2+和Cl-的还原性强弱 |
| C.“水”电池内Na+不断向正极移动 |
| D.Ⅱ为负极,其电极反应式为Ag+Cl--e-=AgCl |
您最近一年使用:0次
2020-07-08更新
|
72次组卷
|
3卷引用:安徽省太和第一中学2019-2020学年高一下学期期末考试化学试题
解题方法
9 . 应用电化学原理,回答下列问题:
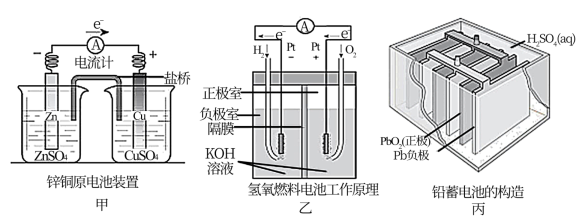
(1)上述三个装置中,负极反应物化学性质上的共同特点是_______ 。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是_______ 。
(3)乙中若将H2换成CH4,则负极反应式为_______ 。
(4)丙中铅蓄电池进行充电时,要将外接电源的负极与铅蓄电池_______ 极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
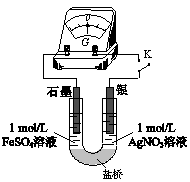
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U形管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作_______ 极。
②综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是_______ 。

(1)上述三个装置中,负极反应物化学性质上的共同特点是
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是
(3)乙中若将H2换成CH4,则负极反应式为
(4)丙中铅蓄电池进行充电时,要将外接电源的负极与铅蓄电池
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U形管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作
②综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是
您最近一年使用:0次
名校
解题方法
10 . 对右图所示的装置中实验现象的描述正确的是
| 选项 | a电极 | b电极 | X溶液 | 实验现象 | 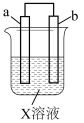 |
| A | 石墨 | 石墨 | CuCl2溶液 | a极质量增加,b极放出无色气体 | |
| B | Cu | Fe | KNO3溶液 | a极质量增加,b极放出无色气体 | |
| C | 石墨 | Fe |  溶液 溶液 | a极质量增加,b极质量减小 | |
| D | 石墨 | Zn | HCl溶液 | a放出无色气体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



