名校
解题方法
1 . 如图是元素周期表的一部分,按要求回答问题:
(1)元素④在周期表中位置是_______ 。元素③的最高价氧化物的化学式为________ 。
(2)元素①⑤组成化合物电子式为___________ 。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___ 。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____ 。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____ (用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。
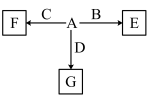
①A和F的化学式分别为_______ 、_______ 。
②B与G反应的化学方程式为____________________ 。
③C与NaOH溶液反应的离子方程式为______________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素④在周期表中位置是
(2)元素①⑤组成化合物电子式为
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。

①A和F的化学式分别为
②B与G反应的化学方程式为
③C与NaOH溶液反应的离子方程式为
您最近一年使用:0次
2020-04-03更新
|
1037次组卷
|
5卷引用:湖北省应城市第一高级中学2019-2020学年高一下学期复学摸底测试化学试题
湖北省应城市第一高级中学2019-2020学年高一下学期复学摸底测试化学试题山东省威海市文登区2019届高三上学期期中考试化学试题(A卷)鲁科版(新)必修第二册第一章检测题山东省泰安市东平县高级中学2021届高三上学期第二次质量检测化学试题(已下线)第15练 第四章章末质量检测-2022年【寒假分层作业】高一化学(人教版2019)
名校
2 . 下表是元素周期表的一部分,根据A~H在元素周期表中的位置,用元素符号或化学式回答下列问题:
(1)上表中,元素金属性最强的是________ (填元素符号)。
(2)写出D的原子结构示意图:__________
(3)B与C的原子半径比较:B________ C (填“>”或“<”)。G与H的非金属性比较:G ________ H(填“>”或“<”)。
(4)A与H形成化合物的电子式:_______
(5)写出B的最高价氧化物对应水化物与H的气态氢化物的水溶液反应的离子方程式:______ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | F | H |
(1)上表中,元素金属性最强的是
(2)写出D的原子结构示意图:
(3)B与C的原子半径比较:B
(4)A与H形成化合物的电子式:
(5)写出B的最高价氧化物对应水化物与H的气态氢化物的水溶液反应的离子方程式:
您最近一年使用:0次
2019-09-21更新
|
286次组卷
|
4卷引用:湖北省沙市中学2019-2020学年高二上学期期中考试化学(学考)试题
湖北省沙市中学2019-2020学年高二上学期期中考试化学(学考)试题湖南省张家界市2018-2019学年高一下学期期末考试化学试题(已下线)专题09 元素周期律(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学四川省成都实验中学2020-2021学年度高2022届高二上学期开学考试化学试题
3 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:

(1)写出元素⑤在元素周期表中的位置_______ ;
(2)比较对应元素原子半径③________ ④(填“>”“<”或“=”);
(3)②和①按原子个数1:4组成的化合物的分子结构呈______ 形。

(1)写出元素⑤在元素周期表中的位置
(2)比较对应元素原子半径③
(3)②和①按原子个数1:4组成的化合物的分子结构呈
您最近一年使用:0次
2019-08-25更新
|
132次组卷
|
2卷引用:湖北省宜昌市2018-2019学年高一下学期期末考试化学试题
名校
4 . 下表是元素周期表的一部分,用化学用语回答:

(1)②的元素名称为_________ ;元素②最外层有___ 个电子,最低负化合价为____ 。
(2)元素①、③、④、⑤简单离子半径由大到小的顺序为___________ (用微粒符号填写)
(3)绘出元素⑥的离子结构示意图_________________ 。
(4)元素①的简单氢化物的电子式为____________ ,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为___________________________________ 。
(5)元素②、⑥的简单氢化物的沸点:②________ (填“高于”或“低于”)⑥,其原因是_________________________________ 。

(1)②的元素名称为
(2)元素①、③、④、⑤简单离子半径由大到小的顺序为
(3)绘出元素⑥的离子结构示意图
(4)元素①的简单氢化物的电子式为
(5)元素②、⑥的简单氢化物的沸点:②
您最近一年使用:0次
名校
5 . 第一张元素周期表由俄国化学家____________ 首制,他绘制依据将元素按照________________ 由小到大的顺序排列;现在使用的周期表是按______________ 由小到大的顺序排列的,有______ 横行,包含_______ 个周期,有_______ 个纵行。
您最近一年使用:0次
名校
6 . 下图是中学教材中元素周期表的一部分,其中标出A-Q14种元素,试回答下列问题:[(1) (2)问用具体的元素符号或离子符号或化学式回答]
(1)在上表所列出的短周期元素中
①性质最不活泼的是_______ ;②原子半径最大的是_____ (除稀有气体元素)
③形成的气态氢化物最稳定的是_______ ;
④最高价氧化物对应的水化物中酸性最强的是_______ 碱性最强的是_______ 。
⑤形成的阴离子还原性最弱的是_______ ,阳离子半径最小的是_______ 。
(2)用电子式表示F与D形成化合物的过程
________________________________________________________________________ ;
(3)设P的原子序数为Z,则F的原子序数为___________ ,Q的原子序数为____________ 。
| A | B | C | D | ||||||||||||||
| E | F | G | H | I | J | K | L | ||||||||||
| P | Q |
(1)在上表所列出的短周期元素中
①性质最不活泼的是
③形成的气态氢化物最稳定的是
④最高价氧化物对应的水化物中酸性最强的是
⑤形成的阴离子还原性最弱的是
(2)用电子式表示F与D形成化合物的过程
(3)设P的原子序数为Z,则F的原子序数为
您最近一年使用:0次
7 . 在工业上,通过含锌矿石制取应用广泛的锌及其化合物。
(1)Zn在元素周期表中位于_____ 区,其基态原子价电子排布式为________ 。
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为_____ ,与CN-互为等电子体的粒子有_____ 、________ (写出两种)。
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为________ .中心原子杂化方式为________ ;HOCH2CN中元素电负性由大到小的顺序_______ ,1 mol HOCH2CN分子中,含有σ键的数为_________ 。
(4)ZnS和HgS晶体在岩浆中先晶出的是________ ,其原因是___________ 。
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为______ g/cm3(设晶胞参数为apm,NA表示阿伏伽德罗常数)
(1)Zn在元素周期表中位于
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为
(4)ZnS和HgS晶体在岩浆中先晶出的是
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为
您最近一年使用:0次
2017-05-03更新
|
334次组卷
|
2卷引用:2017届湖北省华中师范大学(新高考联盟)高三2月教学质量测评理综化学试卷
名校
解题方法
8 . 下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的名称 是______ ,碱性最强的化合物的化学式 是_______ 。
(2)⑤⑦形成化合物的电子式___ 。②形成的最高价氧化物的结构式____ 。
(3)最高价氧化物是两性氧化物的元素 其元素符号是____ ;写出它的氢氧化物与 ⑧的最高价氧化物的水化物反应的离子方程式
⑧的最高价氧化物的水化物反应的离子方程式________ 。
(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是______ 。
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:____________ 。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的
(2)⑤⑦形成化合物的电子式
(3)最高价氧化物是两性氧化物的
 ⑧的最高价氧化物的水化物反应的离子方程式
⑧的最高价氧化物的水化物反应的离子方程式(4)⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是
(5)②和⑦可形成原子数1∶2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程:
您最近一年使用:0次
2017-04-14更新
|
265次组卷
|
3卷引用:湖北省仙桃市汉江高级中学2016-2017学年高一下学期期末考试化学试题
9 . 铜是人类最早发现的金属,也是人类广泛使用的一种金属。铜及其化合物在工业、工程技术和工艺上有着广泛的应用。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的____ 区。基态Al原子的L层电子排布图为___________ 。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为_________ ,1mol乙酸分子中含有的σ键的数目为____________ 。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为____ 。碳、硼、氮元素的电负性由大到小的顺序是_____ 。(用元素符号表示)
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为_________ 。
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为____ g·cm-3(设阿伏伽德罗常数的值为NA)。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为
您最近一年使用:0次
10 . 假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)已知元素周期表中的各周期可排元素种类如下:
人们预测元素周期表第八周期将来也会排满,那么该周期排满后的元素种数是________________ 。
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有___________ 种非金属元素,还有__________ 种未发现。未发现的非金属元素处于__________ 周期_________ 族。
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。

回答下列问题:
①请在图中将过渡元素所在的位置涂黑______________ 。
②画出B元素价电子排布图____________________ 。
(1)已知元素周期表中的各周期可排元素种类如下:
| 周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。

回答下列问题:
①请在图中将过渡元素所在的位置涂黑
②画出B元素价电子排布图
您最近一年使用:0次
2016-12-09更新
|
241次组卷
|
3卷引用:2017届湖北省老河口市江山中学高三10月月考化学卷
2017届湖北省老河口市江山中学高三10月月考化学卷2015-2016学年四川省雅安市天全中学高二9月月考化学试卷(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)



