解题方法
1 . Ga与B、Al处于同一主族,氮化镓是制造LED的重要材料,被誉为第三代半导体材料。回答下列问题:
(1)基态Ga原子的价电子排布式为___________ 。
(2)Be、B、C的电负性由小到大的顺序为___________ ,第一电离能由小到大的顺序为___________ 。
(3)①乙硼烷(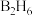 )的结构如图,其中B原子的轨道杂化类型是
)的结构如图,其中B原子的轨道杂化类型是___________ 。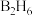 与
与 反应生成环氮硼烷(
反应生成环氮硼烷( 具有规则的平面六角形环状结构),写出一种与
具有规则的平面六角形环状结构),写出一种与 原子总数相同、价电子总数相同的分子
原子总数相同、价电子总数相同的分子___________ 。 极易水解,从配位角度解释原因
极易水解,从配位角度解释原因___________ 。
③B和N形成的BN有石墨型与金刚石型结构,金刚石型BN的硬度大于金刚石,原因是___________ 。
(4)氮化镓的一种晶体结构如图所示(属六方晶系),Ga的配位数为___________ ,晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态Ga原子的价电子排布式为
(2)Be、B、C的电负性由小到大的顺序为
(3)①乙硼烷(
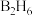 )的结构如图,其中B原子的轨道杂化类型是
)的结构如图,其中B原子的轨道杂化类型是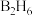 与
与 反应生成环氮硼烷(
反应生成环氮硼烷( 具有规则的平面六角形环状结构),写出一种与
具有规则的平面六角形环状结构),写出一种与 原子总数相同、价电子总数相同的分子
原子总数相同、价电子总数相同的分子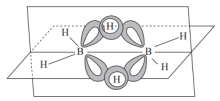
 极易水解,从配位角度解释原因
极易水解,从配位角度解释原因③B和N形成的BN有石墨型与金刚石型结构,金刚石型BN的硬度大于金刚石,原因是
(4)氮化镓的一种晶体结构如图所示(属六方晶系),Ga的配位数为
 (用含a、c、
(用含a、c、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。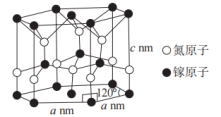
您最近一年使用:0次
名校
解题方法
2 . 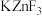 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、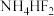 制备。回答下列问题:
制备。回答下列问题:
(1)基态Zn原子的价电子轨道表达式为___________ ;基态N原子中未成对电子数为___________ 。
(2)O的第一电离能小于N的第一电离能的原因是___________ ;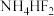 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为___________ (用元素符号表示)。
(3) 中阴离子的空间构型为
中阴离子的空间构型为___________ ;其中C原子的杂化方式为___________ 。
(4) 具有金红石型四方结构,
具有金红石型四方结构, 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
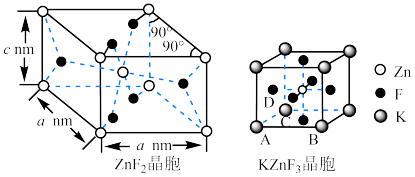
① 和
和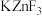 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为___________ 。
②若 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
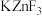 被认为是良好的光学基质材料,可由
被认为是良好的光学基质材料,可由 、
、 、
、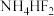 制备。回答下列问题:
制备。回答下列问题:(1)基态Zn原子的价电子轨道表达式为
(2)O的第一电离能小于N的第一电离能的原因是
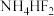 的组成元素中电负性由大到小的顺序为
的组成元素中电负性由大到小的顺序为(3)
 中阴离子的空间构型为
中阴离子的空间构型为(4)
 具有金红石型四方结构,
具有金红石型四方结构,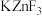 具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示:
①
 和
和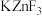 晶体中,Zn的配位数之比为
晶体中,Zn的配位数之比为②若
 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 晶体的密度为
晶体的密度为 (用含a、c、
(用含a、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-01-08更新
|
239次组卷
|
2卷引用:2024届陕西省商洛市高三上学期尖子生学情诊断考试理综试题
名校
解题方法
3 . 丁二酮肟常用于检验 ,在稀氨水介质中,丁二酮肟与
,在稀氨水介质中,丁二酮肟与 反应可生成鲜红色沉淀,其结构如图所示。下列说法不正确的是
反应可生成鲜红色沉淀,其结构如图所示。下列说法不正确的是
 ,在稀氨水介质中,丁二酮肟与
,在稀氨水介质中,丁二酮肟与 反应可生成鲜红色沉淀,其结构如图所示。下列说法不正确的是
反应可生成鲜红色沉淀,其结构如图所示。下列说法不正确的是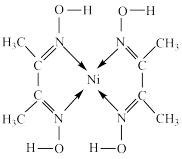
A.元素H、C、N、O、Ni电负性由大到小的顺序为 |
| B.1mol该沉淀含有σ键与π键的个数比为17:2 |
C.基态 的价电子排布式为 的价电子排布式为 |
D.该沉淀中C的杂化方式为 、 、 |
您最近一年使用:0次
2022-12-17更新
|
758次组卷
|
7卷引用:陕西省商洛市柞水中学2023-2024学年高二上学期11月期中化学试题
解题方法
4 . 铜是人类广泛使用的一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态Cu原子的价电子排布式为_______ , 原子核外的电子有_______ 种空间运动状态。
(2)配合物Cu(NH3)2OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是_______ ,NH3分子的价层电子对互斥模型是_______ ,C、N、O、H的电负性由大到小的顺序为_______ 。
(3)Cu+与CN-形成的阴离子为[Cu(CN)3]2- ,该阴离子中σ键与π键数目之比为_______ 。
(4)铜能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-C≡N),其原因为_______ 。
(5)某立方磷青铜晶体的晶胞结构如图所示。
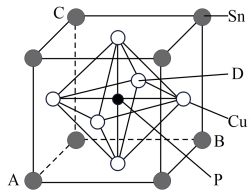
①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为_______ 。
②若晶体密度为ρg·cm-3 ,最近的Cu原子核间距为_______ (用含ρ、NA的代数式表示)pm。
(1)基态Cu原子的价电子排布式为
(2)配合物Cu(NH3)2OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是
(3)Cu+与CN-形成的阴离子为[Cu(CN)3]2- ,该阴离子中σ键与π键数目之比为
(4)铜能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-C≡N),其原因为
(5)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为
②若晶体密度为ρg·cm-3 ,最近的Cu原子核间距为
您最近一年使用:0次
名校
解题方法
5 . 镁、铝、铁、铜及其化合物在生产生活中具有广泛的应用。
(1)基态铝原子核外电子占据的最高能级符号为____ ,该能级原子轨道数为____ ,电子云轮廓图为_____ ;基态铁原子价层电子未成对电子数为_____ 。
(2)第一电离能镁_____ 铝(填>、<、=)
(3)CuSO4·5H2O俗名胆矾矾,可用于配制农药和游泳池消毒,其组成可表示为[Cu(H2O)4]SO4·H2O。晶体中含有的化学键类型为_______
a.离子键 b.共价键 c.配位键 d.氢键 e.金属键
(4)FeSO4·7H2O俗称绿矾,在空气中加热分解可能得到Fe2O3、H2O、SO2、SO3等,其中CuO的熔点为1026℃。
①H2O分子中氧原子的杂化类型是______ ,分子的立体构型是_____ 。组成绿矾的元素中电负性最大的元素是______ ,
②CuO的晶体类型是_____ 。
③SO2与SO3中,属于非极性分子的是______ ,SO2在溶剂水与溶剂CCl4中,相同温度能溶解更多SO2的溶剂是________
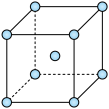
④铁的晶胞结构如图,若晶胞参数为acm,阿伏加德罗常数值为NA,则晶体的密度为___________ g/cm3。
(1)基态铝原子核外电子占据的最高能级符号为
(2)第一电离能镁
(3)CuSO4·5H2O俗名胆矾矾,可用于配制农药和游泳池消毒,其组成可表示为[Cu(H2O)4]SO4·H2O。晶体中含有的化学键类型为
a.离子键 b.共价键 c.配位键 d.氢键 e.金属键
(4)FeSO4·7H2O俗称绿矾,在空气中加热分解可能得到Fe2O3、H2O、SO2、SO3等,其中CuO的熔点为1026℃。
①H2O分子中氧原子的杂化类型是
②CuO的晶体类型是
③SO2与SO3中,属于非极性分子的是
④铁的晶胞结构如图,若晶胞参数为acm,阿伏加德罗常数值为NA,则晶体的密度为

您最近一年使用:0次
名校
解题方法
6 . 氯磺酰氰酯(结构简式为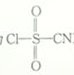 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是
(3)ClO4-的空间构型为
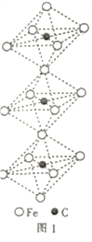
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为
您最近一年使用:0次
2018-05-25更新
|
267次组卷
|
3卷引用:2024届陕西省商洛市高三下学期第五次模拟检测理综试题-高中化学



