解题方法
1 . 国产大飞机C919的制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)立方氮化硼硬度大,熔点为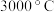 ,其晶体类型为
,其晶体类型为_______ 。
(2)耐高温材料立方 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂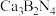 。
。
① 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为_______ 。
② 中
中 原子的
原子的_______ 轨道与 原子的
原子的_______ 轨道形成 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为_______ 。
③ 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是_______ 。
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有_______ (填字母)。 键 E.
键 E. 键 F.氢键
键 F.氢键
(4)硼化钙晶胞结构如图所示, 原子构成
原子构成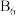 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个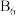 多面体围成立方体,中心为
多面体围成立方体,中心为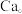 硼化钙的化学式为
硼化钙的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知 原子的分数坐标为
原子的分数坐标为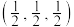 ,
,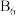 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
(1)立方氮化硼硬度大,熔点为
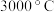 ,其晶体类型为
,其晶体类型为(2)耐高温材料立方
 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂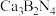 。
。①
 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为②
 中
中 原子的
原子的 原子的
原子的 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为③
 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有
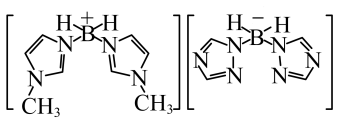
 键 E.
键 E. 键 F.氢键
键 F.氢键(4)硼化钙晶胞结构如图所示,
 原子构成
原子构成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为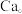 硼化钙的化学式为
硼化钙的化学式为 原子的分数坐标为
原子的分数坐标为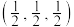 ,
,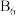 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为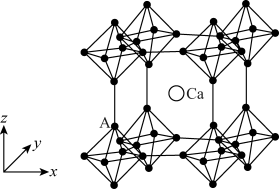
您最近一年使用:0次
2 . X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大;X原子核外有6种不同运动状态的电子;Y原子的最外层电子数比次外层电子数多3个;基态Z原子的 能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
 能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是
能级成对电子数的对数与未成对电子数相等;Q电子总数是最外层电子数的3倍;R是用量最大、使用最广泛的金属。下列说法正确的是A.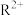 的价电子排布式为 的价电子排布式为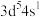 | B.电负性:X>Y>Z |
| C.最简单氢化物的稳定性:Y>Q | D.X的氢化物中只含有σ键 |
您最近一年使用:0次
3 . 下列物质的结构或性质及其解释均正确的是
| 选项 | 物质的结构或性质 | 解释 |
| A | 极性: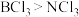 | B元素和Cl元素的电负性差值大于N元素和Cl元素的电负性差值 |
| B | 沸点:对羟基苯甲醛>邻羟基苯甲醛 | 对羟基苯甲醇分子间范德华力更强 |
| C |  在水中的溶解度比在 在水中的溶解度比在 中的溶解度更大 中的溶解度更大 |  是弱极性分子 是弱极性分子 |
| D | 电子云半径3s>1s | 3s电子能量高,在离核更远的区域出现的概率大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
4 . 将氟气通入氢氧化钠溶液中,可得OF2.OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比,OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2中O的化合价为
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比,OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
2023-11-22更新
|
350次组卷
|
2卷引用:陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
名校
解题方法
5 . 已知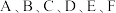 是原子序数依次增大的前四周期元素。其中
是原子序数依次增大的前四周期元素。其中 是宇宙中含量最多的元素;
是宇宙中含量最多的元素; 元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
元素原子最高能级的不同轨道都有电子,并且自旋方向相同; 元素原子的价层电子排布式为
元素原子的价层电子排布式为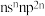 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子; 与
与 的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
 是原子序数依次增大的前四周期元素。其中
是原子序数依次增大的前四周期元素。其中 是宇宙中含量最多的元素;
是宇宙中含量最多的元素; 元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
元素原子最高能级的不同轨道都有电子,并且自旋方向相同; 元素原子的价层电子排布式为
元素原子的价层电子排布式为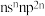 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子; 与
与 的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是A.A、B、C三种元素的电负性: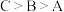 |
B.B、C、D、E四种元素的第一电离能: |
C.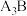 的稳定性大于 的稳定性大于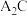 |
D. 的常见离子的核外电子排布图为 的常见离子的核外电子排布图为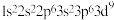 |
您最近一年使用:0次
2023-09-17更新
|
212次组卷
|
2卷引用:陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
解题方法
6 . 非金属氮化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态N原子核外电子的运动状态有___________ 种,其核外电子占据能量最高的能级电子云轮廓图形状为___________ 。
(2)氟化硝酰(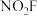 )可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为
)可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为___________ ;第一电离能由大到小顺序为_________ 。
(3)气态 的分子结构为
的分子结构为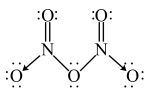 ,而固态
,而固态 则由
则由 与
与 构成。
构成。 的空间构型为
的空间构型为_________ , 中N的杂化方式为
中N的杂化方式为___________ 。
(4)一种新型的氮碳化合物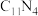 的晶体属于四方晶系,其沿着y轴的投影如图1所示,晶胞参数及侧视图如图2所示。
的晶体属于四方晶系,其沿着y轴的投影如图1所示,晶胞参数及侧视图如图2所示。______ 。
(5)已知某氮化铁的晶胞结构如图所示,则氮化铁的化学式为___________ ,若该晶体的密度是 ,则晶胞中两个最近的Fe的核间距离为
,则晶胞中两个最近的Fe的核间距离为___________ cm(用含 、
、 的代数式表示)。
的代数式表示)。
(1)基态N原子核外电子的运动状态有
(2)氟化硝酰(
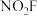 )可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为
)可用作火箭推进剂中的氧化剂,上述所涉及元素中,电负性由大到小顺序为(3)气态
 的分子结构为
的分子结构为 ,而固态
,而固态 则由
则由 与
与 构成。
构成。 的空间构型为
的空间构型为 中N的杂化方式为
中N的杂化方式为(4)一种新型的氮碳化合物
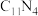 的晶体属于四方晶系,其沿着y轴的投影如图1所示,晶胞参数及侧视图如图2所示。
的晶体属于四方晶系,其沿着y轴的投影如图1所示,晶胞参数及侧视图如图2所示。
(5)已知某氮化铁的晶胞结构如图所示,则氮化铁的化学式为
 ,则晶胞中两个最近的Fe的核间距离为
,则晶胞中两个最近的Fe的核间距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
13-14高二上·江苏泰州·期中
名校
解题方法
7 . 已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C处于同一周期,两者可以形成许多种共价化合物,C、F处于同一主族,B原子最外电子层的p能级处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为____ 。
(2)用电子排布图表示F元素原子的价电子排布:____ 。
(3)F、G元素对应的最高价含氧酸中酸性较强的是____ (填化学式)。
(4)离子半径:D+____ (填“<”“>”或“=”,下同)B3-,第一电离能:B____ C,电负性:C____ F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____ 。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:____ 。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____ 。
(1)E元素基态原子的电子排布式为
(2)用电子排布图表示F元素原子的价电子排布:
(3)F、G元素对应的最高价含氧酸中酸性较强的是
(4)离子半径:D+
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:
您最近一年使用:0次
2022-04-03更新
|
380次组卷
|
11卷引用:陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题
陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题(已下线)2013-2014学年江苏省泰州市姜堰区高二上学期期中考试化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)云南省景东彝族自治县第一中学2021-2022学年高二下学期开学考试化学试题云南省曲靖市宣威市第七中学2021-2022学年高二下学期2月考试化学试题云南省玉溪市江川区第一中学2021-2022学年高二下学期3月月考化学试题江苏省苏州市相城区陆慕高级中学2021-2022学年高二下学期第一次月考化学试题广东省四会市四会中学、广信中学2021-2022学年高二下学期第二次考试化学试题
名校
解题方法
8 . 硼材料及含硼化合物的用途非常广泛,如B(C6F5)3可代品Cu催化重氮化合物对杂环分子的修饰、催化吲哚与苯乙炔的区域选择性加成等。回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过___________ 的方法区分晶体与准晶体。
(2)B、C、F的电负性由大到小的顺序为___________ ;Be、B、C是同周期相邻元素,第一电离能: ,这是因为
,这是因为___________ 。
(3)B(C6F5)3分子中所有原子___________ (填“能”或“不能”)处于同一平面。
(4)吲哚(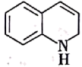 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是_________ 。
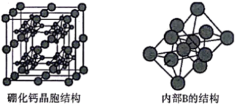
(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为___________ ,其晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态Cu原子的价电子排布式为
 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过(2)B、C、F的电负性由大到小的顺序为
 ,这是因为
,这是因为(3)B(C6F5)3分子中所有原子
(4)吲哚(
 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设
 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-11-23更新
|
194次组卷
|
3卷引用:陕西省榆林市第十中学2022届高三第五次模拟考试理综化学试题
解题方法
9 . 铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为__ ,δ、α两种晶胞中铁原子的配位数之比为__ 。



(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__ (填晶体类型)。
(3)铜晶体中铜原子的堆积方式为__ ,晶胞中原子的空间利用率为__ 。
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①如图表示的是___ (填“CuCl2”或“CuCl”)的晶胞,其中Cl-的配位数为__ 。
②已知铜和Cl的电负性分别为1.9和3.0,则铜与Cl形成的化合物属于__ (填“离子”或“共价”)化合物。


③原子坐标参数表示晶胞内部各原子的相对位置。图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为__ 。
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为



(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(3)铜晶体中铜原子的堆积方式为
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①如图表示的是
②已知铜和Cl的电负性分别为1.9和3.0,则铜与Cl形成的化合物属于


③原子坐标参数表示晶胞内部各原子的相对位置。图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为
您最近一年使用:0次
10 . 碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
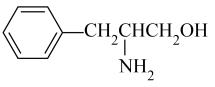
(1)某有机物的结构简式如图。该有机物分子是___ (填“极性”或“非极性”)分子,该有机物分子中电负性最大的原子为___ 。
(2)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是__ 。
(1)某有机物的结构简式如图。该有机物分子是

(2)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为
您最近一年使用:0次



