名校
1 . 请根据所学知识回答下列问题:
(1)已知反应Fe+H2SO4=FeSO4+H2↑。若要加快该反应的速率,在其他条件不变的情况下,下列措施可行的是_______(填字母)。
(2)近年来,科学家致力于将二氧化碳和氢气转化为甲醇(CH3OH)的技术研究,为解决环境与能源问题提供了新途径。某温度下的恒压密闭容器中,充入4molCO2和4molH2,发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①能判断该反应已达到化学反应限度的是_______ (填字母)。
A.容器内压强保持不变
B.容器中CO2浓度与H2浓度之比为1:3,且随着时间的变化,不再发生变化
C.容器中CO2的物质的量分数保持不变
D.CO2的生成速率与CH3OH的生成速率相等
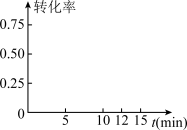
②现测得H2的浓度随时间变化如图所示。从反应开始经过12min达到平衡,则0~12min内CO2的平均反应速率v(CO2)=_______ ,第12min时,甲醇的物质的量浓度为_______ 。_______ 。_______ 。
(1)已知反应Fe+H2SO4=FeSO4+H2↑。若要加快该反应的速率,在其他条件不变的情况下,下列措施可行的是_______(填字母)。
| A.适当地升高温度 | B.改稀硫酸为98%的浓硫酸 |
| C.将纯铁改为生铁 | D.往稀硫酸中加入少量NaNO3(s) |
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。①能判断该反应已达到化学反应限度的是
A.容器内压强保持不变
B.容器中CO2浓度与H2浓度之比为1:3,且随着时间的变化,不再发生变化
C.容器中CO2的物质的量分数保持不变
D.CO2的生成速率与CH3OH的生成速率相等
②现测得H2的浓度随时间变化如图所示。从反应开始经过12min达到平衡,则0~12min内CO2的平均反应速率v(CO2)=

您最近一年使用:0次
2 . 回答下列问题
(1)在密闭容器中,使1mol X和4mol Y混合发生下列反应: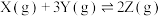
 。
。
①反应过程中X和Y的转化率之比______ 1(填“>”“<”或“=”)。
②当达到平衡时,保持恒温,压缩容器体积,平衡将______ (填“正向”“逆向”或“不”)移动,化学平衡常数K______ (填“变大”“变小”或“不变”)。
(2) 在密闭真空容器中发生反应:
在密闭真空容器中发生反应: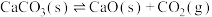 达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,则
达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,则 浓度
浓度______ (填“变大”“变小”或“不变”)。
(3)已知反应:
 。其他条件相同时,该反应使用两种不同催化剂,反应相同的反应时间,测得
。其他条件相同时,该反应使用两种不同催化剂,反应相同的反应时间,测得 的转化率随温度变化的影响如图所示。
的转化率随温度变化的影响如图所示。______ 、______ 。
②温度高于320℃时, 转化率减小的原因可能是
转化率减小的原因可能是______ 。
(1)在密闭容器中,使1mol X和4mol Y混合发生下列反应:
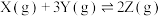
 。
。①反应过程中X和Y的转化率之比
②当达到平衡时,保持恒温,压缩容器体积,平衡将
(2)
 在密闭真空容器中发生反应:
在密闭真空容器中发生反应: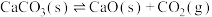 达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,则
达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,则 浓度
浓度(3)已知反应:

 。其他条件相同时,该反应使用两种不同催化剂,反应相同的反应时间,测得
。其他条件相同时,该反应使用两种不同催化剂,反应相同的反应时间,测得 的转化率随温度变化的影响如图所示。
的转化率随温度变化的影响如图所示。
②温度高于320℃时,
 转化率减小的原因可能是
转化率减小的原因可能是
您最近一年使用:0次
3 . 利用反应: 设计了如图所示的原电池。回答下列问题:
设计了如图所示的原电池。回答下列问题:___________ ,电极方程式为:___________ ,发生___________ 反应。
(2)X是___________ ,Y是___________ 。
(3)正极上出现的现象是___________ ;电极方程式为:___________ 。
 设计了如图所示的原电池。回答下列问题:
设计了如图所示的原电池。回答下列问题: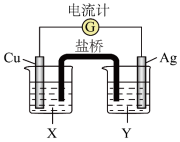
(2)X是
(3)正极上出现的现象是
您最近一年使用:0次
4 . 已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,pH相同的三种溶液①NaF溶液;②NaClO溶液;③Na2CO3溶液,其物质的量浓度由大到小的顺序是_______ 。(填序号)
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_______ 。
(3)室温下,经测定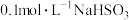 溶液
溶液 ,则
,则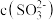
_______  (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。
(4) 时,将
时,将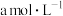 的氨水与
的氨水与 的盐酸等体积混合所得溶液中
的盐酸等体积混合所得溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离平衡常数
的电离平衡常数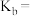
_______ 。
(5)将含 的烟气通入该氨水中,当溶液显中性时,溶液中
的烟气通入该氨水中,当溶液显中性时,溶液中
_______ 。
| 化学式 |  |  |  |  |  |
| 电离常数 |  |  |  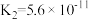 | 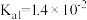 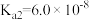 | 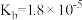 |
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式
(3)室温下,经测定
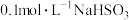 溶液
溶液 ,则
,则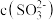
 (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。(4)
 时,将
时,将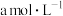 的氨水与
的氨水与 的盐酸等体积混合所得溶液中
的盐酸等体积混合所得溶液中 ,则溶液显
,则溶液显 的电离平衡常数
的电离平衡常数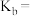
(5)将含
 的烟气通入该氨水中,当溶液显中性时,溶液中
的烟气通入该氨水中,当溶液显中性时,溶液中
您最近一年使用:0次
名校
5 . 柠檬酸是一种重要的工业原料,化学式可表示为 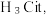 属于三元弱酸。 25℃时,柠檬酸的电离常数分别为:
属于三元弱酸。 25℃时,柠檬酸的电离常数分别为: 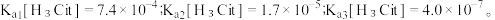
(1)25℃时, 不同pH范围内,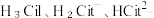 和
和 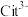 所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表
所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表  的曲线是
的曲线是_______ 。
(3)已知25℃时,碳酸的电离常数为: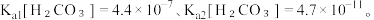 向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式_______ 。
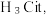 属于三元弱酸。 25℃时,柠檬酸的电离常数分别为:
属于三元弱酸。 25℃时,柠檬酸的电离常数分别为: 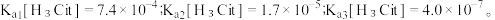
(1)25℃时, 不同pH范围内,
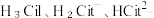 和
和 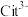 所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表
所占的比例 (该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表  的曲线是
的曲线是
A.Na3Cit溶液中, |
B.Na3Cit溶液中,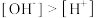 |
C.NaH2Cit溶液中, |
D.Na2HCit溶液中,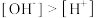 |
(3)已知25℃时,碳酸的电离常数为:
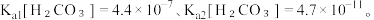 向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
您最近一年使用:0次
名校
解题方法
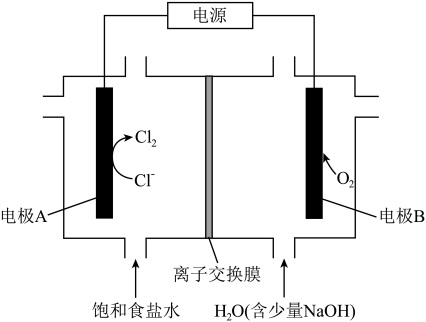
6 . 氯碱工业能耗大,通过如图的结构可大幅度降低能耗。_______ 离子交换膜 (填“正”或“负”)。
(2)反应的总化学方程式为_______ 。
(3)当电路中通过0.2mol电子时, 右侧溶液质量_____ (填“增加”或“减少”) _______ g。
(2)反应的总化学方程式为
(3)当电路中通过0.2mol电子时, 右侧溶液质量
您最近一年使用:0次
名校
解题方法
7 . 金属阳极钝化是一种电化学防护方法。将Fe 作阳极置于一定浓度的H2SO4 溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该过程中阳极的电极反应_______ 。
您最近一年使用:0次
名校
解题方法
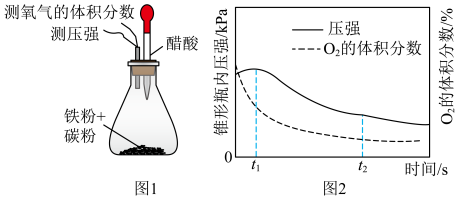
8 . 按图1进行实验,测得锥形瓶内气压和空气中氧气的体积分数随时间变化如图2所示。t1~t2之间主要发生_______ (填“吸氧”或“析氢”)腐蚀,其正极反应式为_______ 。
您最近一年使用:0次
解题方法
9 . 依据叙述,按要求填空
(1)在25℃、101kPa下,1g甲醇(CH3OH液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________ 。
(2)11.2L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5kJ热量,其热化学方程式:___________ 。
(3)已知1molC(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3kJ热量,请写出该反应的热化学方程式:___________ 。
(4)甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1=+92.09kJ/mol
氧化法:CH3OH(g)+ O2(g)=HCHOg+H2O(g) △H2
O2(g)=HCHOg+H2O(g) △H2
已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ/mol,则△H2=___________ 。
(1)在25℃、101kPa下,1g甲醇(CH3OH液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
(2)11.2L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5kJ热量,其热化学方程式:
(3)已知1molC(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3kJ热量,请写出该反应的热化学方程式:
(4)甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1=+92.09kJ/mol
氧化法:CH3OH(g)+
 O2(g)=HCHOg+H2O(g) △H2
O2(g)=HCHOg+H2O(g) △H2已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ/mol,则△H2=
您最近一年使用:0次
解题方法
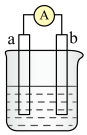
10 . 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:___________ 。若初始时两电极质量相等,当电路中有2mole﹣通过时,两极的质量差为___________ g。
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为___________ ,当反应中收集到标准状况下336mL气体时,消耗负极的物质的量为___________ mol。
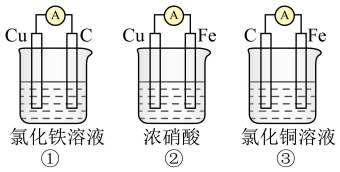
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是___________ ,写出正极的电极反应式___________ 。___________ (填“正”或“负”)极。
②该电池负极的电极反应式为___________ 。
③工作一段时间后,当3.2g甲醇完全反应生成CO2时,外电路中通过的电子数目为___________ 。(用含NA的式子表示)
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是
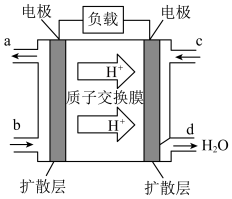
②该电池负极的电极反应式为
③工作一段时间后,当3.2g甲醇完全反应生成CO2时,外电路中通过的电子数目为
您最近一年使用:0次



