解题方法
1 . 近年来,随着新能源汽车行业高速发展,市场对磷酸铁锂( )的需求量也随之增加。以硫铁矿(主要成分是
)的需求量也随之增加。以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 为原料制备)
为原料制备) 的流程如图所示:
的流程如图所示:
请回答下列问题:
(1)写出磷酸铁锂中相应价态基态铁离子的电子排布式:___________ 。
(2)“焙烧”生成 的化学方程式为
的化学方程式为___________ 。
(3)“还原”选用足量FeS的优点是___________ ;“除铝”时,溶液的pH应控制的范围是___________ 。
(4)“氧化”加入 的目的除了可以增强H2O2的氧化性外,还可以
的目的除了可以增强H2O2的氧化性外,还可以___________ 。
(5)“沉铁”后的滤液中阴离子除了 外,还检验出
外,还检验出 和
和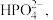 写出“沉铁”反应的离子方程式:
写出“沉铁”反应的离子方程式:___________ 。
(6)“高温煅烧”条件下,由 制备
制备 ,理论上
,理论上 和
和 的投料比为
的投料比为
___________ 。
(7) 的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时
的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时 脱出部分Li⁺形成
脱出部分Li⁺形成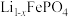 ,结构如图b所示,则
,结构如图b所示,则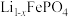 中
中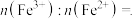
___________ (填最简整数比)。
 )的需求量也随之增加。以硫铁矿(主要成分是
)的需求量也随之增加。以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 为原料制备)
为原料制备) 的流程如图所示:
的流程如图所示:
| 金属氢氧化物 |  |  |  |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 |
(1)写出磷酸铁锂中相应价态基态铁离子的电子排布式:
(2)“焙烧”生成
 的化学方程式为
的化学方程式为(3)“还原”选用足量FeS的优点是
(4)“氧化”加入
 的目的除了可以增强H2O2的氧化性外,还可以
的目的除了可以增强H2O2的氧化性外,还可以(5)“沉铁”后的滤液中阴离子除了
 外,还检验出
外,还检验出 和
和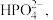 写出“沉铁”反应的离子方程式:
写出“沉铁”反应的离子方程式:(6)“高温煅烧”条件下,由
 制备
制备 ,理论上
,理论上 和
和 的投料比为
的投料比为
(7)
 的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时
的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时 脱出部分Li⁺形成
脱出部分Li⁺形成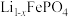 ,结构如图b所示,则
,结构如图b所示,则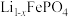 中
中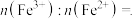

您最近一年使用:0次
解题方法
2 .  还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。
 还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。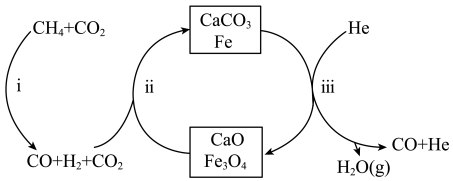
A.该反应的催化剂为 和 和 |
| B.过程iii在恒压条件下通入He,有利于增加CO的产量 |
| C.过程i、ii、iii均涉及置换反应 |
D.每生成4mol的CO,转移的电子数约为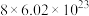 |
您最近一年使用:0次
名校
解题方法
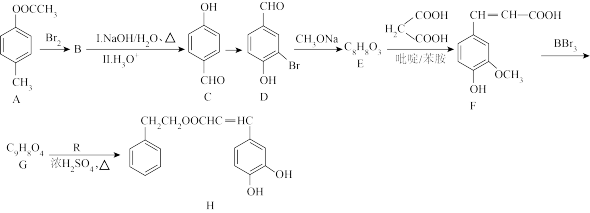
3 . 以乙酸—4—甲基苯酚酯(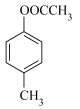 )为主要原料,可以合成重要的医药中间体H(
)为主要原料,可以合成重要的医药中间体H(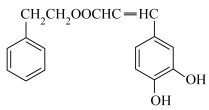 ),其合成线路如下:
),其合成线路如下:
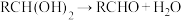 。
。②
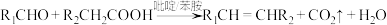 。
。③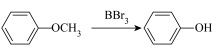
(1)C的化学名称为
(2)
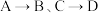 的反应类型相同,均属于
的反应类型相同,均属于 的反应条件为
的反应条件为(3)H中含氧官能团名称为
(4)
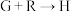 的化学方程式为
的化学方程式为(5)M是R的同分异构体,遇氯化铁溶液发生显色反应,则符合条件的M的结构可能有
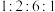 的结构简式为
的结构简式为
您最近一年使用:0次
2024-05-06更新
|
164次组卷
|
3卷引用:2024届山西省晋中市平遥县第二中学校高三下学期冲刺调研押题卷理综(二)-高中化学
2024届山西省晋中市平遥县第二中学校高三下学期冲刺调研押题卷理综(二)-高中化学(已下线)江苏省淮安市淮海中学2024届高三下学期第三次模拟考试化学试题广西壮族自治区贵港市2024届高三下学期收网考化学试题
解题方法
4 . 有一种有机三元弱酸广泛存在于水果中,用 表示,
表示, 时,用
时,用 调节
调节 溶液的
溶液的 ,溶液中含各种微粒的分布系数
,溶液中含各种微粒的分布系数 与
与 的关系如图所示[比如
的关系如图所示[比如 的分布系数:
的分布系数: ],下列叙述正确的是
],下列叙述正确的是
 表示,
表示, 时,用
时,用 调节
调节 溶液的
溶液的 ,溶液中含各种微粒的分布系数
,溶液中含各种微粒的分布系数 与
与 的关系如图所示[比如
的关系如图所示[比如 的分布系数:
的分布系数: ],下列叙述正确的是
],下列叙述正确的是
A.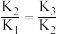 | B.曲线1代表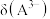 ,曲线4代表 ,曲线4代表 |
C.反应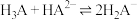 的 的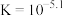 | D.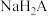 溶液、 溶液、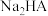 溶液都显酸性 溶液都显酸性 |
您最近一年使用:0次
解题方法
5 . 在催化剂表面,一种合成碳酸二甲酯的反应机理如图,下列说法错误的是
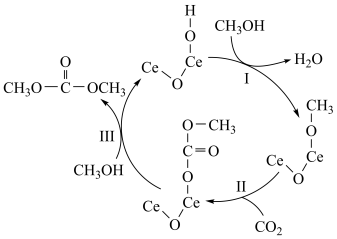
A.该反应总方程式为2CH3OH+CO2 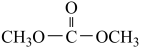 +H2O +H2O |
| B.该反应有利于碳中和和碳达峰 |
| C.反应Ⅲ为取代反应 |
D. 中均有 中均有 键的断裂 键的断裂 |
您最近一年使用:0次
6 . 某种新型治疗类风湿性关节炎的药物合成路线如下,下列说法错误的是
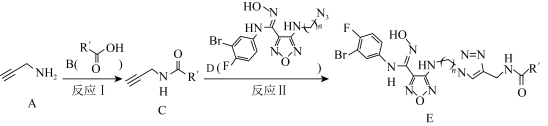
| A.反应I为取代反应,反应II为加成反应 | B.物质D中,N的杂化方式有三种 |
| C.物质A还可以和溴水、酸性高锰酸钾溶液以及氨基酸反应 | D. 物质E中的卤原子发生水解,最多可消耗 物质E中的卤原子发生水解,最多可消耗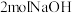 |
您最近一年使用:0次
2024-05-06更新
|
199次组卷
|
3卷引用:2024届山西省晋中市平遥县第二中学校高三下学期冲刺调研押题卷理综(二)-高中化学
2024届山西省晋中市平遥县第二中学校高三下学期冲刺调研押题卷理综(二)-高中化学(已下线)江苏省淮安市淮海中学2024届高三下学期第三次模拟考试化学试题辽宁省沈阳市第二中学2023-2024学年高三下学期第五次模拟考试化学试卷
名校
解题方法
7 . 某离子液体结构如下图所示。W、X、Y、Z、M位于短周期,原子序数依次增大,X基态原子的核外有3种能量不同的电子,且每种数目相同,Y和M同主族,原子序数之和为22,Z基态原子核外有1个未成对电子。下列说法错误的是
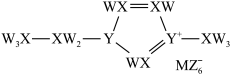
| A.Y、X的简单氢化物沸点:X<Y | B.电负性:Z>Y>M |
| C.第一电离能:Z>Y | D.该离子液体中Y的杂化类型都是sp2 |
您最近一年使用:0次
2024-05-02更新
|
284次组卷
|
3卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
山西省平遥中学2023-2024学年高三二模考试化学试题2024届山西省省级名校高三下学期第二次联考l理科综合试题-高中化学(已下线)押题卷02(15+4题型) -2024高考化学考点必杀300题(新高考通用)
名校
8 . 立方晶系Sb2O3对光稳定,是制备聚对苯二甲酸乙二醇酯的优良催化剂。制备的实验步骤如下:
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器a中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。
①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水。
回答下列问题:
(1)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式___________ 。
(2)仪器a的名称为___________ ,装置B的作用为___________ 。
(3)洗涤时Sb2O3晶体洗净的判断标准是___________ 。
(4)烘干时,晶体装在___________ (填仪器名称)。
(5)如果将乙二醇改为乙醇用上述同样方法制备,往往得到Sb2O3混晶,解释原因___________ 。
(6)用___________ 法可以测定Sb2O3是混晶还是单晶。
(7)取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol·L-1碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为 。
。
①滴定终点现象是___________ 。
②产品中Sb元素的质量分数是___________ 。
①按下图装置安装仪器(加热仪器略),添加试剂,通入NH3,得到固液混合物。
②向容器a中加入一定量的蒸馏水,搅拌一段时间,过滤、洗涤、110℃烘干。

①SbCl3易水解成SbOCl,SbOCl难溶于乙醇、能溶于乙二醇,SbOCl也可水解为Sb2O3,但如果反应只发生在表面,则得不到单一晶型。
②无水乙醇和乙二醇都可能含少量水。
回答下列问题:
(1)步骤①生成Sb2(OCH2CH2O)3,写出化学方程式
(2)仪器a的名称为
(3)洗涤时Sb2O3晶体洗净的判断标准是
(4)烘干时,晶体装在
(5)如果将乙二醇改为乙醇用上述同样方法制备,往往得到Sb2O3混晶,解释原因
(6)用
(7)取mg产品于锥形瓶中,用盐酸等试剂预处理后,用amol·L-1碘标准液滴定。接近终点时加入2滴淀粉溶液,继续滴定至终点,消耗碘标准液VmL。反应原理为
 。
。①滴定终点现象是
②产品中Sb元素的质量分数是
您最近一年使用:0次
2024-05-01更新
|
263次组卷
|
3卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
9 . CO2和CH4合成CH3COOH对实现“碳中和”目标具有重要意义。回答下列问题:
(1)25℃时,CH4和CH3COOH的燃烧热分别为890.3kJ·mol-1和873.7kJ·mol-1,写出CO2和CH4合成CH3COOH(l)的热化学方程式___________ 。
(2)在硫酸酸化的ZrO2催化剂表面发生反应时,涉及多个基元反应,反应经历pathA,pathB两个路径,其能量变化如下图所示。吸附在催化剂表面的物种用*标注,TS1、TS2、TS3表示过渡态。___________ (填“放出热量”或“吸收热量”)。
②上述基元反应pathA路径中,速率最慢的一步的反应方程式为___________ 。
③pathA和pathB路径相比,___________ 更容易进行。
(3)已知 能自发进行,
能自发进行,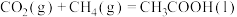
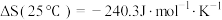 ,下列说法正确的是___________。
,下列说法正确的是___________。
(4)以CuO-ZrO2作催化剂,CO2、CH4投料比为1:1,300℃反应,平衡时CH4转化率为12%,CH3COOH选择性为95%,则CH3COOH的平衡产率为___________ 。(选择性指转化为目标产物的某反应物的质量与发生反应的该反应物的质量之比)
(5)立方ZrO2的晶胞如图,晶胞参数为apm,O2-和Zr4+间的最小距离为___________ pm,晶体密度为___________ g·cm-3。(列出计算式,阿伏加德罗常数的值用 表示)
表示)
(1)25℃时,CH4和CH3COOH的燃烧热分别为890.3kJ·mol-1和873.7kJ·mol-1,写出CO2和CH4合成CH3COOH(l)的热化学方程式
(2)在硫酸酸化的ZrO2催化剂表面发生反应时,涉及多个基元反应,反应经历pathA,pathB两个路径,其能量变化如下图所示。吸附在催化剂表面的物种用*标注,TS1、TS2、TS3表示过渡态。
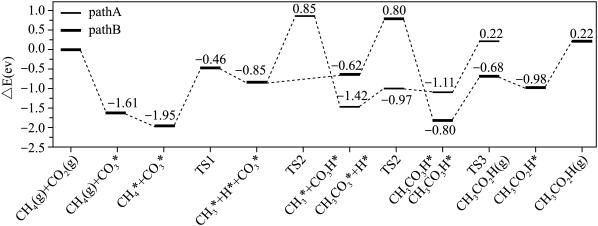
②上述基元反应pathA路径中,速率最慢的一步的反应方程式为
③pathA和pathB路径相比,
(3)已知
 能自发进行,
能自发进行,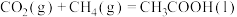
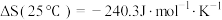 ,下列说法正确的是___________。
,下列说法正确的是___________。| A.25℃时,该反应能自发进行 |
| B.降低温度能提高CH4的平衡转化率 |
C. ,反应达平衡状态 ,反应达平衡状态 |
| D.温度越高反应速率越快 |
(4)以CuO-ZrO2作催化剂,CO2、CH4投料比为1:1,300℃反应,平衡时CH4转化率为12%,CH3COOH选择性为95%,则CH3COOH的平衡产率为
(5)立方ZrO2的晶胞如图,晶胞参数为apm,O2-和Zr4+间的最小距离为
 表示)
表示)
您最近一年使用:0次
2024-04-21更新
|
182次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
名校
10 . 铜是使用广泛的一种金属。下图是某高砷银铜精矿制取铜、银的工艺。该矿石的主要成分是CuS,还含有Ag、As、Ca、Si、Al等的化合物。
①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②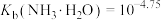 。
。
③萃取原理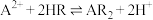 。
。
回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为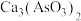 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式___________ 。
(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是___________ 。
(3)写出氨浸铜反应的离子方程式___________ 。氨铵比1:1时氨浸铜效果最好,此时溶液pH=___________ 。
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为___________ ,萃取时萃取剂分子中___________ 键断裂。___________ 。
(6)浸银液含 ,还原时氧化产物为
,还原时氧化产物为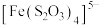 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为___________ 。

①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②
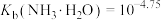 。
。③萃取原理
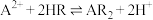 。
。回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为
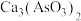 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是
(3)写出氨浸铜反应的离子方程式
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为
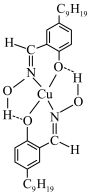
(6)浸银液含
 ,还原时氧化产物为
,还原时氧化产物为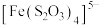 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
2024-04-21更新
|
208次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题



