名校
1 . 工业上可采用还原法处理一氧化氮气体,其原理为 ,该反应为放热反应。经实验证明,正反应速率可以表示为
,该反应为放热反应。经实验证明,正反应速率可以表示为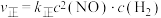 ,逆反应速率可以表示为
,逆反应速率可以表示为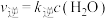 ,
, 、
、 为速率常数,与浓度无关。下列有关说法错误的是
为速率常数,与浓度无关。下列有关说法错误的是
 ,该反应为放热反应。经实验证明,正反应速率可以表示为
,该反应为放热反应。经实验证明,正反应速率可以表示为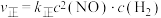 ,逆反应速率可以表示为
,逆反应速率可以表示为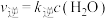 ,
, 、
、 为速率常数,与浓度无关。下列有关说法错误的是
为速率常数,与浓度无关。下列有关说法错误的是| A.压缩容器的容积,正逆反应速率都增大,且正反应速率增大的倍数较大 |
| B.当反应达到平衡时,各物质的浓度不再改变,反应停止 |
| C.若反应在恒容密闭容器中进行,通入He后正逆反应速率都不变 |
D.该反应中2mol NO(g)和2mol  的总能量大于1mol 的总能量大于1mol  和2mol 和2mol  的总能量 的总能量 |
您最近一年使用:0次
2024-04-21更新
|
112次组卷
|
2卷引用:宁夏回族自治区石嘴山市平罗县平罗中学2023-2024学年高二下学期5月期中化学试题
名校
2 . 氢能新质生产力正加速发展。工业上利用天然气制备氢气,还能得到乙烯、乙炔等化工产品,有关反应原理如下:
反应①:2CH4(g) C2H2(g)+3H2(g) ∆H1=+376.3kJ/mol K1;
C2H2(g)+3H2(g) ∆H1=+376.3kJ/mol K1;
反应②:2CH4(g) C2H4(g)+2H2(g) ∆H2=+202.0kJ/mol K2;
C2H4(g)+2H2(g) ∆H2=+202.0kJ/mol K2;
回答下列问题:
(1)反应③:C2H2(g)+2H2(g) C2H4(g) ∆H3=
C2H4(g) ∆H3=___________ kJ/mol,K3=___________ (用含K1、K2的代数式表示)。
(2)若用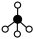 、
、 、
、 和
和 表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应①,从吸附到解吸的过程中,能量状态最高的是
表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应①,从吸附到解吸的过程中,能量状态最高的是___________ (填字母)。___________ T2(填“>”“<”或“=”)。
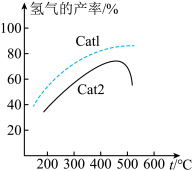
(4)向恒温恒容密闭容器中充入适量CH4,同时发生上述反应①和反应②,在不同催化剂Cat1、Cat2作用下,测得单位时间内H2的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是___________ (填“Cat1”或“Cat2”)。在Cat2作用下,温度高于500℃时,H2的产率迅速降低的原因是___________ 。 C2H2(g)+H2(g)制备氢气。
C2H2(g)+H2(g)制备氢气。
①实际操作中,往往向反应器中充入一定量的水蒸气,其目的是___________ 。
②忽略其他副反应,若向反应器中充入5mol水蒸气,平衡时(C2H4的转化率为75%,则该反应的Kp=___________ 。
反应①:2CH4(g)
 C2H2(g)+3H2(g) ∆H1=+376.3kJ/mol K1;
C2H2(g)+3H2(g) ∆H1=+376.3kJ/mol K1;反应②:2CH4(g)
 C2H4(g)+2H2(g) ∆H2=+202.0kJ/mol K2;
C2H4(g)+2H2(g) ∆H2=+202.0kJ/mol K2;回答下列问题:
(1)反应③:C2H2(g)+2H2(g)
 C2H4(g) ∆H3=
C2H4(g) ∆H3=(2)若用
 、
、 、
、 和
和 表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应①,从吸附到解吸的过程中,能量状态最高的是
表示CH4、C2H2、H2和固体催化剂,如图在催化剂表面进行反应①,从吸附到解吸的过程中,能量状态最高的是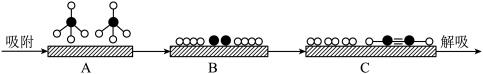
(4)向恒温恒容密闭容器中充入适量CH4,同时发生上述反应①和反应②,在不同催化剂Cat1、Cat2作用下,测得单位时间内H2的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是
 C2H2(g)+H2(g)制备氢气。
C2H2(g)+H2(g)制备氢气。①实际操作中,往往向反应器中充入一定量的水蒸气,其目的是
②忽略其他副反应,若向反应器中充入5mol水蒸气,平衡时(C2H4的转化率为75%,则该反应的Kp=
您最近一年使用:0次
2024-04-20更新
|
178次组卷
|
3卷引用:宁夏回族自治区石嘴山市平罗县平罗中学2023-2024学年高二下学期5月期中化学试题
名校
解题方法
3 . 过渡金属铬、铅、镍、铁及其化合物在工业上有重要用途,回答下列问题:
(1)基态Cr原子的价层电子的轨道表示式为___________ 。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由 与尿素[
与尿素[ ]反应先得到配合物
]反应先得到配合物 ,然后正通有
,然后正通有 和
和 混合气体的反应炉内热分解制得。
混合气体的反应炉内热分解制得。
①尿素中C、N、O三种元素的第一电离能由大到小的顺序为___________ 。
② 中存在的化学键有
中存在的化学键有___________ (填字母)。
A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图所示:
的熔点如图所示: 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是___________ 。
②请解释 随原子序数的递增熔点变化的原因
随原子序数的递增熔点变化的原因___________ 。
(4)丁二酮肟常与 形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
形成图A所示的配合物,图B是图A中硫代氧后的结构简式:___________ 。
(1)基态Cr原子的价层电子的轨道表示式为
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由
 与尿素[
与尿素[ ]反应先得到配合物
]反应先得到配合物 ,然后正通有
,然后正通有 和
和 混合气体的反应炉内热分解制得。
混合气体的反应炉内热分解制得。①尿素中C、N、O三种元素的第一电离能由大到小的顺序为
②
 中存在的化学键有
中存在的化学键有A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅
 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图所示:
的熔点如图所示:
 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是②请解释
 随原子序数的递增熔点变化的原因
随原子序数的递增熔点变化的原因(4)丁二酮肟常与
 形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
形成图A所示的配合物,图B是图A中硫代氧后的结构简式: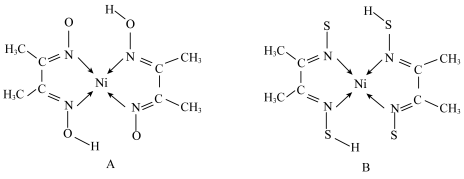
您最近一年使用:0次
4 . 铁及其化合物在生产生活中有重要应用。Fe的某种硫化物的晶胞如图所示,该晶胞为立方体,晶胞棱长为a nm。___________ 。
(2)下列说法正确的是___________。
(3)冰、金刚石、 、干冰4种晶体的熔点由高到低的顺序为
、干冰4种晶体的熔点由高到低的顺序为___________ 。
(4)已知阿伏加德罗常数的值为 ,该晶胞密度为
,该晶胞密度为___________ 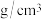 。(列出算式即可)
。(列出算式即可)
(5)在该晶胞中,每个 周围与它最近且等距的
周围与它最近且等距的 有
有___________ 个,下列属于从该晶体结构中分割出的部分结构图的是___________ 。(白球、黑球分别代表题中阴、阳离子)

(2)下列说法正确的是___________。
| A.该晶胞与NaCl晶胞结构相似 |
B.该晶体结构中存在 和 和 |
C. 之间最短距离为 之间最短距离为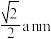 |
| D.该物质中含有离子键、共价键和分子间作用力 |
(3)冰、金刚石、
 、干冰4种晶体的熔点由高到低的顺序为
、干冰4种晶体的熔点由高到低的顺序为(4)已知阿伏加德罗常数的值为
 ,该晶胞密度为
,该晶胞密度为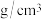 。(列出算式即可)
。(列出算式即可)(5)在该晶胞中,每个
 周围与它最近且等距的
周围与它最近且等距的 有
有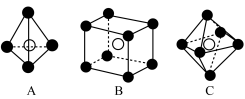
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.已知A、B、C、D、E为原子序数依次增大的短周期主族元素。其中A元素的一种同位素中没有中子,B元素原子的L层电子数是K层电子数的2倍,D元素是地壳中含他最多的元素,E的原子序数是A、C原子序数之和的2倍。回答下列问题:
(1)B元素在周期表中的位置是___________ ;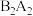 是由极性键和非极性键形成的
是由极性键和非极性键形成的___________ (填“极性”或“非极性”)分子。
(2)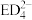 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为___________ ,VSEPR模型名称为___________ 。
(3)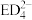 、
、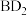 和
和 的键角由大到小的顺序是
的键角由大到小的顺序是___________ (用化学式表示)。
Ⅱ.研究发现,在低压合成甲醇反应(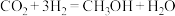 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(4)在 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为___________ 。
(5)1mol丙酮(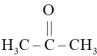 )分子中含有
)分子中含有 键的数目为
键的数目为___________ 。(设 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
(6)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝的晶体类型是___________ 。
(1)B元素在周期表中的位置是
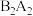 是由极性键和非极性键形成的
是由极性键和非极性键形成的(2)
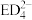 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为(3)
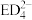 、
、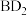 和
和 的键角由大到小的顺序是
的键角由大到小的顺序是Ⅱ.研究发现,在低压合成甲醇反应(
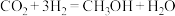 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:(4)在
 低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为(5)1mol丙酮(
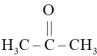 )分子中含有
)分子中含有 键的数目为
键的数目为 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)(6)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝的晶体类型是
您最近一年使用:0次
名校
6 . 原子结构与元素周期表存在着内在联系。根据已学知识,请回答下列问题:
(1)基态N原子电子占据___________ 个能层,电子占据的最高能级的符号是___________ ;基态N原子共有___________ 种不同空间运动状态的电子。
(2)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:___________ ,位于元素周期表的___________ 区。
(3)比较Cu和Zn的第二电离能大小[用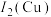 和
和 表示]:
表示]:___________ 。
(4)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填选项)。
(5)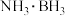 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(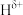 ),与B原子相连的H负电性(
),与B原子相连的H负电性(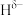 )。在H、B、N三种元素中,电负性由大到小的顺序是
)。在H、B、N三种元素中,电负性由大到小的顺序是___________ 。
(1)基态N原子电子占据
(2)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:
(3)比较Cu和Zn的第二电离能大小[用
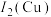 和
和 表示]:
表示]:(4)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填选项)。
A.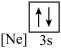 | B.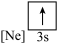 | C. | D.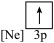 |
(5)
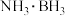 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(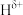 ),与B原子相连的H负电性(
),与B原子相连的H负电性(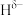 )。在H、B、N三种元素中,电负性由大到小的顺序是
)。在H、B、N三种元素中,电负性由大到小的顺序是
您最近一年使用:0次
名校
解题方法
7 . 下列各图表示物质的某种性质与核电荷数的关系(Z为核电荷数,从第二周期开始,Y为元素的有关性质),下列选项中的对应关系不正确的是
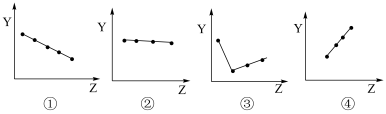
| A.图①可表示碱金属单质的熔点大小关系 |
| B.图②可表示ⅥA族元素的价电子数关系 |
| C.图③可表示ⅥA族元素的简单氢化物的沸点高低关系 |
| D.图④可表示ⅦA族元素的简单氢化物稳定性大小关系 |
您最近一年使用:0次
名校
解题方法
8 . Cu和O形成某种晶体的晶胞结构如图所示,下列说法中正确的是
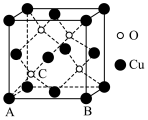
A.该物质的化学式为 |
B.该晶胞原子坐标参数A为(0,0,0),B为(1,0,0),则C的坐标参数为(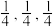 ) ) |
| C.离每个O原子最近的O原子数为8 |
D.若晶胞棱长为a pm,则该晶体的密度为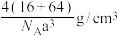 |
您最近一年使用:0次
9 . 下列选项中各物质的化学键类型相同、晶体类型也相同的是
A.HCHO、 、 、 | B.金刚石、 、 、 |
C. 、 、 、 、 | D. 、Ar、Cu、 、Ar、Cu、 |
您最近一年使用:0次
名校
解题方法
10 . 下列关于物质的结构或性质的比较中,错误的是
A. 的键角比 的键角比 大 大 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
C. 、MgO、 、MgO、 三者的晶体类型和化学键类型完全相同 三者的晶体类型和化学键类型完全相同 |
| D.金属晶体具有良好的延展性,是因为金属键具有方向性 |
您最近一年使用:0次



