解题方法
1 . 硫及其化合物是十分重要的化工原料。
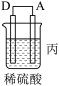
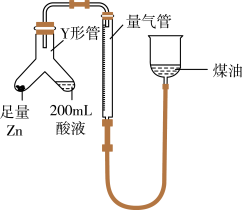
(1)某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):__________ (填字母)。
②已知开始时量气管读数为 ,最终读数为
,最终读数为 (均折合成标准状况,且
(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为__________  。
。
(2)已知 具有还原性,可以还原
具有还原性,可以还原 ,也可以与
,也可以与 发生反应。
发生反应。
①将 通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明
通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明 与
与 反应无
反应无 生成,可能发生反应的化学方程式为
生成,可能发生反应的化学方程式为__________ 。
②将 通入装有碘水(含淀粉)的洗气瓶中,若
通入装有碘水(含淀粉)的洗气瓶中,若__________ ,说明还原性: ,写出该反应的离子方程式:
,写出该反应的离子方程式:__________ 。
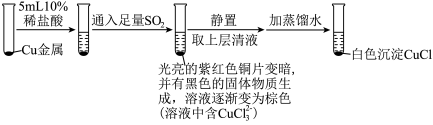
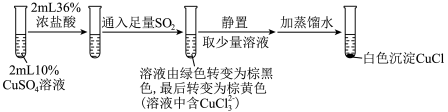
(3)为探究 在盐酸中与Cu、
在盐酸中与Cu、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。
实验Ⅰ: ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。
。
①实验Ⅰ通入 时反应的离子方程式为
时反应的离子方程式为__________ ,实验Ⅱ通入 时反应的离子方程式为
时反应的离子方程式为__________ 。
②实验Ⅱ若消耗__________  ,则生成
,则生成 个
个 。
。
(1)某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):
②已知开始时量气管读数为
 ,最终读数为
,最终读数为 (均折合成标准状况,且
(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为 。
。(2)已知
 具有还原性,可以还原
具有还原性,可以还原 ,也可以与
,也可以与 发生反应。
发生反应。①将
 通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明
通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。若木条不复燃,则说明 与
与 反应无
反应无 生成,可能发生反应的化学方程式为
生成,可能发生反应的化学方程式为②将
 通入装有碘水(含淀粉)的洗气瓶中,若
通入装有碘水(含淀粉)的洗气瓶中,若 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(3)为探究
 在盐酸中与Cu、
在盐酸中与Cu、 的反应,某实验小组设计如图实验。
的反应,某实验小组设计如图实验。实验Ⅰ:
 ,实验Ⅰ中得到的黑色固体为
,实验Ⅰ中得到的黑色固体为 。
。①实验Ⅰ通入
 时反应的离子方程式为
时反应的离子方程式为 时反应的离子方程式为
时反应的离子方程式为②实验Ⅱ若消耗
 ,则生成
,则生成 个
个 。
。
您最近一年使用:0次
2 . 有机物在生产生活中应用广泛,某实验小组以“有机物结构的测定方法”和“配合物结构的测定方法”为研究课题设计了如下实验。
I.有机物结构的确定方法
①取6.8g该有机物A试样通过上述装置完全反应,装置甲增重3.6g,装置乙增重17.6g。
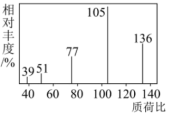
②用质谱仪测定有机物A的相对分子质量,得到如图所示的质谱图。
③用核磁共振仪处理该化合物,所得核磁共振氢谱图中4组峰的面积之比是1:2:2:3。
(1)若没有装置丙,可能带来的影响是___________ 。
(2)由上述已知条件可推出有机物A的分子式为___________ 。
(3)已知有机物A属于芳香族化合物,与乙酸的官能团种类相同,请写出其结构简式:___________ 。
Ⅱ.配合物结构的测定方法
已知:①Co的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如: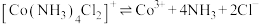 。
。
②下述实验所得样品中的Co元素为+3价,Co3+的配位数为6。
某兴趣小组用Cl-取代 离子中NH3制得配合物
离子中NH3制得配合物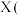 化学式为
化学式为 。该实验小组用以下方法测定所得配合物的组成。
。该实验小组用以下方法测定所得配合物的组成。
实验步骤:取mgX样品加入过量浓NaOH溶液,煮沸,将生成的NH3通入20mL0.20mol/L的稀硫酸(过量)中,再用0.1000mol/LNaOH标准溶液滴定剩余H2SO4溶液。
(4)该配合物中,配体NH3分子中的配位原子为___________ 原子(填原子符号)。
(5)若滴定过程平均消耗NaOH标准溶液20.00mL,则样品中含有NH3的物质的量为___________ mol。
(6)为了减小实验误差,上述中和滴定实验应选择___________ (填“甲基橙”或“酚酞”)做指示剂。
(7)另取mgX样品,加入过量HNO3酸化后,用AgNO3溶液滴定测得n(Cl-)=0.0036mol。请用配合物的形式表示该样品的组成:___________ 。
I.有机物结构的确定方法
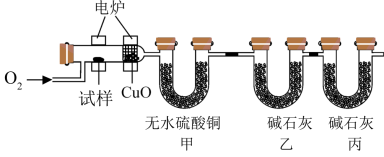
①取6.8g该有机物A试样通过上述装置完全反应,装置甲增重3.6g,装置乙增重17.6g。
②用质谱仪测定有机物A的相对分子质量,得到如图所示的质谱图。
③用核磁共振仪处理该化合物,所得核磁共振氢谱图中4组峰的面积之比是1:2:2:3。
(1)若没有装置丙,可能带来的影响是
(2)由上述已知条件可推出有机物A的分子式为
(3)已知有机物A属于芳香族化合物,与乙酸的官能团种类相同,请写出其结构简式:
Ⅱ.配合物结构的测定方法
已知:①Co的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如:
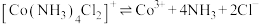 。
。②下述实验所得样品中的Co元素为+3价,Co3+的配位数为6。
某兴趣小组用Cl-取代
 离子中NH3制得配合物
离子中NH3制得配合物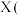 化学式为
化学式为 。该实验小组用以下方法测定所得配合物的组成。
。该实验小组用以下方法测定所得配合物的组成。实验步骤:取mgX样品加入过量浓NaOH溶液,煮沸,将生成的NH3通入20mL0.20mol/L的稀硫酸(过量)中,再用0.1000mol/LNaOH标准溶液滴定剩余H2SO4溶液。
(4)该配合物中,配体NH3分子中的配位原子为
(5)若滴定过程平均消耗NaOH标准溶液20.00mL,则样品中含有NH3的物质的量为
(6)为了减小实验误差,上述中和滴定实验应选择
(7)另取mgX样品,加入过量HNO3酸化后,用AgNO3溶液滴定测得n(Cl-)=0.0036mol。请用配合物的形式表示该样品的组成:
您最近一年使用:0次
2024-05-04更新
|
338次组卷
|
3卷引用:江西省南昌市第二中学2023-2024学年高二下学期月考化学试卷
名校
3 . 现代社会活动需要利用化学反应中的物质和能量变化。
Ⅰ.化学能与热能
下表中的数据是破坏1mol物质中的化学键所消耗的能量,回答下列问题:
(1)以上物质中最不稳定的是___________ 。
(2)按照反应 ,生成2mol HCl
,生成2mol HCl_________ (填“吸收”或“放出”)的热量为_________ kJ。根据能量守恒定律,反应物的总能量应该___________ 其生成物的总能量(填“大于”或“小于”)。
Ⅱ.化学能与电能
(3)把A、B、C、D四种金属按表中装置进行实验。
根据表中信息判断四种金属活动性由大到小的顺序是________________ 。
(4)“乙醇燃料电池”的工作原理为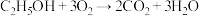 ,装置如图所示。
,装置如图所示。 的移动方向为由
的移动方向为由_______ (填“A到B”或“B到A”)。写出A电极的电极反应式:_____________ 。
②若标况下有11.2L 参与反应,理论上通过质子交换膜的
参与反应,理论上通过质子交换膜的 数目为
数目为_______ 。
Ⅰ.化学能与热能
下表中的数据是破坏1mol物质中的化学键所消耗的能量,回答下列问题:
物质 |
|
|
|
| HCl |
键能/kJ | 243 | 193 | 151 | 436 | 432 |
(1)以上物质中最不稳定的是
(2)按照反应
 ,生成2mol HCl
,生成2mol HClⅡ.化学能与电能
(3)把A、B、C、D四种金属按表中装置进行实验。
装置 |
|
|
|
A表面有气泡 | B电极的质量增加 | 电子由A到D |
(4)“乙醇燃料电池”的工作原理为
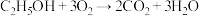 ,装置如图所示。
,装置如图所示。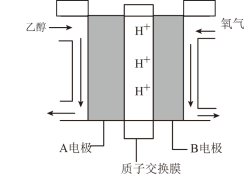
 的移动方向为由
的移动方向为由②若标况下有11.2L
 参与反应,理论上通过质子交换膜的
参与反应,理论上通过质子交换膜的 数目为
数目为
您最近一年使用:0次
2024-05-04更新
|
372次组卷
|
3卷引用:贵州省贵阳市第一中学2023-2024学年高一下学期教学质量监测卷(三)化学试题
贵州省贵阳市第一中学2023-2024学年高一下学期教学质量监测卷(三)化学试题(已下线)猜想04 化学反应与热能、电能(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)名校期末好题汇编-化学反应与能量(非选择题)
4 . 氨气在工农业生产中有重要应用。
(1)工业合成氨的化学方程式为___________ 。
(2)某化学小组同学利用以下装置制备氨气,并探究氨气的性质(夹持仪器略)。___________ 。
②用装置B收集氨时,进气口是___________ (选填“a”或“b”)。打开装置B中的活塞c,烧瓶内产生了红色喷泉,则说明氨具有的性质是___________ ,___________ 。
③向C中NaOH固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为___________ ,检验白烟中阳离子的方法是:取少量白烟于试管中,___________ 。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有___________ 和4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(1)工业合成氨的化学方程式为
(2)某化学小组同学利用以下装置制备氨气,并探究氨气的性质(夹持仪器略)。
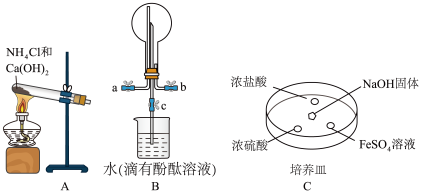
②用装置B收集氨时,进气口是
③向C中NaOH固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为
您最近一年使用:0次
2024-05-04更新
|
85次组卷
|
2卷引用:北京市陈经纶中学2023-2024学年高一下学期期中诊断化学试卷
2024高三下·全国·专题练习
5 . Ⅰ.随着碳中和目标的提出,CO2回收技术已成为科学研究热点问题,其中逆水煤气变换反应引起了广泛关注。该反应是将CO2加氢转化为CH3OH等高附加值化学品的关键步骤。
在催化剂作用下,逆水煤气变换体系中存在以下反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
②CO2(g)+H2(g) CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
③CO2(g)+2H2(g) CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
(1)K1=___________ (用K2、K3表示)。
Ⅱ.将6 mol CO2和8 mol H2充入容积为2L的密闭容器中,分别在T1、T2温度下发生反应①,H2的物质的量变化如表所示:
(2)T1温度下,5~10min内以CO2表示该反应速率v(CO2)=___________ 。该温度下,若各物质的起始量n(CO2) = n(H2) = n(CH3OH) = n(H2O) = 2 mol,则v(正)___________ v(逆)。
A.> B.= C.<
(3)下列说法正确的是___________。
Ⅲ.一定条件下,将原料气n(CO2)∶n(H2)=1∶3进行投料,在恒容密闭容器中模拟上述三个反应,CO和CH3OH在含碳产物(CH3OH和CO)中物质的量分数及CO2的平衡转化率随温度变化的情况如图所示___________ 。曲线___________ 代表CH3OH在含碳产物中物质的量分数。
A.m B.n
(5)有利于提高CO2转化为CH3OH的平衡转化率的措施有___________。
在催化剂作用下,逆水煤气变换体系中存在以下反应:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1②CO2(g)+H2(g)
 CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2③CO2(g)+2H2(g)
 CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3(1)K1=
Ⅱ.将6 mol CO2和8 mol H2充入容积为2L的密闭容器中,分别在T1、T2温度下发生反应①,H2的物质的量变化如表所示:
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| H2 | 8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 |
A.> B.= C.<
(3)下列说法正确的是___________。
| A.T1 < T2 |
| B.混合气体的密度保持不变时,反应已达到平衡 |
| C.平衡后向容器中充入稀有气体,平衡不发生移动 |
| D.加入合适的催化剂可以降低反应的活化能,∆H减小 |
Ⅲ.一定条件下,将原料气n(CO2)∶n(H2)=1∶3进行投料,在恒容密闭容器中模拟上述三个反应,CO和CH3OH在含碳产物(CH3OH和CO)中物质的量分数及CO2的平衡转化率随温度变化的情况如图所示
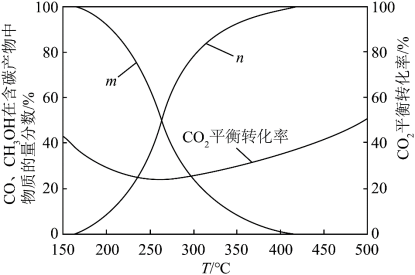
A.m B.n
(5)有利于提高CO2转化为CH3OH的平衡转化率的措施有___________。
| A.使用催化性能好的催化剂 | B.降低反应温度 |
| C.投料比不变,增加反应物的浓度 | D.增大CO2和H2的初始投料比 |
您最近一年使用:0次
6 . 纳米氧化锌具有颗粒微小、比表面积大、分散性好、疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
铜转炉烟灰主要化学成分分析结果/%
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃,浸出率随温度升高而降低的原因可能是___________ 。
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3作沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间。
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5,使还原产物为MnO2,滤渣2的主要成分为___________ (填化学式)。
(5)“还原沉降”选用的“试剂a”为___________ (填化学式)。
(6)“沉锌”反应的离子方程式为___________ 。
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整HCO 和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO
和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO 的浓度为
的浓度为___________ ,沉淀物的粒径最佳。
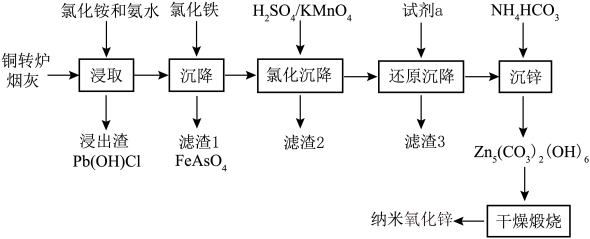
铜转炉烟灰主要化学成分分析结果/%
| Cu | Zn | Pb | Fe(Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2×10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3作沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5,使还原产物为MnO2,滤渣2的主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整HCO
 和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO
和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO 的浓度为
的浓度为n(HCO )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数/% | ||||
| 0.0~0.1μm | 0.1~0.5μm | 0.5~1.0μm | 1.0~5.0μm | 5.0μm以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
您最近一年使用:0次
2024高三·全国·专题练习
7 . 苯酚(C6H5OH)是一种广泛使用的化工产品,但若在水体中存在超标又会导致严重的污染。
Ⅰ.现有一种在一定温度下用某分子筛催化N2O废气氧化苯制备苯酚的新方法,方程式为C6H6(g)+N2O(g)⇌C6H5OH(g)+N2(g)。
(1)已知:①6C(s,石墨)+3H2(g)⇌C6H6(g);ΔH1=+82.9kJ·mol-1
②2N2(g)+O2(g)⇌2N2O(g);ΔH2=+163.2kJ·mol-1
③12C(s,石墨)+6H2(g)+O2(g)⇌2C6H5OH(g);ΔH3=-243kJ·mol-1
则C6H6(g)+N2O(g)⇌C6H5OH(g)+N2(g);ΔH=___________ 。
(2)以固定N2O和苯酚比例、恒定流速、O2加入量为1%的条件下,考查单因素改变反应温度时对N2O转化率和苯酚选择性的影响如图1和图2所示。___________ 。
②由图2可知,在648K和673K反应时,苯酚的选择性基本保持恒定,而在698K和723K时,苯酚选择性随着反应进行迅速下降,高温时苯酚选择性下降的原因可能是___________ 。
Ⅱ.以苯酚为原料化合成某有机物的反应机理如图3所示(图中个别反应物未列出,Ph为苯环):___________ 。
Ⅲ.Fenton试剂氧化法是一种很好的除去废水中苯酚的方法。Fe2+/H2O2联合处理有机废水时,Fe2++H2O2=Fe3++HO·+OH-,生成了氧化性能极强的HO·,使废水中的苯酚得到彻底降解。
(4)①·OH与苯酚反应的化学方程式为___________ 。
②H2O2在Fe3O4催化下除去废水中的苯酚的原理如图4所示。研究在不同初始pH条件下,苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是___________ 。
Ⅰ.现有一种在一定温度下用某分子筛催化N2O废气氧化苯制备苯酚的新方法,方程式为C6H6(g)+N2O(g)⇌C6H5OH(g)+N2(g)。
(1)已知:①6C(s,石墨)+3H2(g)⇌C6H6(g);ΔH1=+82.9kJ·mol-1
②2N2(g)+O2(g)⇌2N2O(g);ΔH2=+163.2kJ·mol-1
③12C(s,石墨)+6H2(g)+O2(g)⇌2C6H5OH(g);ΔH3=-243kJ·mol-1
则C6H6(g)+N2O(g)⇌C6H5OH(g)+N2(g);ΔH=
(2)以固定N2O和苯酚比例、恒定流速、O2加入量为1%的条件下,考查单因素改变反应温度时对N2O转化率和苯酚选择性的影响如图1和图2所示。
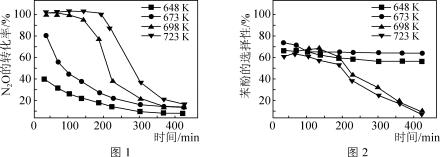
②由图2可知,在648K和673K反应时,苯酚的选择性基本保持恒定,而在698K和723K时,苯酚选择性随着反应进行迅速下降,高温时苯酚选择性下降的原因可能是
Ⅱ.以苯酚为原料化合成某有机物的反应机理如图3所示(图中个别反应物未列出,Ph为苯环):
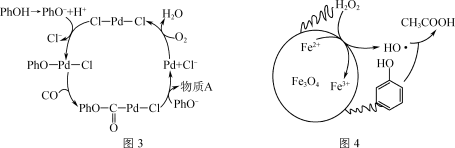
Ⅲ.Fenton试剂氧化法是一种很好的除去废水中苯酚的方法。Fe2+/H2O2联合处理有机废水时,Fe2++H2O2=Fe3++HO·+OH-,生成了氧化性能极强的HO·,使废水中的苯酚得到彻底降解。
(4)①·OH与苯酚反应的化学方程式为
②H2O2在Fe3O4催化下除去废水中的苯酚的原理如图4所示。研究在不同初始pH条件下,苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是
您最近一年使用:0次
2024高三·全国·专题练习
8 . 利用氧化锌烟尘(主要成分为ZnO、PbS、As2O3、Fe2O3、SiO2等)制备饲料级碱式氯化锌[Zn5(OH)8Cl2·H2O],其工艺流程如下:
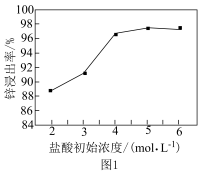
(1)“浸出”过程中的浸出液含有的阳离子是H+、Pb2+、As3+、Zn2+、Fe2+。锌的浸出率和盐酸浓度关系如图1所示;工业上,选择初始浓度为4 mol·L-1的原因是___________ 。___________ 。
(3)写出“除铅”的离子反应方程式:___________ ;若除铅后测得c(Zn2+)=0.36 mol·L-1,则溶液中c(Pb2+)=___________ mol·L-1[已知:Ksp(PbCO3)=7.20×10-14;Ksp(ZnCO3)=1.44×10-10]。
(4)“合成”时,总化学反应方程式为___________ 。
(5)用Zn5(OH)8Cl2·H2O制得纳米ZnO,其悬浊液可以用于吸收SO2尾气。已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的变化如图2所示。室温下,lgKa2(H2SO3)=
的物质的量分数随pH的变化如图2所示。室温下,lgKa2(H2SO3)=___________ ;在开始吸收的40 min内,溶液pH的变化如图3所示。0~10 min,该反应主要产物是___________ (填化学式);30 min以后阶段,发生的主要的化学反应方程式为___________ 。
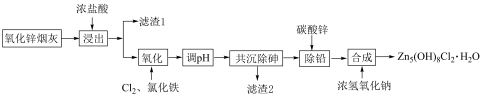
(1)“浸出”过程中的浸出液含有的阳离子是H+、Pb2+、As3+、Zn2+、Fe2+。锌的浸出率和盐酸浓度关系如图1所示;工业上,选择初始浓度为4 mol·L-1的原因是
(3)写出“除铅”的离子反应方程式:
(4)“合成”时,总化学反应方程式为
(5)用Zn5(OH)8Cl2·H2O制得纳米ZnO,其悬浊液可以用于吸收SO2尾气。已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH的变化如图2所示。室温下,lgKa2(H2SO3)=
的物质的量分数随pH的变化如图2所示。室温下,lgKa2(H2SO3)=
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
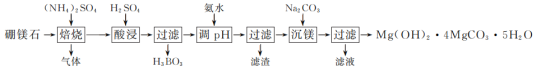
9 . 某以硼镁石[主要含MgB3O3(OH)5,还含少量Fe2O3、Al2O3]为原料制Mg(OH)2·4MgCO3·5H2O的工艺流程如下:___________ 。
(2)(NH4)2SO4焙烧分解得到NH3、H2O、SO2和N2四种物质,其中SO2和N2的体积比为___________ 。
(3)B2O3易溶于水,溶于水后生成硼酸H3BO3,硼酸在冷水中溶解度小,溶于水的硼酸可发生电离: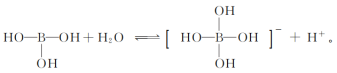 ,硼酸属于
,硼酸属于___________ 元酸。
(4)用氨水调pH的目的是沉淀Fe3+和Al3+,已知实验条件下,部分金属离子开始沉淀的pH和对应氢氧化物的Ksp如下表所示;溶液中金属离子浓度<1×10-5 mol·L-1,可以认为沉淀完全。
Fe3+刚好完全沉淀时溶液的pH为___________ ,调pH除去Fe3+和Al3+需控制的范围是___________ 。
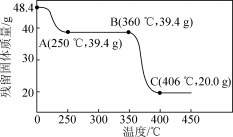
(5)取48.4 g Mg(OH)2·4MgCO3·5H2O加热分解,所得残留固体的质量与温度的关系如图所示。250℃时所得固体的成分为___________ 。
(2)(NH4)2SO4焙烧分解得到NH3、H2O、SO2和N2四种物质,其中SO2和N2的体积比为
(3)B2O3易溶于水,溶于水后生成硼酸H3BO3,硼酸在冷水中溶解度小,溶于水的硼酸可发生电离:
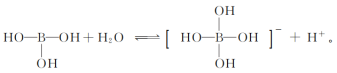 ,硼酸属于
,硼酸属于(4)用氨水调pH的目的是沉淀Fe3+和Al3+,已知实验条件下,部分金属离子开始沉淀的pH和对应氢氧化物的Ksp如下表所示;溶液中金属离子浓度<1×10-5 mol·L-1,可以认为沉淀完全。
| Mg2+ | Al3+ | Fe3+ | |
| 开始沉淀的pH | 8.6 | 3.7 | 2.2 |
| 氢氧化物的Ksp | 1×10-10.7 | 1×10-33 | 1×10-38 |
(5)取48.4 g Mg(OH)2·4MgCO3·5H2O加热分解,所得残留固体的质量与温度的关系如图所示。250℃时所得固体的成分为
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
10 . Co3O4在磁性材料、电化学领域应用广泛,实验室中可以用CoCO3或CoC2O4煅烧后制得。利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的流程如下:
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为_______ 。
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)2C2O4溶液,原因是_______ 。
(3)检验CoC2O4固体是否洗净的实验操作是_______ 。
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O,摩尔质量为183g·mol-1)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定。
④重复步骤③的实验两次,三次测定数据如下:
计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数_______ (写出计算过程)。
(5)以尿素为原料可获得CoCO3并制备Co3O4.已知:尿素水溶液在70℃以上能缓慢水解产生 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,_______ 。
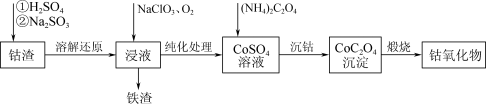
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)2C2O4溶液,原因是
(3)检验CoC2O4固体是否洗净的实验操作是
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O,摩尔质量为183g·mol-1)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定。
④重复步骤③的实验两次,三次测定数据如下:
| 实验序号 | 1 | 2 | 3 |
| 消耗FeSO4标准溶液体积/mL | 18.32 | 18.02 | 17.98 |
(5)以尿素为原料可获得CoCO3并制备Co3O4.已知:尿素水溶液在70℃以上能缓慢水解产生
 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
您最近一年使用:0次