名校
解题方法
1 .  和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为:
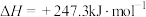 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热(25℃、101kPa):
则 燃烧热
燃烧热
_____  。
。
(2)其他条件相同,在不同催化剂(A、B)作用下,反应 进行相同时间后,CO的产率随反应温度的变化如图所示。
进行相同时间后,CO的产率随反应温度的变化如图所示。
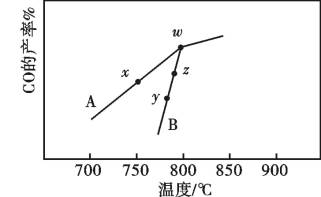
①由图可知,催化效果较好的催化剂是_____ ,在催化剂A、B作用下,它们反应活化能分别用 、
、 表示,则
表示,则
_____  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②w点_____ (填“能”或“不能”)表示上述反应达到平衡状态,理由是_____ 。
③速率大小比较:y点对应的
_____ z点对应的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)将原料 和
和 按等物质的量充入密闭容器中,保持体系压强为100kPa发生反应:
按等物质的量充入密闭容器中,保持体系压强为100kPa发生反应:
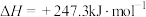 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
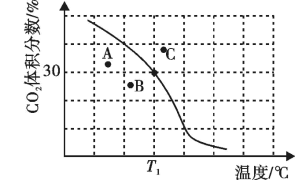
①若A、B、C三点表示不同温度和压强下达到平衡时 的体积分数,则
的体积分数,则_____ 点对应的平衡常数最小,理由是_____ 。
② 、100kPa下,达平衡时
、100kPa下,达平衡时 转化率=
转化率=_____ ;该温度下,此反应的平衡常数
_____  (以分压表示,分压=总压强×气体成分的物质的量分数)。
(以分压表示,分压=总压强×气体成分的物质的量分数)。
 和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为:
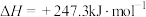 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(25℃、101kPa):
| 物质 |  |  |  |
燃烧热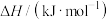 | ? | -283.0 | -285.8 |
 燃烧热
燃烧热
 。
。(2)其他条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,CO的产率随反应温度的变化如图所示。
进行相同时间后,CO的产率随反应温度的变化如图所示。
①由图可知,催化效果较好的催化剂是
 、
、 表示,则
表示,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②w点
③速率大小比较:y点对应的

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)将原料
 和
和 按等物质的量充入密闭容器中,保持体系压强为100kPa发生反应:
按等物质的量充入密闭容器中,保持体系压强为100kPa发生反应:
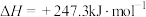 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①若A、B、C三点表示不同温度和压强下达到平衡时
 的体积分数,则
的体积分数,则②
 、100kPa下,达平衡时
、100kPa下,达平衡时 转化率=
转化率=
 (以分压表示,分压=总压强×气体成分的物质的量分数)。
(以分压表示,分压=总压强×气体成分的物质的量分数)。
您最近一年使用:0次
2023-12-21更新
|
604次组卷
|
6卷引用:2024届四川省内江市高中高三上学期第一次模拟考试(一模)理综试题
2024届四川省内江市高中高三上学期第一次模拟考试(一模)理综试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)山西省运城市盐湖区第五高级中学2023-2024学年高三上学期一轮复习检测卷宁夏石嘴山市第三中学2023-2024学年高三上学期第四次月考理科综合试卷宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期第四次月考理综试题江西省宜春市丰城市第九中学2023-2024学年高一上学期1月期末化学试题
解题方法
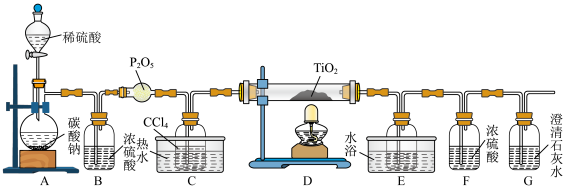
2 .  是制备钛及其化合物的重要中间体,实验室以
是制备钛及其化合物的重要中间体,实验室以 和
和 为原料制取液态
为原料制取液态 的装置如图所示(部分夹持装置省略)。
的装置如图所示(部分夹持装置省略)。
已知:有关物质的性质如表:
回答下列问题:
(1)装置A中盛装碳酸钠溶液的仪器名称为_____ 。
(2)补充并分析实验步骤:①连接好装置,_____ ;②向各装置中加入药品,重新连接好装置,拧开装置A中分液漏斗活塞,缓慢加入稀硫酸,待装置G中出现白色沉淀后,关闭分液漏斗活塞;③向C中注入热水并点燃D处酒精灯……(后续步骤略)。步骤②的作用是_____ 。
(3)装置C中热水浴的作用是_____ ;装置D中发生反应的化学方程式为_____ 。
(4)若缺少装置F,将观察到装置E中的现象是_____ 。
(5)从E处混合物中分离出 的实验方法是
的实验方法是_____ (填编号);
A.过滤 B.蒸发 C.蒸馏 D.分液
经分离提纯后得到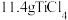 ,则本实验所得到的
,则本实验所得到的 的产率是
的产率是_____ 。
 是制备钛及其化合物的重要中间体,实验室以
是制备钛及其化合物的重要中间体,实验室以 和
和 为原料制取液态
为原料制取液态 的装置如图所示(部分夹持装置省略)。
的装置如图所示(部分夹持装置省略)。
已知:有关物质的性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
 | -23 | 76 | 与 互溶 互溶 |
 | -25 | 136 | 遇水极易水解,在550℃时能被氧气氧化 |
(1)装置A中盛装碳酸钠溶液的仪器名称为
(2)补充并分析实验步骤:①连接好装置,
(3)装置C中热水浴的作用是
(4)若缺少装置F,将观察到装置E中的现象是
(5)从E处混合物中分离出
 的实验方法是
的实验方法是A.过滤 B.蒸发 C.蒸馏 D.分液
经分离提纯后得到
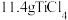 ,则本实验所得到的
,则本实验所得到的 的产率是
的产率是
您最近一年使用:0次
解题方法
3 . 五氧化二钒( )广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有
)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有 、
、 及少量
及少量 、
、 等杂质)回收
等杂质)回收 的部分工艺流程如图所示。
的部分工艺流程如图所示。
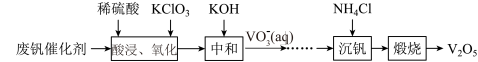
已知:常温下,部分含钒物质在水中的溶解性如表1;+5价钒在溶液中的主要存在形式与溶液pH的关系如表2。
表1
表2
回答下列问题:
(1) 中钒元素的化合价为
中钒元素的化合价为___________ ,其在水溶液中电离方程式为___________ 。
(2)工业生产中的钒催化剂一般以疏松多孔的硅藻土为载体,该做法的优点是___________ 。
(3)“酸浸、氧化”时溶液的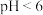 ,
, 转化为
转化为 ,
, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)“中和”时调节pH为7的目的是ⅰ.沉淀部分杂质离子,ⅱ.___________ 。
(5)“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入 生成
生成 ;“离子交换”和“洗脱”两步操作可简单表示为:
;“离子交换”和“洗脱”两步操作可简单表示为: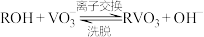 (ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,洗脱液为
(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,洗脱液为___________ (填字母),从化学平衡移动的角度解释选择该试剂的原因:___________ 。
A.稀 B.KOH溶液 C.KCl溶液
B.KOH溶液 C.KCl溶液
(6)“沉钒”前若滤液中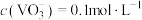 ,“沉钒”完成时,若上层清液中
,“沉钒”完成时,若上层清液中 ,则钒元素的沉降率=
,则钒元素的沉降率=___________ %[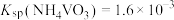 ,反应过程中溶液的体积不变]。
,反应过程中溶液的体积不变]。
(7)在Ar气氛中加热煅烧 ,升温过程中固体的质量变化如图所示,加热分解
,升温过程中固体的质量变化如图所示,加热分解 制备
制备 需要控制的温度为
需要控制的温度为___________ (填字母)。

A.250℃ B.350℃ C.450℃
 )广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有
)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有 、
、 及少量
及少量 、
、 等杂质)回收
等杂质)回收 的部分工艺流程如图所示。
的部分工艺流程如图所示。
已知:常温下,部分含钒物质在水中的溶解性如表1;+5价钒在溶液中的主要存在形式与溶液pH的关系如表2。
表1
| 物质 |  |  |  |  |
| 溶解性 | 难溶 | 可溶 | 易溶 | 难溶 |
| pH | <6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  | 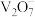 |  |
(1)
 中钒元素的化合价为
中钒元素的化合价为(2)工业生产中的钒催化剂一般以疏松多孔的硅藻土为载体,该做法的优点是
(3)“酸浸、氧化”时溶液的
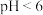 ,
, 转化为
转化为 ,
, 发生反应的离子方程式为
发生反应的离子方程式为(4)“中和”时调节pH为7的目的是ⅰ.沉淀部分杂质离子,ⅱ.
(5)“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入
 生成
生成 ;“离子交换”和“洗脱”两步操作可简单表示为:
;“离子交换”和“洗脱”两步操作可简单表示为: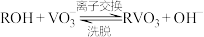 (ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,洗脱液为
(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,洗脱液为A.稀
 B.KOH溶液 C.KCl溶液
B.KOH溶液 C.KCl溶液(6)“沉钒”前若滤液中
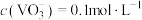 ,“沉钒”完成时,若上层清液中
,“沉钒”完成时,若上层清液中 ,则钒元素的沉降率=
,则钒元素的沉降率=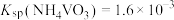 ,反应过程中溶液的体积不变]。
,反应过程中溶液的体积不变]。(7)在Ar气氛中加热煅烧
 ,升温过程中固体的质量变化如图所示,加热分解
,升温过程中固体的质量变化如图所示,加热分解 制备
制备 需要控制的温度为
需要控制的温度为
A.250℃ B.350℃ C.450℃
您最近一年使用:0次
解题方法
4 . 海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某工厂综合利用海水资源的示意图。
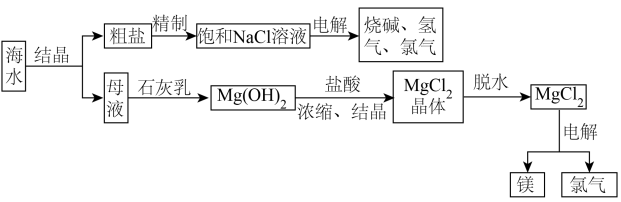
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、 等杂质,精制后可得饱和NaCl溶液。精制过程中,通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后向溶液中加入盐酸至溶液呈中性。写出加入盐酸后溶液中可能发生反应的离子方程式:
等杂质,精制后可得饱和NaCl溶液。精制过程中,通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后向溶液中加入盐酸至溶液呈中性。写出加入盐酸后溶液中可能发生反应的离子方程式:___________ 。
(2)海水中提取食盐后的母液中含有K+、Na+、Mg2+等。从离子反应的角度考虑,向母液中加入石灰乳的作用是___________ 。
(3)海水中的镁元素处于___________ (填“游离态”或“化合态”),从海水中提取氯化镁的反应___________ (填“是”或“不是”)氧化还原反应,用电解法冶炼金属镁的反应___________ (填“是”或“不是”)氧化还原反应,原因是___________ 。
(4)电解熔融的氯化镁所得的镁蒸气冷却后即为固体镁,可以冷却镁蒸气的气体氛围为___________(填字母)。

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、
 等杂质,精制后可得饱和NaCl溶液。精制过程中,通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后向溶液中加入盐酸至溶液呈中性。写出加入盐酸后溶液中可能发生反应的离子方程式:
等杂质,精制后可得饱和NaCl溶液。精制过程中,通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后向溶液中加入盐酸至溶液呈中性。写出加入盐酸后溶液中可能发生反应的离子方程式:(2)海水中提取食盐后的母液中含有K+、Na+、Mg2+等。从离子反应的角度考虑,向母液中加入石灰乳的作用是
(3)海水中的镁元素处于
(4)电解熔融的氯化镁所得的镁蒸气冷却后即为固体镁,可以冷却镁蒸气的气体氛围为___________(填字母)。
| A.H2 | B.CO2 | C.空气 | D.O2 |
您最近一年使用:0次
解题方法
5 . 二氯化砜又名磺酰氯( ),是重要的化学试剂,主要用作氯化剂或氯磺化剂,也可用于制造染料、橡胶等。
),是重要的化学试剂,主要用作氯化剂或氯磺化剂,也可用于制造染料、橡胶等。
查阅资料:①磺酰氯熔点为―54.1℃,沸点为69.1℃,遇冷水逐渐分解。
②实验需要加入适当的催化剂,控制温度在140―150℃。
③该实验中活性炭的作用仅为增大反应的接触面积。
现用如图所示装置(加热仪器、夹持仪器已略去)进行实验.请回答相应问题:
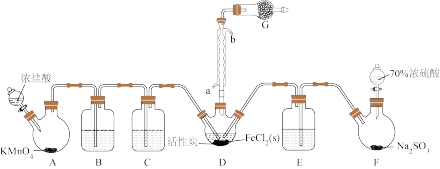
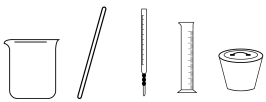
(1)用98%浓硫酸配置70%的浓硫酸,下列仪器不需要的是______ (填仪器名称)。
(2)冷凝管的作用是______ ,进水口为______ 。(填“a”或“b”)
(3)仪器A中发生反应的离子方程式______ 。
(4)干燥管G中装入碱石灰的目的______ 。
(5)反应温度控制在140-150℃的方法______ ,温度控制在该范围的可能原因是______ 。
(6)写出D瓶中生成磺酰氯( )的化学方程式
)的化学方程式______ 。
 ),是重要的化学试剂,主要用作氯化剂或氯磺化剂,也可用于制造染料、橡胶等。
),是重要的化学试剂,主要用作氯化剂或氯磺化剂,也可用于制造染料、橡胶等。查阅资料:①磺酰氯熔点为―54.1℃,沸点为69.1℃,遇冷水逐渐分解。
②实验需要加入适当的催化剂,控制温度在140―150℃。
③该实验中活性炭的作用仅为增大反应的接触面积。
现用如图所示装置(加热仪器、夹持仪器已略去)进行实验.请回答相应问题:

(1)用98%浓硫酸配置70%的浓硫酸,下列仪器不需要的是

(2)冷凝管的作用是
(3)仪器A中发生反应的离子方程式
(4)干燥管G中装入碱石灰的目的
(5)反应温度控制在140-150℃的方法
(6)写出D瓶中生成磺酰氯(
 )的化学方程式
)的化学方程式
您最近一年使用:0次
2023-12-21更新
|
454次组卷
|
4卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题陕西省汉中市2023-2024学年高三上学期教学质量第一次检测(一模)化学试卷(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建
2024·广西·模拟预测
6 . 为了缓解温室效应与能源供应之间的冲突,从空气中捕集 并将其转化为燃料或增值化学品成为了新的研究热点,如甲醇的的制备。回答下列问题:
并将其转化为燃料或增值化学品成为了新的研究热点,如甲醇的的制备。回答下列问题:
I.制备合成气:反应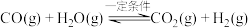 在工业上有重要应用。
在工业上有重要应用。
(1)该反应在不同温度下的平衡常数如表所示。
①反应的ΔH_______ 0(填“>”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是_______ 。
(2)该反应常在Pd膜反应器中进行,其工作原理如图1所示。
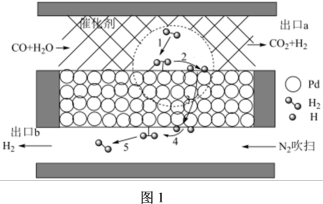
①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是_______ 。
②某温度下, 在Pd膜表面上的解离过程存在如下平衡:
在Pd膜表面上的解离过程存在如下平衡: ,其正反应的活化能远小于逆反应的活化能。下列说法错误的是
,其正反应的活化能远小于逆反应的活化能。下列说法错误的是_______ (填标号)。
A.Pd膜对气体分子的透过具有选择性
B.过程2的ΔH>0
C.加快Pd膜内H原子迁移有利于 的解离
的解离
D.H原子在Pd膜表面上结合为 的过程为放热反应
的过程为放热反应
Ⅱ.合成甲醇:在体积不变的密闭容器中投入 0.5mol CO 和 1mol H2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
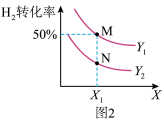
(3)图2中X代表_______ (填“温度”或“压强”)。若图2中M 点对应的容器体积为5 L,则N点的平衡常数K为_______ 。
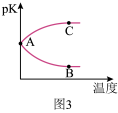
(4)图3中正确表示该反应的平衡常数的负对数pK(pK=−lgK)与X 的关系的曲线_______ (填“AC”或“AB”)。
(5)通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇(CH3OH),发生的主要反应是CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是
CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是_______ (填标号)。
a.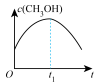 b.
b.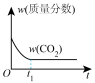 c.
c.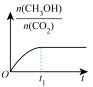 d.
d.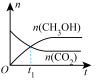
 并将其转化为燃料或增值化学品成为了新的研究热点,如甲醇的的制备。回答下列问题:
并将其转化为燃料或增值化学品成为了新的研究热点,如甲醇的的制备。回答下列问题:I.制备合成气:反应
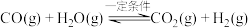 在工业上有重要应用。
在工业上有重要应用。(1)该反应在不同温度下的平衡常数如表所示。
| 温度/℃ | 700 | 800 | 830 | 1000 |
| 平衡常数 | 1.67 | 1.11 | 1.00 | 0.59 |
②反应常在较高温度下进行,该措施的优缺点是
(2)该反应常在Pd膜反应器中进行,其工作原理如图1所示。

①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是
②某温度下,
 在Pd膜表面上的解离过程存在如下平衡:
在Pd膜表面上的解离过程存在如下平衡: ,其正反应的活化能远小于逆反应的活化能。下列说法错误的是
,其正反应的活化能远小于逆反应的活化能。下列说法错误的是A.Pd膜对气体分子的透过具有选择性
B.过程2的ΔH>0
C.加快Pd膜内H原子迁移有利于
 的解离
的解离D.H原子在Pd膜表面上结合为
 的过程为放热反应
的过程为放热反应Ⅱ.合成甲醇:在体积不变的密闭容器中投入 0.5mol CO 和 1mol H2,不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
(3)图2中X代表
(4)图3中正确表示该反应的平衡常数的负对数pK(pK=−lgK)与X 的关系的曲线

(5)通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇(CH3OH),发生的主要反应是CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是
CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2023-12-20更新
|
1486次组卷
|
4卷引用:热点26 反应原理综合题
(已下线)热点26 反应原理综合题2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题(已下线)化学01(14+4模式)2024年1月“九省联考”考前化学猜想卷湖北省部分县市区省级示范高中温德克英协作体2023-2024学年高二上学期期末综合性调研考试化学试题
7 . 甲、乙、丙、丁四种物质存在如下转化关系:甲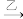 丙
丙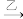 丁。
丁。
(1)若甲、乙均为空气的主要成分,甲所含元素的简单阴离子的结构示意图为___________ 。
(2)若乙是生活中常见的金属单质,丙→丁的离子方程式为___________ 。
(3)若丙既能与强酸又能与强碱反应,则丙的化学式为___________ (任写1种)。
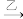 丙
丙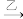 丁。
丁。(1)若甲、乙均为空气的主要成分,甲所含元素的简单阴离子的结构示意图为
(2)若乙是生活中常见的金属单质,丙→丁的离子方程式为
(3)若丙既能与强酸又能与强碱反应,则丙的化学式为
您最近一年使用:0次
8 . 某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
已知:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
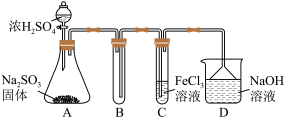
(1)B装置的作用是___________ 。
(2)C中观察到的现象是___________ 。据此,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。请设计实验方案检验有Fe2+生成___________ 。
(3)若C中溶液分别为:①BaCl2溶液和氨水,②BaCl2溶液和氯水,则各自的现象为________ ,若有沉淀生成,沉淀分别为___________ 。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有___________ (填字母)。
a.浓硫酸 b.酸性KMnO4溶液 c.碘水 d.NaOH溶液
已知:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O

(1)B装置的作用是
(2)C中观察到的现象是
(3)若C中溶液分别为:①BaCl2溶液和氨水,②BaCl2溶液和氯水,则各自的现象为
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有
a.浓硫酸 b.酸性KMnO4溶液 c.碘水 d.NaOH溶液
您最近一年使用:0次
解题方法
9 . 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO,设计了如下实验方案。

(1)甲同学设计如图实验(实验过程中玻璃塞为打开状态)。
①组装好装置并检验气密性后,如何加入稀硝酸?___________ 。
②如何控制反应的进行?___________ 。
③如何验证产生的气体为NO?___________ 。
(2)乙同学设计了如图实验(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是存有空气的注射器。
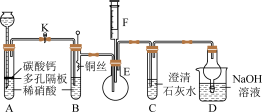
①设计装置A的目的是___________ 。
②装置E和F的作用是___________ 。为实现此作用,操作是___________ 。
③装置D的作用是___________ 。

(1)甲同学设计如图实验(实验过程中玻璃塞为打开状态)。
①组装好装置并检验气密性后,如何加入稀硝酸?
②如何控制反应的进行?
③如何验证产生的气体为NO?
(2)乙同学设计了如图实验(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是存有空气的注射器。

①设计装置A的目的是
②装置E和F的作用是
③装置D的作用是
您最近一年使用:0次
解题方法
10 . 丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以用乙烯、丙烯等石油化工产品为原料进行合成:
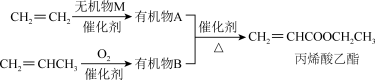
(1)由丙烯生成有机物B的化学反应的类型是___________ 。
(2)有机物A与Na反应的化学方程式为___________ 。
(3)有机物B中含有的官能团是___________ (填名称),A与B反应生成丙烯酸乙酯的化学方程式是___________ 。
(4)久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。请用化学方程式表示上述聚合过程___________ 。
(5)根据丙烯酸的结构判断,丙烯酸可能发生的反应有___________(填正确答案标号)。
①中和反应 ②取代反应 ③加成反应 ④氧化反应

(1)由丙烯生成有机物B的化学反应的类型是
(2)有机物A与Na反应的化学方程式为
(3)有机物B中含有的官能团是
(4)久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。请用化学方程式表示上述聚合过程
(5)根据丙烯酸的结构判断,丙烯酸可能发生的反应有___________(填正确答案标号)。
①中和反应 ②取代反应 ③加成反应 ④氧化反应
| A.①③ | B.①②③ | C.①③④ | D.①②③④ |
您最近一年使用:0次



