名校
解题方法
1 . 已知: ;
;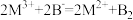 ;
; 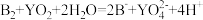 ;
;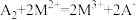
由以上信息判断下列哪个反应不能发生
 ;
;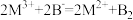 ;
; 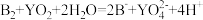 ;
;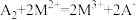
由以上信息判断下列哪个反应不能发生
A.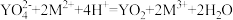 |
B. |
C. |
D. |
您最近一年使用:0次
名校
解题方法
2 . I. CO2、SO2的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
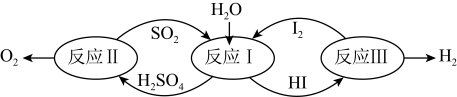
(1)反应I的化学方程式是_________ 。
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550kJ·mol-1
它由两步反应组成:
i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177kJ•mol-1
ii. SO3(g)分解
则SO3(g)分解的热化学方程式为_________ 。
(3)电催化还原CO2的方法具有催化效率更高、反应条件更温和的优点,CO2在 纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为_________ (填“a”“b”或“c”)。

II.在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。
(4)已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式_________ 。
III.磷的一种化合物叫亚磷酸(H3PO3)。已知:
a. 0.1mol/L H3PO3溶液的pH=1.7;
b. H3PO3与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐;
c. H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
(5)关于H3PO3的说法:①强电解质;②弱电解质;③二元酸;④三元酸;⑥氧化性酸;⑥还原性酸,其中正确的是_________。
(6)写出H3PO3与过量NaOH溶液反应的离子方程式_________ 。

(1)反应I的化学方程式是
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550kJ·mol-1
它由两步反应组成:
i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177kJ•mol-1
ii. SO3(g)分解
则SO3(g)分解的热化学方程式为
(3)电催化还原CO2的方法具有催化效率更高、反应条件更温和的优点,CO2在
 纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
II.在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。
(4)已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式
III.磷的一种化合物叫亚磷酸(H3PO3)。已知:
a. 0.1mol/L H3PO3溶液的pH=1.7;
b. H3PO3与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐;
c. H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
(5)关于H3PO3的说法:①强电解质;②弱电解质;③二元酸;④三元酸;⑥氧化性酸;⑥还原性酸,其中正确的是_________。
| A.②④⑥ | B.②③⑥ | C.①④⑤ | D.②③⑤ |
您最近一年使用:0次
3 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,以下是过氧化氢法生产亚氯酸钠的工艺流程图:

回答下列问题:
(1)亚氯酸钠用作纸浆、纸张和各种纤维的漂白剂,是一种高效漂白剂,主要原因是亚氯酸钠具有___________ 性。
(2)写出制备ClO2的化学反应方程式:______________ 。
(3)可从“废液”中回收的主要物质是___________ (填化学式),“结晶”后经过滤即可获得粗产品。
(4)吸收塔的温度不能超过20°C,其目的是_____________ 。
(5)吸收塔内的反应的化学方程式为_____________ 。

回答下列问题:
(1)亚氯酸钠用作纸浆、纸张和各种纤维的漂白剂,是一种高效漂白剂,主要原因是亚氯酸钠具有
(2)写出制备ClO2的化学反应方程式:
(3)可从“废液”中回收的主要物质是
(4)吸收塔的温度不能超过20°C,其目的是
(5)吸收塔内的反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 高铁酸盐是一种集氧化、絮凝、杀菌、吸附、助凝、除臭为一体的新型高效多功能水处理剂。
I.某实验小组在实验室制备少量高铁酸钾( )。
)。
查阅资料:
a. 为紫色固体。
为紫色固体。
b. 具有强氧化性,在酸性或中性溶液中快速产生
具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。

(1)装置B除去挥发的HCl,目的是_______ 。
(2)装置C中反应的离子方程式:_______ 。
(3)装置D中反应的离子方程式为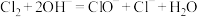 ,用单线桥表示电子转移方向和数目
,用单线桥表示电子转移方向和数目_______ 。在装置D的溶液中还检测出 ,若溶液中个数
,若溶液中个数 ,则个数
,则个数
_______ 。
II.工业上可以用多种制备高铁酸钠( )。
)。
(4) 与
与 生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式
生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式____ 。
(5)高铁酸钠还可以通过如下反应制得: ,反应中的还原剂有
,反应中的还原剂有_____ ,反应中1个 可以还原
可以还原 的数目为
的数目为_____ 个。
I.某实验小组在实验室制备少量高铁酸钾(
 )。
)。查阅资料:
a.
 为紫色固体。
为紫色固体。b.
 具有强氧化性,在酸性或中性溶液中快速产生
具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)装置B除去挥发的HCl,目的是
(2)装置C中反应的离子方程式:
(3)装置D中反应的离子方程式为
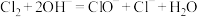 ,用单线桥表示电子转移方向和数目
,用单线桥表示电子转移方向和数目 ,若溶液中个数
,若溶液中个数 ,则个数
,则个数
II.工业上可以用多种制备高铁酸钠(
 )。
)。(4)
 与
与 生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式
生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式(5)高铁酸钠还可以通过如下反应制得:
 ,反应中的还原剂有
,反应中的还原剂有 可以还原
可以还原 的数目为
的数目为
您最近一年使用:0次
2022-10-09更新
|
381次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学校2022一2023学年高一上学期9月份考试化学试题
名校
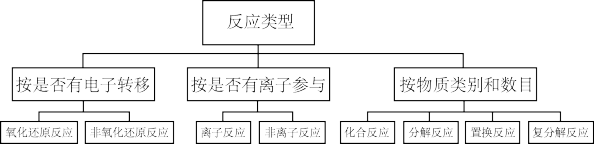
5 . 分类是根据研究对象的共同点和差异点,将它们区分不同种类和层次的科学方法。运用分类的方法,可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。下图是对化学反应类型进行的分类。
① ______
______
②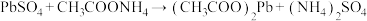
③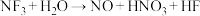
④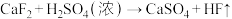
⑤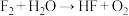
⑥ ______
______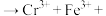 _______
_______
⑦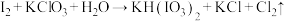
根据上面的化学反应(未配平)完成下列问题:
(1)图中分类方式为_______ 。
A.树状分类法 B.交叉分类法
(2)①反应属于非氧化还原反应,生成一种强酸和一种弱酸,弱酸的化学式为_______ 。
(3)②反应属于复分解反应且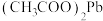 可溶于水,由此推断
可溶于水,由此推断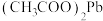 属于
属于_______ (填“强电解质”或“弱电解质”)。
(4)反应③④⑤均生成HF,属于氧化还原反应的是_______ (填序号)。
(5)将反应⑥和⑦配平:
⑥_______ 。
_____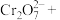 _____
_____ _____=______
_____=______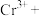 _____
_____ ______
______
⑦_______ 。
_______ ______
______ ______
______ =_____
=_____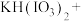 ______
______ ______
______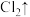

①
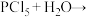 ______
______②
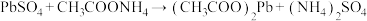
③
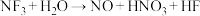
④
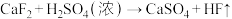
⑤
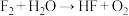
⑥
 ______
______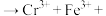 _______
_______⑦
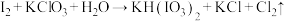
根据上面的化学反应(未配平)完成下列问题:
(1)图中分类方式为
A.树状分类法 B.交叉分类法
(2)①反应属于非氧化还原反应,生成一种强酸和一种弱酸,弱酸的化学式为
(3)②反应属于复分解反应且
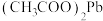 可溶于水,由此推断
可溶于水,由此推断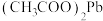 属于
属于(4)反应③④⑤均生成HF,属于氧化还原反应的是
(5)将反应⑥和⑦配平:
⑥
_____
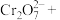 _____
_____ _____=______
_____=______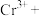 _____
_____ ______
______⑦
_______
 ______
______ ______
______ =_____
=_____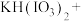 ______
______ ______
______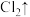
您最近一年使用:0次
名校
解题方法
6 . 阅读下段语句,“我国海水制盐具有悠久的历史。从海水中制得的氯化钠除食用外,还用作工业原料,如生产①烧碱、②纯碱、③金属钠、④氯气、⑤漂白液(主要成分:NaCl和NaClO)、⑥次氯酸(化学式:HClO)等含氯化工产品”。
(1)语句中的化学物质中,属于电解质的是_______ (填序号),可以导电的是_______ (填序号)。
(2)语句中漂白液在酸性条件下发生归中反应生成氯气,反应的离子方程式为_______ 。
(3)从海水获得较纯净的氯化钠的简要流程如下:

①流程图中试剂1、试剂2和试剂3,可行的组合是_______ 。
A.NaOH溶液 溶液
溶液 溶液
溶液
B. 溶液NaOH溶液
溶液NaOH溶液 溶液
溶液
C. 溶液
溶液 溶液NaOH溶液
溶液NaOH溶液
D.NaOH溶液 溶液
溶液 溶液
溶液
②试剂4的化学式为_______ 。
③操作的名称:_______ 。
(4)若纯碱溶液中 与盐酸溶液中的HCl按4∶7反应的离子方程式为
与盐酸溶液中的HCl按4∶7反应的离子方程式为_______ 。
(1)语句中的化学物质中,属于电解质的是
(2)语句中漂白液在酸性条件下发生归中反应生成氯气,反应的离子方程式为
(3)从海水获得较纯净的氯化钠的简要流程如下:

①流程图中试剂1、试剂2和试剂3,可行的组合是
A.NaOH溶液
 溶液
溶液 溶液
溶液B.
 溶液NaOH溶液
溶液NaOH溶液 溶液
溶液C.
 溶液
溶液 溶液NaOH溶液
溶液NaOH溶液D.NaOH溶液
 溶液
溶液 溶液
溶液②试剂4的化学式为
③操作的名称:
(4)若纯碱溶液中
 与盐酸溶液中的HCl按4∶7反应的离子方程式为
与盐酸溶液中的HCl按4∶7反应的离子方程式为
您最近一年使用:0次
2022-10-09更新
|
195次组卷
|
3卷引用:黑龙江省哈尔滨市第九中学校2022一2023学年高一上学期9月份考试化学试题
名校
7 . 三效催化剂能有效实现汽车尾气中CO、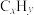 、
、 三种成分的净化,其催化剂BaO表面物质转化的关系如图。下列说法错误的是
三种成分的净化,其催化剂BaO表面物质转化的关系如图。下列说法错误的是

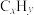 、
、 三种成分的净化,其催化剂BaO表面物质转化的关系如图。下列说法错误的是
三种成分的净化,其催化剂BaO表面物质转化的关系如图。下列说法错误的是
| A.在转化过程中,氮元素均被还原 |
| B.催化剂BaO先参加反应后又再生成,最终质量不变 |
C.储存时发生反应: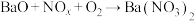 , , 的系数为2x-5 的系数为2x-5 |
D.还原时若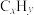 为 为 且与CO的数目相同,则生成的 且与CO的数目相同,则生成的 和 和 的数目相等 的数目相等 |
您最近一年使用:0次
2022-10-09更新
|
187次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学校2022一2023学年高一上学期9月份考试化学试题
名校
8 . 对于下列反应说法错误的是
A.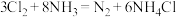 中,氧化产物和还原产物个数比为3∶2 中,氧化产物和还原产物个数比为3∶2 |
B. 中,氧化剂和还原剂的物质个数之比为1∶2 中,氧化剂和还原剂的物质个数之比为1∶2 |
C. 中, 中, 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
D.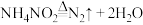 既是分解反应又是氧化还原反应 既是分解反应又是氧化还原反应 |
您最近一年使用:0次
2022-10-09更新
|
306次组卷
|
3卷引用:黑龙江省哈尔滨市第九中学校2022一2023学年高一上学期9月份考试化学试题
9 . 已知NaNO2能发生如下反应(未配平):NaNO2+HI→NO+I2+NaI+H2O
(1)配平方程式,并用单线桥表示电子的转移方向和数目:_______ 。
NaNO2+_______HI—_______NO+_______I2+_______NaI+_______H2O
(2)反应中_______ 元素被氧化(填元素名称),_______ 是氧化剂(填化学式);
(3)氧化产物是_______ (填写化学式,下同),还原产物是_______ 。
(4)反应中,每生成1分子I2,转移的电子数为_______ ;消耗128g还原剂,生成还原产物的质量为_______ 。
(1)配平方程式,并用单线桥表示电子的转移方向和数目:
NaNO2+_______HI—_______NO+_______I2+_______NaI+_______H2O
(2)反应中
(3)氧化产物是
(4)反应中,每生成1分子I2,转移的电子数为
您最近一年使用:0次
名校
10 . 次磷酸(H3PO2)是一元中强酸,次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如图所示。下列有关说法正确的是


A.Ni2+价电子的轨道表示式为 |
| B.“碱溶”时氧化剂与还原剂的物质的量之比为3:1 |
C.PH3、PO 中P的杂化方式相同,键角PO 中P的杂化方式相同,键角PO >PH3 >PH3 |
D.次磷酸铵与足量氢氧化钠共热,发生反应NH +H2PO +H2PO +3OH- +3OH- NH3↑+3H2O+PO NH3↑+3H2O+PO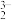 |
您最近一年使用:0次
2022-10-08更新
|
1443次组卷
|
8卷引用:黑龙江省绥化市第一中学2022-2023学年高三上学期期中考试化学试题



