名校
解题方法
1 . 某兴趣小组用铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备K2Cr2O7晶体,流程如下:

(1)焙烧时向矿料中加入碳酸钠和氧气,发生如下反应FeCr2O4转化为Na2CrO4,Na2CO3+SiO2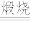 Na2SiO3+CO2↑,Na2CO3+Al2O3
Na2SiO3+CO2↑,Na2CO3+Al2O3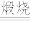 2NaAlO2+CO2↑
2NaAlO2+CO2↑
写出FeCr2O4转化为Na2CrO4的化学方程式_____________________________ 。
(2)滤渣1的主要成分是_____ 。
(3)滤渣2的成分是_____ 和__ 。
(4)流程中调pH:已知2CrO +2H+⇌Cr2O
+2H+⇌Cr2O +H2O,蒸发结晶所产生的副产品是
+H2O,蒸发结晶所产生的副产品是_____ 。
(5)结晶步骤Na2Cr2O7+2KCl= K2Cr2O7+2NaCl该反应是_________ 类型(四种基本反应类型)。
(6)该小组用m1 kg铬铁矿(FeCr2O4 50%)制备K2Cr2O7,最终得到m2 kg,产率为____ 。

(1)焙烧时向矿料中加入碳酸钠和氧气,发生如下反应FeCr2O4转化为Na2CrO4,Na2CO3+SiO2
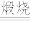 Na2SiO3+CO2↑,Na2CO3+Al2O3
Na2SiO3+CO2↑,Na2CO3+Al2O3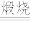 2NaAlO2+CO2↑
2NaAlO2+CO2↑写出FeCr2O4转化为Na2CrO4的化学方程式
(2)滤渣1的主要成分是
(3)滤渣2的成分是
(4)流程中调pH:已知2CrO
 +2H+⇌Cr2O
+2H+⇌Cr2O +H2O,蒸发结晶所产生的副产品是
+H2O,蒸发结晶所产生的副产品是(5)结晶步骤Na2Cr2O7+2KCl= K2Cr2O7+2NaCl该反应是
(6)该小组用m1 kg铬铁矿(FeCr2O4 50%)制备K2Cr2O7,最终得到m2 kg,产率为
您最近一年使用:0次
2 . 离子化合物 和
和 与水的反应分别为①
与水的反应分别为①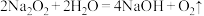 ;②
;② 。下列说法正确的是
。下列说法正确的是
 和
和 与水的反应分别为①
与水的反应分别为①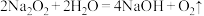 ;②
;② 。下列说法正确的是
。下列说法正确的是A.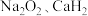 中均有非极性共价键 中均有非极性共价键 |
| B.①中水发生氧化反应,②中水发生还原反应 |
C. 中阴、阳离子个数比为 中阴、阳离子个数比为 , , 中阴、阳离子个数比为 中阴、阳离子个数比为 |
D.当反应①和②中转移的电子数相同时,产生的 和 和 的物质的量相同 的物质的量相同 |
您最近一年使用:0次
2023-06-28更新
|
10715次组卷
|
40卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题
黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高一下学期开学摸底考试化学试卷2023年高考北京卷化学真题(已下线)2023年北京卷高考真题变式题(选择题11-14)(已下线)第4讲 钠及其重要化合物(已下线)第8讲 物质的量与气体摩尔体积(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)(已下线)广东省东莞市光正实验学校2023-2024学年高三上学期第二次月孝化学试题湖南省株洲市炎陵县2023-2024学年高二上学期入学考试化学试题江西省丰城中学2023-2024学年高二创新班上学期开学考试化学试题江苏省常州市联盟学校2023-2024学年高三上学期10月学情调研化学试题北京市第一七一中学2023-2024学年高三上学期10月考化学试题(已下线)实验03 探究氧化钠和过氧化钠的性质-【同步实验课】2023-2024学年高一化学教材实验大盘点(人教版2019必修第一册)山西省大同市第一中学校2023-2024学年高三上学期10月月考化学试题河北省石家庄市第二十四中学2023-2024高三上学期第一次月考化学试题四川省攀枝花市第七高级中学校2023-2024学年高三上学期9月第二次诊断性考试理综化学试题河北省石家庄市河北正定中学2024届高三上学期第二次月考化学试题天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题(已下线)北京市第四中学2023-2024学年高三上学期期中考试化学试题(已下线)题型04 氧化还原反应-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河南省信阳高级中学2023-2024学年高三上学期11月一模考试化学试题陕西省西安市长安区第一中学2023-2024学年高三上学期第二次教学质量检测化学试题山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题(已下线)北京市第四中学2023-2024学年高三上学期 期中化学试卷北京师范大学附属中学2023-2024学年高一上学期期末考试化学试卷北京市密云二中2023-2024学年高二上学期10月月考化学试卷 安徽省宿州市泗县第一中学2023-2024学年高一下学期开学考试化学试题福建省福建师范大学附属中学2023-2024学年高三上学期开学考化学试题四川省达州外国语学校2023-2024学年高二下学期3月月考化学试题北京市北京师范大学第二附属中学2023-2024学年高一下学期期中考试化学试题北京大学附属中学2023-2024学年高一下学期期中考试化学(行知+未名)试卷(已下线)第04讲 氧化还原反应的基本概念和规律(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
3 . 下列有关化学品使用的说法中,错误的是
| A.非处方药的包装上印有“OTC”标志 | B.制作豆腐时可添加适量石膏作凝固剂 |
| C.水果罐头中常加入维生素C作抗氧化剂 | D.面包、饼干加工时常加入 作蓬松剂 作蓬松剂 |
您最近一年使用:0次
2023-06-27更新
|
116次组卷
|
2卷引用:黑龙江省大庆市大庆中学2022-2023学年高一下学期7月期末考试化学试题
名校
4 . K3[Fe(C2O4)3]·3H2O[三草酸合铁酸钾(M=491 g·mol-1)]易溶于水,难溶于乙醇,常用作有机反应的催化剂。某同学利用下图装置制备FeC2O4·2H2O,然后再制备三草酸合铁酸钾。
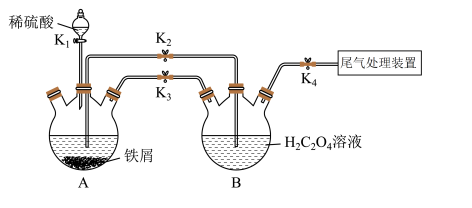
回答下列问题:
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式______________ 。
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为__________________ 。
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40°C下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为______________________ ;将上述混合物煮沸,加入饱和H2C2O4溶液,充分反应后冷却、结晶;结晶完全后减压抽滤、洗涤、干燥得到目标产物。
i.缓慢滴加H2O2溶液,水浴控温在40°C的原因是___________________ 。
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是_______________ 。
iii.为促进结晶,冷却后可加入_____________ (填试剂名称)。
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz- (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(4)阴离子电荷数为____________ (用含字母的代数式表示);若交换时样品液的流速过快,则会导致测定结果_____ (填“偏高“偏低”或“无影响”)。

回答下列问题:
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40°C下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为
i.缓慢滴加H2O2溶液,水浴控温在40°C的原因是
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是
iii.为促进结晶,冷却后可加入
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz-
 (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。(4)阴离子电荷数为
您最近一年使用:0次
名校
解题方法
5 . 利用锌精矿(ZnS)和软锰矿(MnO2)两种矿料(含少量杂质Fe、Cu、Pb等元素的化合物及SiO2)生产硫酸锌和硫酸锰的流程如下:

已知常温下:①H2S的电离常数为:Ka1=1.0 ×10-7,Ka2=1.0 ×10-13;
②Ksp(ZnS)=1.0 ×10-22,Ksp(MnS)=1.0 ×10-13;
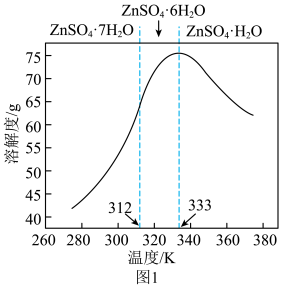
③ZnSO4的溶解度如图1所示:
回答下列问题:
(1)基态S原子占据最高能级的原子轨道形状为_________________________ 。
(2)“滤渣1”主要成分为_____________ 和硫;写出“酸浸”过程中MnO2和ZnS反应的化学方程式_________________ 。
(3)“除铁”的萃取剂为磷酸二(2-乙基己基)酯(用HA表示),萃取后含铁的物质为[Fe(HA)2(H2O)2]ASO4,该物质中Fe3+的配位数为___________ 。
(4)BaS为可溶性钡盐。向“水相1”中加入适量BaS,发生主要反应的离子方程式为_____________ ;若溶液中S2-的浓度控制不当,会造成Zn2+、Mn2+沉淀而损失,若溶液中Zn2+、Mn2+的浓度为0.10 mol·L-1,则应控制溶液中c(H+)不小于_____________ mol·L-1。(已知溶液中H2S的浓度为1.0×10-3 mol/L)
(5)从“反萃取液”中获得ZnSO4·H2O晶体的操作为:控制温度在_________________ K以上,蒸发至有大量固体析出、________________ 、洗涤、干燥。
(6)ZnSO4·H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。

已知常温下:①H2S的电离常数为:Ka1=1.0 ×10-7,Ka2=1.0 ×10-13;
②Ksp(ZnS)=1.0 ×10-22,Ksp(MnS)=1.0 ×10-13;
③ZnSO4的溶解度如图1所示:

回答下列问题:
(1)基态S原子占据最高能级的原子轨道形状为
(2)“滤渣1”主要成分为
(3)“除铁”的萃取剂为磷酸二(2-乙基己基)酯(用HA表示),萃取后含铁的物质为[Fe(HA)2(H2O)2]ASO4,该物质中Fe3+的配位数为
(4)BaS为可溶性钡盐。向“水相1”中加入适量BaS,发生主要反应的离子方程式为
(5)从“反萃取液”中获得ZnSO4·H2O晶体的操作为:控制温度在
(6)ZnSO4·H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。
| A.滴定前,锥形瓶和滴定管均须用标准溶液润洗 |
| B.将标准溶液装入滴定管时,应借助漏斗转移 |
| C.滴定终点时,读取标准液体积时俯视滴定管液面,则测得的体积比实际消耗的小 |
| D.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的大 |
您最近一年使用:0次
6 . Ar气氛下,高价态钒镁氧化物晶体作为催化剂进行乙苯脱氢制备苯乙烯,并将CO2转化为CO,反应机理如图(a)所示;同时采用电解法处理含苯乙烯的废水,其工作原理如图(b)(电解液是含苯乙烯和硫酸的废水,pH≈ 6),已知:·OH具有很强的氧化性。下列说法不正确的是
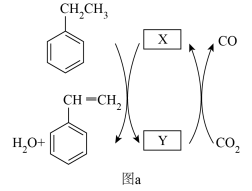
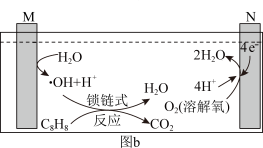


| A.图a由MgVmOn+1转化为MgVmOn的过程,乙苯发生氧化反应 |
| B.M连接电源的正极 |
| C.苯乙烯被·OH氧化的化学方程式为C8H8-40e- +40·OH =8CO2↑+ 24H2O |
| D.若电路中通过10mol电子,理论上有26g苯乙烯(M= 104 g/mol)被氧化成CO2和H2O |
您最近一年使用:0次
7 . 某工厂采用如下工艺制备 ,已知焙烧后
,已知焙烧后 元素以
元素以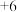 价形式存在,下列说法错误的是
价形式存在,下列说法错误的是
 ,已知焙烧后
,已知焙烧后 元素以
元素以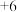 价形式存在,下列说法错误的是
价形式存在,下列说法错误的是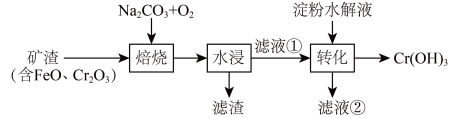
A.“焙烧”中产生 | B.滤渣的主要成分为 |
C.滤液①中 元素的主要存在形式为 元素的主要存在形式为 | D.淀粉水解液中的葡萄糖起还原作用 |
您最近一年使用:0次
2023-06-13更新
|
11176次组卷
|
23卷引用:黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题
黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题黑龙江省齐齐哈尔市龙西北高中名校联盟2023-2024学年高三上学期10月联考化学试题2023年高考辽宁卷化学真题(已下线)T10-物质反应及转化(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)陕西省汉中中学2024届高三上学期8月质量检测化学试题陕西省渭南市2023-2024学年高三上学期期中检测化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河北省迁安市2023-2024学年高三上学期期中考试化学试题(已下线)第3讲 物质制备实验的设计与评价(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)陕西省西安市长安区第一中学2023-2024学年高三上学期第二次教学质量检测化学试题河北省保定市蠡县中学2023-2024学年高二上学期化学月考试题福建泉州科技中学2022-2023学年高二下学期期末考化学试题(已下线)第四章 生物大分子(B卷)(已下线)FHgkyldyjhx03福建省厦门第一中学2023-2024学年高三下学期5月第2次月考化学试卷(已下线)测试辽宁化学 请勿下载2024年辽宁省锦州市渤海大学附属高级中学模拟化学试题
名校
8 . 钯(Pd)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量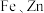 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
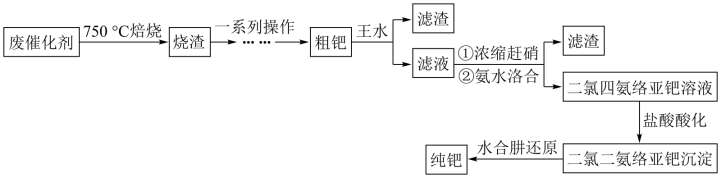
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是___________ 。
(2)“一系列操作”包括向烧渣中加入 ,目的是将
,目的是将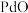 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:___________ 。
(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(H2PdCl4)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
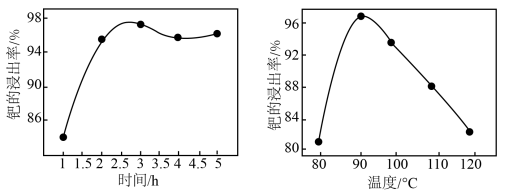
的物质的量之比为___________ 。钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为___________ 。
(4)“氨水络合”时需要控制好溶液的 ,已知常温下,
,已知常温下,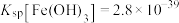 ,
,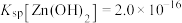 ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为___________ (保留三位有效数字)。(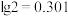 )
)
(5)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=___________ 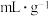 ,氢气的浓度r=
,氢气的浓度r=___________ (保留小数点后两位)。(吸附容量R即1g钯吸附氢气的体积;氢气的浓度r为 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
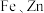 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是
(2)“一系列操作”包括向烧渣中加入
 ,目的是将
,目的是将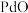 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(H2PdCl4)和一种有毒的无色气体
 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
的物质的量之比为
(4)“氨水络合”时需要控制好溶液的
 ,已知常温下,
,已知常温下,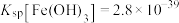 ,
,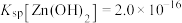 ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为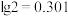 )
)(5)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=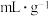 ,氢气的浓度r=
,氢气的浓度r= 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
您最近一年使用:0次
2023-06-10更新
|
102次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学校2023-2024学年高三上学期期中考试化学试卷
名校
解题方法
9 . 以某含钴废料(主要成分为 ,含有少量铁的氧化物、
,含有少量铁的氧化物、 和NiO)为原料制备碳酸钴和黄钠铁矾
和NiO)为原料制备碳酸钴和黄钠铁矾 的工艺流程如下。下列说法错误的是
的工艺流程如下。下列说法错误的是

 ,含有少量铁的氧化物、
,含有少量铁的氧化物、 和NiO)为原料制备碳酸钴和黄钠铁矾
和NiO)为原料制备碳酸钴和黄钠铁矾 的工艺流程如下。下列说法错误的是
的工艺流程如下。下列说法错误的是
A.还原性: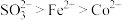 |
B.可用 溶液检验“氧化”是否完全 溶液检验“氧化”是否完全 |
C.“调pH”时反应的离子方程式: |
D.“沉钴”时若用 代替 代替 ,将有 ,将有 放出污染环境 放出污染环境 |
您最近一年使用:0次
2023-06-02更新
|
236次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
10 . 工业上用粉碎的黄铁矿(主要成分可表示为 ,其中还有少量
,其中还有少量 等)为原料制备硫酸的流程如图:
等)为原料制备硫酸的流程如图:
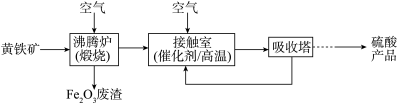
回答下列问题:
(1)硫酸厂沸腾炉排出的矿渣中含有 、CuO,请写出煅烧
、CuO,请写出煅烧 的化学方程式
的化学方程式___________ ,为提高生产效率,工业生产中我们会采用一定的办法加快反应速率,你认为上述流程中能加快速率的做法有___________ (至少写出两条)。
(2)在接触室中发生的是 的催化氧化反应,该反应属于
的催化氧化反应,该反应属于___________ (填字母)。
a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(3)为提高原料的转化率,并减少污染物的产生,落实绿色化学思想,上述流程中可循环利用的物质有___________ 。
(4)国家规定由吸收塔排出的尾气中 的最高含量不得超过
的最高含量不得超过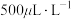 ,否则就要加以处理才能排出。处理方法之一是用足量氨水洗涤烟气脱硫,所得产物
,否则就要加以处理才能排出。处理方法之一是用足量氨水洗涤烟气脱硫,所得产物 可作为肥料。请与出此脱硫过程中可能发生反应的离子方程式:
可作为肥料。请与出此脱硫过程中可能发生反应的离子方程式:___________ ,___________ 。
(5)用含硫质量分数为a%的硫铁矿制硫酸,若高温煅烧时损失b%的硫元素,由 制
制 的转化率为c%,则制取1吨98%的硫酸需这种硫铁矿的质量为
的转化率为c%,则制取1吨98%的硫酸需这种硫铁矿的质量为___________ 吨(列出表达式即可,不必化简)。
 ,其中还有少量
,其中还有少量 等)为原料制备硫酸的流程如图:
等)为原料制备硫酸的流程如图:
回答下列问题:
(1)硫酸厂沸腾炉排出的矿渣中含有
 、CuO,请写出煅烧
、CuO,请写出煅烧 的化学方程式
的化学方程式(2)在接触室中发生的是
 的催化氧化反应,该反应属于
的催化氧化反应,该反应属于a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(3)为提高原料的转化率,并减少污染物的产生,落实绿色化学思想,上述流程中可循环利用的物质有
(4)国家规定由吸收塔排出的尾气中
 的最高含量不得超过
的最高含量不得超过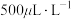 ,否则就要加以处理才能排出。处理方法之一是用足量氨水洗涤烟气脱硫,所得产物
,否则就要加以处理才能排出。处理方法之一是用足量氨水洗涤烟气脱硫,所得产物 可作为肥料。请与出此脱硫过程中可能发生反应的离子方程式:
可作为肥料。请与出此脱硫过程中可能发生反应的离子方程式:(5)用含硫质量分数为a%的硫铁矿制硫酸,若高温煅烧时损失b%的硫元素,由
 制
制 的转化率为c%,则制取1吨98%的硫酸需这种硫铁矿的质量为
的转化率为c%,则制取1吨98%的硫酸需这种硫铁矿的质量为
您最近一年使用:0次



