1 . 现有下列物质(括号内为对应物质的主要成分):a.熔融NaOH;b.医用酒精;c.蔗糖晶体;d.加碘盐(NaCl和KIO3);e.“84”消毒液(NaClO);f.小苏打(NaHCO3);g.洁厕灵(HCl),回答下列问题:
(1)上述状态下的物质中,属于电解质且能导电的是_______ (填字母,下同);d和f均为厨房中的常用物质,可用于区分两者的物质是________ 。
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:________ 。
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:___________ ;该反应中被氧化的Ⅰ原子与被还原的Ⅰ原子的个数之比为___________ 。
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:_____ ,__NaClO2+__NaHSO4=___ClO2+___NaCl+__Na2SO4+____H2O;若每片泡腾片中NaClO2的质量分数≥17%为合格品,上述所得ClO2溶液的物质的量浓度为0.002mol/L,则所用泡腾片____ (填“属于”或“不属于”)合格品。
(1)上述状态下的物质中,属于电解质且能导电的是
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:
您最近一年使用:0次
2 . 一氧化二氯( )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: 。
。
已知: 的部分性质如表所示
的部分性质如表所示

请回答下列问题:
(1)装置A中仪器a的名称为___________ ,装置A中发生反应的化学方程式为___________ 。
(2)装置B中盛装的试剂的名称为___________ 。
(3)装置E采用冰水混合物冷却的目的是___________ 。
(4)装置F中无水 的作用是
的作用是___________ 。
(5)装置G中发生反应的离子方程式为___________ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的___________ 倍(产物视为 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
 )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: 。
。已知:
 的部分性质如表所示
的部分性质如表所示| 物理性质 | 化学性质 |
常温下, 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ |  易溶于水,同时与水反应生成 易溶于水,同时与水反应生成 |

请回答下列问题:
(1)装置A中仪器a的名称为
(2)装置B中盛装的试剂的名称为
(3)装置E采用冰水混合物冷却的目的是
(4)装置F中无水
 的作用是
的作用是(5)装置G中发生反应的离子方程式为
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
您最近一年使用:0次
3 . 纪录片《神秘的古文明——三星堆》介绍了大量造型精美的青铜器,震惊世人。刚发掘的青铜器表面有很多铜锈(主要成分是氯化亚铜和碱式碳酸铜),可以用稀硫酸除去,涉及的氧化还原反应是: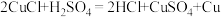 。下列有关该反应的叙述中,正确的是
。下列有关该反应的叙述中,正确的是
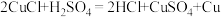 。下列有关该反应的叙述中,正确的是
。下列有关该反应的叙述中,正确的是A. 只作还原剂 只作还原剂 |
B. 只作氧化剂 只作氧化剂 |
C.氧化剂和还原剂的物质的量之比为 |
D.生成 ,转移电子物质的量为 ,转移电子物质的量为 |
您最近一年使用:0次
2024-01-12更新
|
136次组卷
|
2卷引用:黑龙江省哈尔滨市2023-2024学年高一上学期学业质量检测化学试卷
名校
4 . 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
I.氯气常用于自来水的杀菌消毒,但用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效安全的消毒剂。
工业上制备 的反应为:
的反应为: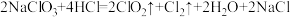 。
。
(1)该反应中的还原产物是___________ (写化学式),反应中每生成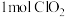 分子,转移电子的数目为
分子,转移电子的数目为___________ 。
(2) 在杀菌消毒后转化为
在杀菌消毒后转化为 ,可能会生成副产物亚氯酸盐(
,可能会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是________ (填序号)。
A. B.
B. C.
C.
(3)含氰废水中的 有剧毒。在碱性环境下
有剧毒。在碱性环境下 能被
能被 氧化成
氧化成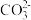 和
和 ,该反应氧化产物与还原产物物质的量之比为
,该反应氧化产物与还原产物物质的量之比为___________ 。
Ⅱ.高铁酸钾( )是一种新型绿色消毒剂,其在消毒后可形成胶体,可用于处理饮用水。
)是一种新型绿色消毒剂,其在消毒后可形成胶体,可用于处理饮用水。
(4) 胶体具有良好的净水效果,其分散质微粒大小范围为
胶体具有良好的净水效果,其分散质微粒大小范围为___________ ,其净水原理是胶体粒子具有___________ 性。
(5)工业上有干法与湿法两种制备高铁酸钾( )的方法。
)的方法。
①干法制备高铁酸钾时,一般先制备得到 ,当制
,当制 发生如下反应:
发生如下反应: ,该反应每生成
,该反应每生成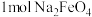 转移
转移___________  电子。
电子。
②湿法制备高铁酸钾的反应体系中主要有以下几种微粒: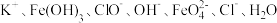 ,写出并配平湿法制高铁酸钾的离子反应方程式
,写出并配平湿法制高铁酸钾的离子反应方程式___________ 。
I.氯气常用于自来水的杀菌消毒,但用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效安全的消毒剂。
工业上制备
 的反应为:
的反应为: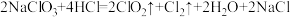 。
。(1)该反应中的还原产物是
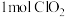 分子,转移电子的数目为
分子,转移电子的数目为(2)
 在杀菌消毒后转化为
在杀菌消毒后转化为 ,可能会生成副产物亚氯酸盐(
,可能会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.
C.
(3)含氰废水中的
 有剧毒。在碱性环境下
有剧毒。在碱性环境下 能被
能被 氧化成
氧化成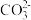 和
和 ,该反应氧化产物与还原产物物质的量之比为
,该反应氧化产物与还原产物物质的量之比为Ⅱ.高铁酸钾(
 )是一种新型绿色消毒剂,其在消毒后可形成胶体,可用于处理饮用水。
)是一种新型绿色消毒剂,其在消毒后可形成胶体,可用于处理饮用水。(4)
 胶体具有良好的净水效果,其分散质微粒大小范围为
胶体具有良好的净水效果,其分散质微粒大小范围为(5)工业上有干法与湿法两种制备高铁酸钾(
 )的方法。
)的方法。①干法制备高铁酸钾时,一般先制备得到
 ,当制
,当制 发生如下反应:
发生如下反应: ,该反应每生成
,该反应每生成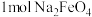 转移
转移 电子。
电子。②湿法制备高铁酸钾的反应体系中主要有以下几种微粒:
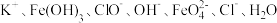 ,写出并配平湿法制高铁酸钾的离子反应方程式
,写出并配平湿法制高铁酸钾的离子反应方程式
您最近一年使用:0次
5 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即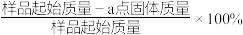 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即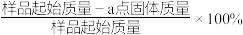 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为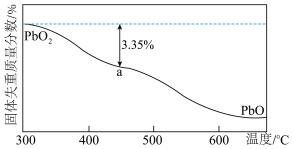
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
名校
6 . 请回答下列问题:
(1)标准状况下 与标准状况下
与标准状况下_______ L  气体含有相同数目的氢原子数。
气体含有相同数目的氢原子数。
(2)27g某二价金属的氯化物 中含有0.4mol的
中含有0.4mol的 ,则R的摩尔质量为
,则R的摩尔质量为_______ 。
(3)某实验过程中需要用 溶液配制
溶液配制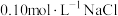 溶液475mL,配制过程中需要用到下列仪器中的
溶液475mL,配制过程中需要用到下列仪器中的_______ (填字母)。
A. B.
B. C.
C.  D.
D.
下列情况会使所配溶液浓度偏低的是_______ (填序号)。
①未进行洗涤操作
②转移至容量瓶中前容量瓶内有少量蒸馏水
③定容时,俯视容量瓶的刻度线
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为_______ 。
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则 中
中
_______ 。
(1)标准状况下
 与标准状况下
与标准状况下 气体含有相同数目的氢原子数。
气体含有相同数目的氢原子数。(2)27g某二价金属的氯化物
 中含有0.4mol的
中含有0.4mol的 ,则R的摩尔质量为
,则R的摩尔质量为(3)某实验过程中需要用
 溶液配制
溶液配制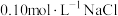 溶液475mL,配制过程中需要用到下列仪器中的
溶液475mL,配制过程中需要用到下列仪器中的A.
 B.
B. C.
C.  D.
D.
下列情况会使所配溶液浓度偏低的是
①未进行洗涤操作
②转移至容量瓶中前容量瓶内有少量蒸馏水
③定容时,俯视容量瓶的刻度线
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则
 中
中
您最近一年使用:0次
2023-12-14更新
|
244次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学校2023-2024学年高一上学期12月测试化学试题
7 . 根据所学知识回答下列问题:
(1)在一定条件下,实现以下物质间转化,下列说法错误的是________
Ca CaO
CaO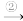 Ca(OH)2
Ca(OH)2 CaCO3
CaCO3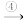 Ca(HCO3)2
Ca(HCO3)2
(2)在S2-、Fe2+、Cu2+、Na+中,既有氧化性又有还原性的是___________ 。
(3)某同学写出以下三个化学方程式(未配平)。
① NO + HNO3→ N2O3 + H2O
②N2O4 + H2O → HNO3 + HNO2
③ NH3 + NO → HNO2 + H2O
其中你认为一定不能实现的是___________ (填序号)。
(4)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①氧化剂是___________ (填化学式)。
②该反应中硝酸的作用是___________ (填字母)。
A.氧化剂 B.还原剂 C.酸性作用
③上述反应的离子方程式为___________ 。
④参加反应的HNO3与作为氧化剂的HNO3的个数之比为___________ 。
⑤配平反应________
___________ I2 + ___________ H2O +___________Cl2=___________ HIO3 + ___________ HCl
(1)在一定条件下,实现以下物质间转化,下列说法错误的是________
Ca
 CaO
CaO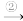 Ca(OH)2
Ca(OH)2 CaCO3
CaCO3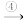 Ca(HCO3)2
Ca(HCO3)2| A.实现反应③只能向澄清石灰水中通入CO2气体 |
| B.反应①是氧化还原反应 |
| C.Ca→CaO的反应发生了化合反应 |
| D.CaCO3属于盐类物质,但是Ca(HCO3)2不属于盐类物质 |
(3)某同学写出以下三个化学方程式(未配平)。
① NO + HNO3→ N2O3 + H2O
②N2O4 + H2O → HNO3 + HNO2
③ NH3 + NO → HNO2 + H2O
其中你认为一定不能实现的是
(4)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①氧化剂是
②该反应中硝酸的作用是
A.氧化剂 B.还原剂 C.酸性作用
③上述反应的离子方程式为
④参加反应的HNO3与作为氧化剂的HNO3的个数之比为
⑤配平反应
___________ I2 + ___________ H2O +___________Cl2=___________ HIO3 + ___________ HCl
您最近一年使用:0次
名校
解题方法
8 . 元素化合物知识在化工生产和生活中发挥着重要作用,根据教材知识和题中所给资料完成下列各题
资料Ⅰ:铬元素的常见价态有+6、+3、+2价。在酸性介质中,+6价铬在酸性条件下以 存在,具有强氧化性,在碱性介质中以
存在,具有强氧化性,在碱性介质中以 存在。
存在。
资料Ⅱ:锰元素的常见价态有+7、+6、+4、+3、+2价,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
①在酸性介质中, 具有强氧化性,本身被还原为Mn2+。
具有强氧化性,本身被还原为Mn2+。
②在碱性、中性或微弱酸性溶液中, 仍旧是氧化剂,本身被还原为MnO2。
仍旧是氧化剂,本身被还原为MnO2。
资料Ⅲ:硫代硫酸钠: 俗名海波或大苏打,易溶于水,溶于水后呈碱性。
俗名海波或大苏打,易溶于水,溶于水后呈碱性。
S元素的化合价为+2价,具有还原性,遇酸不稳定发生歧化反应。
过二硫酸钠Na2S2O8中S元素的化合价是+6价,Na2S2O8是一种强氧化剂。
(1)写出Cr3+在酸性环境中被强氧化剂PbO2氧化的离子反应方程式___________ ,写出在碱性溶液中, 可以被H2O2氧化为离子反应方程式
可以被H2O2氧化为离子反应方程式___________ 。
(2)写出向高锰酸钾溶液中滴加H2C2O4溶液的离子反应方程式___________ 。
(3)写出Na2S2O3与盐酸反应的化学方程式___________ 。
(4)1个Na2S2O8中化合价为-2价的氧原子有___________ 个,其阴离子 结构中含有
结构中含有___________ 个过氧键(—O—O—)。
资料Ⅰ:铬元素的常见价态有+6、+3、+2价。在酸性介质中,+6价铬在酸性条件下以
 存在,具有强氧化性,在碱性介质中以
存在,具有强氧化性,在碱性介质中以 存在。
存在。资料Ⅱ:锰元素的常见价态有+7、+6、+4、+3、+2价,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
①在酸性介质中,
 具有强氧化性,本身被还原为Mn2+。
具有强氧化性,本身被还原为Mn2+。②在碱性、中性或微弱酸性溶液中,
 仍旧是氧化剂,本身被还原为MnO2。
仍旧是氧化剂,本身被还原为MnO2。资料Ⅲ:硫代硫酸钠:
 俗名海波或大苏打,易溶于水,溶于水后呈碱性。
俗名海波或大苏打,易溶于水,溶于水后呈碱性。S元素的化合价为+2价,具有还原性,遇酸不稳定发生歧化反应。
过二硫酸钠Na2S2O8中S元素的化合价是+6价,Na2S2O8是一种强氧化剂。
(1)写出Cr3+在酸性环境中被强氧化剂PbO2氧化的离子反应方程式
 可以被H2O2氧化为离子反应方程式
可以被H2O2氧化为离子反应方程式(2)写出向高锰酸钾溶液中滴加H2C2O4溶液的离子反应方程式
(3)写出Na2S2O3与盐酸反应的化学方程式
(4)1个Na2S2O8中化合价为-2价的氧原子有
 结构中含有
结构中含有
您最近一年使用:0次
名校
解题方法
9 . 化学与生活密切相关。下列说法正确的是
A.大力推广使用太阳能,太阳能电池板材料为 |
| B.长期服用阿司匹林引起酸中毒,可以服用纯碱溶液中和酸 |
| C.乡村建设使用水泥盖房和铺路,水泥属于传统硅酸盐材料 |
D.水果罐头中添加维生素 作抗氧化剂,是因为维生素 作抗氧化剂,是因为维生素 难被氧化 难被氧化 |
您最近一年使用:0次
2023-12-02更新
|
276次组卷
|
3卷引用:黑龙江省牡丹江市第三高级中学2023-2024学年高三上学期第三次月考化学试卷
名校
10 . 亚硝酰氯(NOCl)熔点为-64.5℃,沸点为-5.5℃,常温下是黄色有毒气体,易水解。实验室中可用Cl2与NO在常温常压下制备NOCl。回答下列问题:
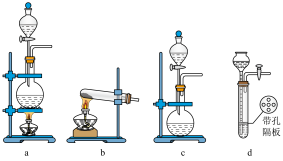
(1)若用MnO2和浓盐酸制取氯气,可以选用下列装置___________ (填字母)。
(2)若用铜和稀硝酸制取NO,则反应的离子方程式为___________ 。
(3)下列各装置按气流方向,连接的顺序为a接___________ 接d.
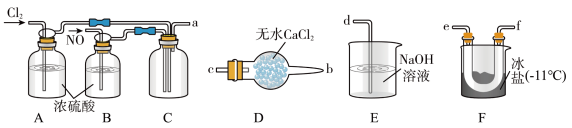
(4)①装置A和B的作用是___________ 、___________ 。
②反应开始时应先通入___________ 气体。
(5)装置F的作用是___________ 。
(1)若用MnO2和浓盐酸制取氯气,可以选用下列装置

(2)若用铜和稀硝酸制取NO,则反应的离子方程式为
(3)下列各装置按气流方向,连接的顺序为a接

(4)①装置A和B的作用是
②反应开始时应先通入
(5)装置F的作用是
您最近一年使用:0次
2023-11-30更新
|
186次组卷
|
2卷引用:黑龙江省哈尔滨市南岗中学2023-2024学年高三上学期期中考试化学试题



