名校
1 . 氮的化合物在日常生活及工、农业生产中涉及广泛,已知氮元素及其化合物的转化关系如图所示,回答下列问题。______ (填序号)。常用作制冷剂的氮的气态氢化物是______ (填化学式)。
(2)NO2为红棕色气体,与水反应的离子方程式:______ 。
(3)工业上用氨气制备NO的化学方程式是______ 。
(4)实验室中检验NH3的方法是______ (答出一种即可)。
海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。______ 种价态。
(6)反应③和⑤中,若生成等量的N2,则转移的电子数之比为______ 。

(2)NO2为红棕色气体,与水反应的离子方程式:
(3)工业上用氨气制备NO的化学方程式是
(4)实验室中检验NH3的方法是
海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。

(6)反应③和⑤中,若生成等量的N2,则转移的电子数之比为
您最近一年使用:0次
名校
2 . 金属矿物资源的利用有着非常重要的意义。回答下列问题:
(1)下列反应原理不符合工业冶炼金属实际情况的是_______(填字母)。
(2)白口铁(镀锌铁)在生产、生活中有广泛应用。某小组以菱锌矿(主要成分是 ,以及
,以及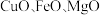 和
和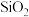 等)制备白口铁的流程如图:
等)制备白口铁的流程如图: 。
。
①“浸取”前将菱锌矿粉碎的目的是_______ 。
②“滤渣1”的主要成分是_______ (填化学式)。
③“滤渣3”中主要成分是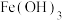 和
和 ,写出“氧化”时发生反应的离子方程式:
,写出“氧化”时发生反应的离子方程式:_______ 。
④加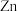 时转化的离子方程式为
时转化的离子方程式为_______ ,该工序基本反应类型为_______ 。
⑤取一定量的白口铁样品于试管中,加入足量稀硫酸,收集到标准状况下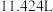 气体;再加入过量
气体;再加入过量 溶液,最后加入过量氨水。过滤、洗涤、干燥后得到
溶液,最后加入过量氨水。过滤、洗涤、干燥后得到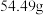 固体,该白口铁样品中铁的质量为
固体,该白口铁样品中铁的质量为_______  (结果保留一位小数)。
(结果保留一位小数)。
(1)下列反应原理不符合工业冶炼金属实际情况的是_______(填字母)。
A. | B.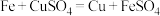 |
C. | D.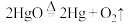 |
(2)白口铁(镀锌铁)在生产、生活中有广泛应用。某小组以菱锌矿(主要成分是
 ,以及
,以及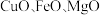 和
和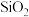 等)制备白口铁的流程如图:
等)制备白口铁的流程如图:
 。
。①“浸取”前将菱锌矿粉碎的目的是
②“滤渣1”的主要成分是
③“滤渣3”中主要成分是
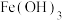 和
和 ,写出“氧化”时发生反应的离子方程式:
,写出“氧化”时发生反应的离子方程式:④加
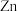 时转化的离子方程式为
时转化的离子方程式为⑤取一定量的白口铁样品于试管中,加入足量稀硫酸,收集到标准状况下
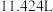 气体;再加入过量
气体;再加入过量 溶液,最后加入过量氨水。过滤、洗涤、干燥后得到
溶液,最后加入过量氨水。过滤、洗涤、干燥后得到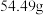 固体,该白口铁样品中铁的质量为
固体,该白口铁样品中铁的质量为 (结果保留一位小数)。
(结果保留一位小数)。
您最近一年使用:0次
2024-06-19更新
|
157次组卷
|
6卷引用:黑龙江省哈尔滨市第六中学校2023-2024学年高一下学期期末考试化学试题
真题
解题方法
3 . 中国是世界上最早利用细菌冶金的国家。已知金属硫化物在“细菌氧化”时转化为硫酸盐,某工厂用细菌冶金技术处理载金硫化矿粉(其中细小的 颗粒被
颗粒被 、
、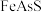 包裹),以提高金的浸出率并冶炼金,工艺流程如下:
包裹),以提高金的浸出率并冶炼金,工艺流程如下:
(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为_______ (填化学式)。
(2)“细菌氧化”中, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)“沉铁砷”时需加碱调节 ,生成
,生成_______ (填化学式)胶体起絮凝作用,促进了含 微粒的沉降。
微粒的沉降。
(4)“培烧氧化”也可提高“浸金”效率,相比“培烧氧化”,“细菌氧化”的优势为_______(填标号)。
(5)“真金不怕火炼”,表明 难被
难被 氧化,“浸金”中
氧化,“浸金”中 的作用为
的作用为_______ 。
(6)“沉金”中 的作用为
的作用为_______ 。
(7)滤液②经 酸化,
酸化, 转化为
转化为 和
和 的化学方程式为
的化学方程式为_______ 。用碱中和 可生成
可生成_______ (填溶质化学式)溶液,从而实现循环利用。
 颗粒被
颗粒被 、
、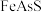 包裹),以提高金的浸出率并冶炼金,工艺流程如下:
包裹),以提高金的浸出率并冶炼金,工艺流程如下:
(1)北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为
(2)“细菌氧化”中,
 发生反应的离子方程式为
发生反应的离子方程式为(3)“沉铁砷”时需加碱调节
 ,生成
,生成 微粒的沉降。
微粒的沉降。(4)“培烧氧化”也可提高“浸金”效率,相比“培烧氧化”,“细菌氧化”的优势为_______(填标号)。
| A.无需控温 | B.可减少有害气体产生 |
| C.设备无需耐高温 | D.不产生废液废渣 |
(5)“真金不怕火炼”,表明
 难被
难被 氧化,“浸金”中
氧化,“浸金”中 的作用为
的作用为(6)“沉金”中
 的作用为
的作用为(7)滤液②经
 酸化,
酸化, 转化为
转化为 和
和 的化学方程式为
的化学方程式为 可生成
可生成
您最近一年使用:0次
2024-06-12更新
|
6572次组卷
|
9卷引用:2024年黑龙江省高考化学试卷
2024年黑龙江省高考化学试卷(已下线)2024年高考化学真题完全解读(黑龙江、吉林、辽宁卷)(课件+讲义)2024年吉林省高考化学试题2024年辽宁省高考化学试卷(已下线)10化学工艺流程综合(已下线)T16-工业流程题(已下线)暑假作业19 化学工艺流程题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)四川省泸州市合江县2023-2024学年高二下学期6月期末考试化学试题(已下线)专题15 工艺流程综合题-备战2025年高考化学真题题源解密(新高考通用)
4 . 某工厂利用铜屑脱除锌浸出液中的 并制备
并制备 ,流程如下“脱氯”步骤仅
,流程如下“脱氯”步骤仅 元素化合价发生改变。下列说法正确的是
元素化合价发生改变。下列说法正确的是
 并制备
并制备 ,流程如下“脱氯”步骤仅
,流程如下“脱氯”步骤仅 元素化合价发生改变。下列说法正确的是
元素化合价发生改变。下列说法正确的是
| 离子 |  |  |  |
浓度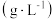 | 145 | 0.03 | 1 |
A.“浸铜”时应加入足量 ,确保铜屑溶解完全 ,确保铜屑溶解完全 |
B.“浸铜”反应: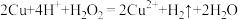 |
C.“脱氯”反应: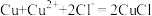 |
D.脱氯液净化后电解,可在阳极得到 |
您最近一年使用:0次
2024-06-12更新
|
6122次组卷
|
10卷引用:2024年黑龙江省高考化学试卷
2024年黑龙江省高考化学试卷(已下线)2024年高考化学真题完全解读(黑龙江、吉林、辽宁卷)(课件+讲义)2024年吉林省高考化学试题2024年辽宁省高考化学试卷(已下线)03离子反应(已下线)选择题11-15(已下线)暑假作业19 化学工艺流程题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)辽宁省朝阳市建平县实验中学2023-2024学年高二下学期7月期末考试化学试题(已下线)专题09 无机物的反应与转化 微型工艺流程-备战2025年高考化学真题题源解密(新高考通用)湖南省长沙市雅礼中学2025届高三上学期第一次月考化学试题
真题
名校
5 .  分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和
溶液;②淀粉、丙二酸和 混合溶液;③
混合溶液;③ 、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
 分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①
分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(① 溶液;②淀粉、丙二酸和
溶液;②淀粉、丙二酸和 混合溶液;③
混合溶液;③ 、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是
、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是A.无色→蓝色:生成 | B.蓝色→无色: 转化为化合态 转化为化合态 |
C. 起漂白作用 起漂白作用 | D.淀粉作指示剂 |
您最近一年使用:0次
2024-06-12更新
|
5993次组卷
|
10卷引用:2024年黑龙江省高考化学试卷
2024年黑龙江省高考化学试卷(已下线)2024年高考化学真题完全解读(黑龙江、吉林、辽宁卷)(课件+讲义)2024年吉林省高考化学试题2024年辽宁省高考化学试卷(已下线)04氧化还原反应(已下线)选择题6-10(已下线)暑假作业18 化学实验综合题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)(已下线)第01讲 氯及其重要化合物(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)专题09 无机物的反应与转化 微型工艺流程-备战2025年高考化学真题题源解密(新高考通用)四川省成都列五中学2024-2025学年高三上学期入学摸底测试 化学试题
真题
名校
6 . 家务劳动中蕴含着丰富的化学知识。下列相关解释错误的是
A.用过氧碳酸钠漂白衣物: 具有较强氧化性 具有较强氧化性 |
| B.酿米酒需晾凉米饭后加酒曲:乙醇受热易挥发 |
| C.用柠檬酸去除水垢:柠檬酸酸性强于碳酸 |
| D.用碱液清洗厨房油污:油脂可碱性水解 |
您最近一年使用:0次
2024-06-12更新
|
6346次组卷
|
11卷引用:2024年黑龙江省高考化学试卷
2024年黑龙江省高考化学试卷(已下线)2024年高考化学真题完全解读(黑龙江、吉林、辽宁卷)(课件+讲义)2024年吉林省高考化学试题2024年辽宁省高考化学试卷(已下线)01化学物质及其变化(已下线)04氧化还原反应(已下线)选择题1-5安徽省安庆一中2023-2024学年下学期高一年级期末考试化学试卷河南省南阳市内乡县实验高级中学2024-2025学年高三上学期学习效果检测化学试题江西省南昌市聚仁高级中学2024-2025学年高三上学期七月月考化学试题山西大学附属中学校2024~2025学年高三上学期8月第二次诊断考试化学试题
解题方法
7 . SnO2是锡的重要氧化物,现以锡锑渣(主要含塑料及SnO2、Sb4O6、PbO2)为原料,提纯SnO2的工艺流程图如下:
②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是_______ 。
(2)“沉铅”时同时生成S沉淀的化学方程式_______ 。
(3)“还原”时Na3SbO4发生的离子方程式为_______ 。
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。_______ 。
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为_______ 、用_______ 洗涤、干燥。
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为_______ 。

②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是
(2)“沉铅”时同时生成S沉淀的化学方程式
(3)“还原”时Na3SbO4发生的离子方程式为
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。
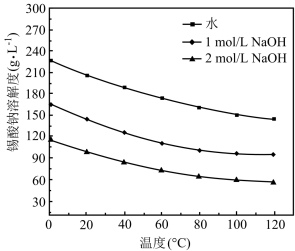
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
| A.工业制粗硅 | B.电解熔融氯化钠制钠 |
| C.氧化汞分解制汞 | D.工业炼铁 |
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为
您最近一年使用:0次
名校
8 . 我国稀土资源丰富,氟化镨( )常用于电弧碳棒添加剂。工业上采用方镨矿(主要成分
)常用于电弧碳棒添加剂。工业上采用方镨矿(主要成分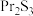 ,难溶于水)制备氟化镨的工艺流程如下:
,难溶于水)制备氟化镨的工艺流程如下: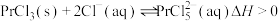
②80℃时,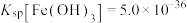
(1)步骤I为溶浸除硫,镨元素以 形式存在,则反应的离子方程式为
形式存在,则反应的离子方程式为___________ ;该反应中,每转移0.6mol电子,生成___________ g单质硫。
(2)加入 的目的为
的目的为___________ 。
(3)80℃时,若 ,“调pH”是控制
,“调pH”是控制 ,则该条件下,溶液中
,则该条件下,溶液中
___________ 。
(4)请用化学平衡移动原理解释过程中使用“趁热过滤”“冷却结晶”的原因:___________ 。
(5)写出步骤Ⅲ转化过程的化学方程式:___________ 。
(6)若某工厂用 kg方镨矿粉(含
kg方镨矿粉(含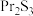 40%)制备
40%)制备 ,最终得到产品
,最终得到产品 kg,则产率为
kg,则产率为___________ (列出计算式即可)。
 )常用于电弧碳棒添加剂。工业上采用方镨矿(主要成分
)常用于电弧碳棒添加剂。工业上采用方镨矿(主要成分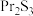 ,难溶于水)制备氟化镨的工艺流程如下:
,难溶于水)制备氟化镨的工艺流程如下:
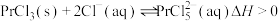
②80℃时,
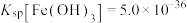
(1)步骤I为溶浸除硫,镨元素以
 形式存在,则反应的离子方程式为
形式存在,则反应的离子方程式为(2)加入
 的目的为
的目的为(3)80℃时,若
 ,“调pH”是控制
,“调pH”是控制 ,则该条件下,溶液中
,则该条件下,溶液中
(4)请用化学平衡移动原理解释过程中使用“趁热过滤”“冷却结晶”的原因:
(5)写出步骤Ⅲ转化过程的化学方程式:
(6)若某工厂用
 kg方镨矿粉(含
kg方镨矿粉(含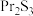 40%)制备
40%)制备 ,最终得到产品
,最终得到产品 kg,则产率为
kg,则产率为
您最近一年使用:0次
名校
9 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取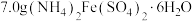 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至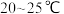 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加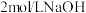 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于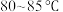 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
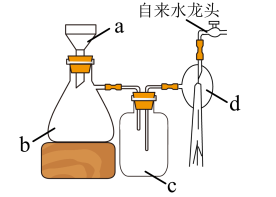
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,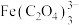 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
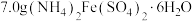 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至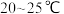 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加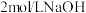 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于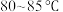 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,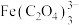 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近一年使用:0次
2024-05-26更新
|
472次组卷
|
3卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
解题方法
10 . 高铁酸盐是一种优良的净水剂。实验室合成高铁酸钾( )的过程如图所示:
)的过程如图所示:
回答下列问题:
(1)Fe位于元素周期表第___________ 周期第___________ 族, 中Fe的化合价为
中Fe的化合价为___________ 。
(2)“反应1”中氧化剂与还原剂的物质的量之比为___________ 。
(3)“洗气”操作可选用的装置为___________ (填字母)。___________ (填化学式)。从饱和KOH溶液中得到白色沉淀b需要使用的玻璃仪器为___________ 。
(5)“反应2”发生主要反应的化学方程式为___________ 。
(6)高铁酸盐还可用电解法制备。利用纯铁作电极插入浓的NaOH溶液电解制得 的工作原理如图所示。
的工作原理如图所示。 的电极反应式为
的电极反应式为___________ 。
②对装置进行改进,在阴、阳电极间设置阳离子交换膜,能有效提高 产率,离子交换膜的作用是
产率,离子交换膜的作用是___________ 。
 )的过程如图所示:
)的过程如图所示: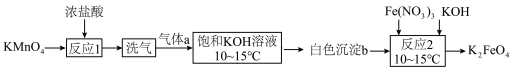
回答下列问题:
(1)Fe位于元素周期表第
 中Fe的化合价为
中Fe的化合价为(2)“反应1”中氧化剂与还原剂的物质的量之比为
(3)“洗气”操作可选用的装置为

(5)“反应2”发生主要反应的化学方程式为
(6)高铁酸盐还可用电解法制备。利用纯铁作电极插入浓的NaOH溶液电解制得
 的工作原理如图所示。
的工作原理如图所示。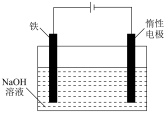
 的电极反应式为
的电极反应式为②对装置进行改进,在阴、阳电极间设置阳离子交换膜,能有效提高
 产率,离子交换膜的作用是
产率,离子交换膜的作用是
您最近一年使用:0次



