名校
解题方法
1 . 过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。
已知:2H2O2(l) 2H2O(l)+O2(g)+Q(Q>0)
2H2O(l)+O2(g)+Q(Q>0)
H2O2(l) H+(aq)+HO
H+(aq)+HO (aq) K=2.24×10-12(25℃)
(aq) K=2.24×10-12(25℃)
完成下列填空:
(1)氧原子核外电子亚层数为___ ,H2O2的电子式___ 。
(2)实验室可以使用稀H2SO4和H2O2溶解铜片,该反应的化学方程式为___ 。
(3)H2O2分解反应的平衡常数K=___ ;不同温度下H2O2分解反应的平衡常数K25℃___ K40℃(填“>”“<”或“=”)。
(4)25℃,H2O2的pH___ H2O(选填“大于”“小于”或“等于”)。研究表明,H2O2溶液中HO 的浓度越大,H2O2的分解速率越快。某温度下,不同浓度的H2O2分解率与pH的关系如图所示。
的浓度越大,H2O2的分解速率越快。某温度下,不同浓度的H2O2分解率与pH的关系如图所示。___ ;相同pH下,H2O2浓度越大H2O2分解率越低的原因是___ 。
(5)蓝色的CrO5遇H2O2会褪色,此反应可用于检验H2O2,发生反应如下: CrO5+
CrO5+ H2O2+
H2O2+ H+→
H+→ Cr3++
Cr3++ O2↑+
O2↑+ H2O,配平上述方程式
H2O,配平上述方程式___ 。
已知:2H2O2(l)
 2H2O(l)+O2(g)+Q(Q>0)
2H2O(l)+O2(g)+Q(Q>0)H2O2(l)
 H+(aq)+HO
H+(aq)+HO (aq) K=2.24×10-12(25℃)
(aq) K=2.24×10-12(25℃)完成下列填空:
(1)氧原子核外电子亚层数为
(2)实验室可以使用稀H2SO4和H2O2溶解铜片,该反应的化学方程式为
(3)H2O2分解反应的平衡常数K=
(4)25℃,H2O2的pH
 的浓度越大,H2O2的分解速率越快。某温度下,不同浓度的H2O2分解率与pH的关系如图所示。
的浓度越大,H2O2的分解速率越快。某温度下,不同浓度的H2O2分解率与pH的关系如图所示。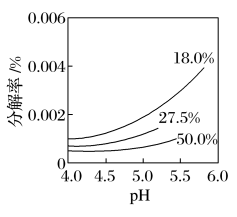
(5)蓝色的CrO5遇H2O2会褪色,此反应可用于检验H2O2,发生反应如下:
 CrO5+
CrO5+ H2O2+
H2O2+ H+→
H+→ Cr3++
Cr3++ O2↑+
O2↑+ H2O,配平上述方程式
H2O,配平上述方程式
您最近一年使用:0次
2022-01-20更新
|
195次组卷
|
4卷引用:福建省福州高级中学2023-2024学年高二下学期7月期末化学试题
福建省福州高级中学2023-2024学年高二下学期7月期末化学试题上海市徐汇区2022届高三一模化学试题上海市虹口区复兴高级中学2022-2023学年高三上学期期中考试化学试题(已下线)化学-2023年高考押题预测卷03(上海卷)(含考试版、全解全析、参考答案、答题卡)
名校
2 . “价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好的了解氮的循环。___________ ; 丙为钠盐,其化学式为___________ 。
(2)甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为___________ 。
(3)用以下物质研究乙的性质,预测能与乙发生反应的物质为___________(填标号)。
(4)丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与KI按物质的量1∶1恰好完全反应,且生成能使淀粉变蓝的物质,则产物中含氮元素物质的化学式为___________ 。
II.海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。___________ 种价态。
(6)反应③和⑤中,若生成等量的N2,则转移的电子数之比为___________ 。

(2)甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为
(3)用以下物质研究乙的性质,预测能与乙发生反应的物质为___________(填标号)。
| A.Na2SO4 | B.Mg | C.CO2 | D.NH3·H2O |
II.海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。
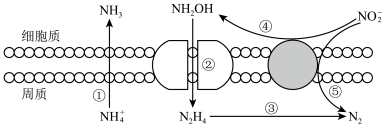
(6)反应③和⑤中,若生成等量的N2,则转移的电子数之比为
您最近一年使用:0次
2022-01-19更新
|
563次组卷
|
3卷引用:福建省南平市2020-2021学年高一上学期期末质量检测化学试题
3 . 科学家采用如图所示方法,利用锂循环可持续合成氨,跟氮气和氢气高温高压合成氨相比,反应条件更加温和。下列说法错误的是
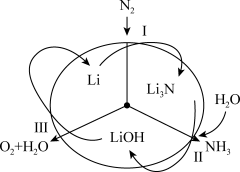

| A.Li3N、LiOH是中间产物 |
| B.三步反应都是氧化还原反应 |
C.第III步反应的化学方程式是4LiOH  4Li+O2↑+2H2O 4Li+O2↑+2H2O |
| D.反应过程中N2和H2O需要不断补充 |
您最近一年使用:0次
名校
4 . 高铁酸钠是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。
(1)电解法生产高铁酸钠的原理是: ,
, 中铁元素的化合价为
中铁元素的化合价为___________ ,若生成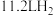 (标准状况),转移的电子数为
(标准状况),转移的电子数为___________ 。
(2)干法制备高铁酸钠的主要反应为: ,该反应中的还原剂是
,该反应中的还原剂是___________ ,生产1mol的高铁酸钠,需要消耗 的物质的量是
的物质的量是___________ mol。
(3)其净水过程中所发生的化学反应主要为:_____Na2FeO4+________H2O→_____Fe(OH)3(胶体)+_____NaOH+_____X↑,请推测X的化学式为___________ ,配平该化学方程式,将化学计量数标在上式横线处。___________
(1)电解法生产高铁酸钠的原理是:
 ,
, 中铁元素的化合价为
中铁元素的化合价为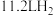 (标准状况),转移的电子数为
(标准状况),转移的电子数为(2)干法制备高铁酸钠的主要反应为:
 ,该反应中的还原剂是
,该反应中的还原剂是 的物质的量是
的物质的量是(3)其净水过程中所发生的化学反应主要为:_____Na2FeO4+________H2O→_____Fe(OH)3(胶体)+_____NaOH+_____X↑,请推测X的化学式为
您最近一年使用:0次
2022-01-19更新
|
464次组卷
|
2卷引用:福建省福州市2021-2022学年高一上学期期末质量检测化学试题
5 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。以下是氮元素的“价一类”二维图的部分信息。请回答下列问题:
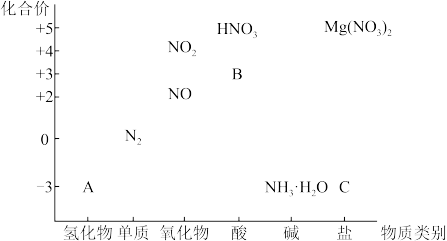
(1)亚硝酸(HNO2)在工业上用于有机合成,其在图中的字母标号为____ 。
(2)工业上制备A的化学方程式为____ ,检验C中含氮阳离子的方法是____ 。
(3)NO2溶于水发生反应3NO2+H2O=2HNO3+NO,若生成1molHNO3时,转移的电子数目为____ ,反应中NO2表现的性质为____ (填标号)。
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
(4)Mg(NO3)2受热会分解,有同学猜想分解产物为MgO、NO2、N2,这种猜想不合理的理由是_____ 。

(1)亚硝酸(HNO2)在工业上用于有机合成,其在图中的字母标号为
(2)工业上制备A的化学方程式为
(3)NO2溶于水发生反应3NO2+H2O=2HNO3+NO,若生成1molHNO3时,转移的电子数目为
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
(4)Mg(NO3)2受热会分解,有同学猜想分解产物为MgO、NO2、N2,这种猜想不合理的理由是
您最近一年使用:0次
解题方法
6 . 久置的 溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组对转化过程进行研究。
溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组对转化过程进行研究。
(1)甲同学认为在酸性条件下 易被氧化:
易被氧化: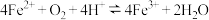 。其依据是
。其依据是 增大,平衡向
增大,平衡向_______ 移动, 增大。
增大。
(2)乙同学依据如下反应,推测在酸性条件下 不易被氧化:
不易被氧化:_______ (将反应补充完整)。
_______ 1
1 _______
_______ _______
_______ _______
_______
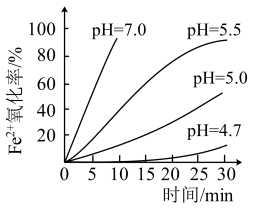
(3)研究小组测定了常温下不同pH对 被
被 氧化的氧化率随时间变化的关系,结果如图。结合图象分析可知,增大溶液pH,
氧化的氧化率随时间变化的关系,结果如图。结合图象分析可知,增大溶液pH, 被氧化速率
被氧化速率_______ (填“增大”“减小”或“无影响”)。pH越小 氧化率越
氧化率越_______ (填“大”或“小”)。
(4)室温下,在 的环境中,
的环境中, 的氧化变质可以理解为:
的氧化变质可以理解为:
第一步: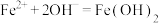
第二步:_______ (用化学方程式回答)
当氧化达到平衡时,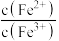
_______  (填“>”“<”或“=”)。(已知的
(填“>”“<”或“=”)。(已知的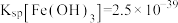 ,
,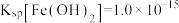 )
)
(5)通过以上研究可知,新配制的 溶液中常加入适量的铁粉和
溶液中常加入适量的铁粉和_______ 。
 溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组对转化过程进行研究。
溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组对转化过程进行研究。(1)甲同学认为在酸性条件下
 易被氧化:
易被氧化: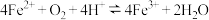 。其依据是
。其依据是 增大,平衡向
增大,平衡向 增大。
增大。(2)乙同学依据如下反应,推测在酸性条件下
 不易被氧化:
不易被氧化:_______
 1
1 _______
_______ _______
_______ _______
_______
(3)研究小组测定了常温下不同pH对
 被
被 氧化的氧化率随时间变化的关系,结果如图。结合图象分析可知,增大溶液pH,
氧化的氧化率随时间变化的关系,结果如图。结合图象分析可知,增大溶液pH, 被氧化速率
被氧化速率 氧化率越
氧化率越
(4)室温下,在
 的环境中,
的环境中, 的氧化变质可以理解为:
的氧化变质可以理解为:第一步:
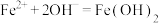
第二步:
当氧化达到平衡时,
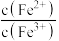
 (填“>”“<”或“=”)。(已知的
(填“>”“<”或“=”)。(已知的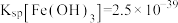 ,
, )
)(5)通过以上研究可知,新配制的
 溶液中常加入适量的铁粉和
溶液中常加入适量的铁粉和
您最近一年使用:0次
2022-01-16更新
|
125次组卷
|
2卷引用:福建省宁德市2021-2022学年高二上学期期末质量检测化学试题1
7 . 某炼锌的有机物钴渣逐级分离与富集钴的工艺流程如图:
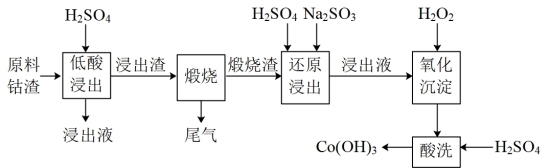
已知:
①原料钴渣的主要成分:钴的有机盐[(C3H6NS2)2Co]、ZnSO4•6H2O和Fe4(OH)2(SO4)5。
②“煅烧渣”中钴元素的主要成分:CoO、Co3O4和CoSO4。
③部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
回答下列问题:
(1)Fe4(OH)2(SO4)5中铁元素的化合价为____ 。
(2)低酸浸出液中,主要的金属阳离子为____ 。
(3)“煅烧”的主要目的是____ 。
(4)“还原浸出”时,钴元素发生还原反应的离子方程式为_____ 。
(5)已知电位差△E>0时,“氧化沉淀”反应可以发生,△E越大,反应越容易进行。△E=E(H2O2/H2O)-E[(Co(Ⅲ)/Co(Ⅱ)]、E(H2O2/H2O)、E[(Co(Ⅲ)/Co(Ⅱ)]与pH的关系如图。“氧化沉淀”时,向还原浸出液添加试剂的正确操作为____ (选填序号),理由是_____ 。
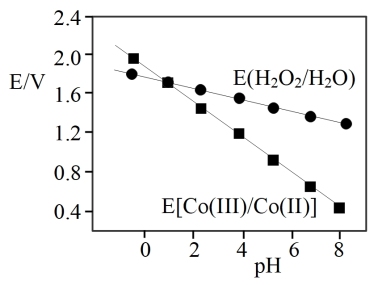
a.直接加入H2O2
b.先加入NaOH溶液,调节pH,再加入H2O2
c.先加入H2SO4溶液,调节pH,再加入H2O2
(6)“酸洗”可除去钴渣中少量Fe(OH)3、Zn(OH)2等杂质,应控制溶液的pH范围为____ 。

已知:
①原料钴渣的主要成分:钴的有机盐[(C3H6NS2)2Co]、ZnSO4•6H2O和Fe4(OH)2(SO4)5。
②“煅烧渣”中钴元素的主要成分:CoO、Co3O4和CoSO4。
③部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Zn(OH)2 |
| 开始沉淀 | 2.2 | 7.4 | 5.9 | -1.1 | 6.2 |
| 完全沉淀 | 3.2 | 8.9 | 9.2 | 1.1 | 8.0 |
(1)Fe4(OH)2(SO4)5中铁元素的化合价为
(2)低酸浸出液中,主要的金属阳离子为
(3)“煅烧”的主要目的是
(4)“还原浸出”时,钴元素发生还原反应的离子方程式为
(5)已知电位差△E>0时,“氧化沉淀”反应可以发生,△E越大,反应越容易进行。△E=E(H2O2/H2O)-E[(Co(Ⅲ)/Co(Ⅱ)]、E(H2O2/H2O)、E[(Co(Ⅲ)/Co(Ⅱ)]与pH的关系如图。“氧化沉淀”时,向还原浸出液添加试剂的正确操作为

a.直接加入H2O2
b.先加入NaOH溶液,调节pH,再加入H2O2
c.先加入H2SO4溶液,调节pH,再加入H2O2
(6)“酸洗”可除去钴渣中少量Fe(OH)3、Zn(OH)2等杂质,应控制溶液的pH范围为
您最近一年使用:0次
名校
解题方法
8 . 自然界的氮循环包括以下过程。下列说法中,不正确 的是

| A.硝化过程中,含氮物质被氧化 |
| B.氨氧化过程中,亚硝态氮元素与铵态氮元素理论物质的量之比为3:4 |
C.N2→ 属于氮的固定,N2发生还原反应 属于氮的固定,N2发生还原反应 |
| D.土壤中Fe2+和Fe3+的存在有利于从与其接触的水体中除去氮元素 |
您最近一年使用:0次
2022-01-14更新
|
2966次组卷
|
22卷引用:福建省安溪县第一中学2021-2022学年高一下学期第一次月考化学试题
福建省安溪县第一中学2021-2022学年高一下学期第一次月考化学试题北京市海淀区2021-2022学年高一上学期期末参考样题化学试题(已下线)章末培优 第5章 化工生产中的重要非金属元素-2021-2022学年高一化学课后培优练(人教版2019必修第二册)黑龙江省双鸭山市第一中学2021-2022学年高二下学期第一次月考化学试题山东省济宁市兖州区2021-2022学年高一下学期期中考试化学试题辽宁省辽南协作体2021-2022学年高一下学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高一下学期期中考试化学试题湖北省重点高中智学联盟2021-2022学年高一下学期5月联考化学试题山东省临沂第一中学2021-2022学年高一下学期6月月考化学试题山西省运城市景胜中学2021-2022学年高一下学期3月月考化学试题新疆生产建设兵团第一师高级中学2022-2023学年高一下学期4月月考化学试题第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册) 湖北省仙桃中学2022-2023学年高一上学期10月月考化学试题北京市第五十中学2022-2023学年高一下学期期中考试化学试题(已下线)考点巩固卷04 非金属及其化合物(4大考点60题)?-2024年高考化学一轮复习考点通关卷(新高考通用)云南省昆明市第三中学2023-2024学年高二上学期第一次综合测试化学试题宁夏石嘴山第三中学2023-2024学年高三上学期期中考试化学试题(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】云南省开远市第一中学校2023-2024学年高一下学期3月月考化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题北京市第十五中学2023-2024学年高一下学期期中考试化学试题北京市怀柔区2023-2024学年第一中学高一上学期期末考试 化学 试题
名校
9 . 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。
I.以下是硫元素形成的部分物质的价类二维图及相互转化的部分信息。
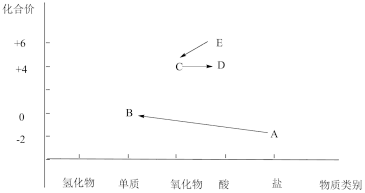
(1)A是一种钠盐,它的电离方程式是___________ 。加入氯水,可完成从A →B的转化,氯水起到的作用是___________ 。
(2)D的化学式是___________ ,写出C →D的化学方程式___________ 。
(3)写出E →C的化学方程式___________ 。
II.双碱法脱除烟气中SO2的过程如下图所示。
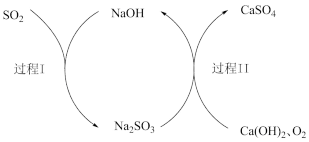
(4)过程I的化学方程式是___________ ,该反应中,含S元素物质发生了类别间的转化,具体来说是___________ 类物质向___________ 类物质的转化。
(5)过程II中含硫元素物质发生了___________ 反应 (填“氧化”或者“还原”),反应中氧化剂是___________ 。 写出该反应的化学方程式___________ 。
(6)该过程中可以循环利用的物质是___________ 。
I.以下是硫元素形成的部分物质的价类二维图及相互转化的部分信息。

(1)A是一种钠盐,它的电离方程式是
(2)D的化学式是
(3)写出E →C的化学方程式
II.双碱法脱除烟气中SO2的过程如下图所示。

(4)过程I的化学方程式是
(5)过程II中含硫元素物质发生了
(6)该过程中可以循环利用的物质是
您最近一年使用:0次
2022-01-12更新
|
213次组卷
|
2卷引用:福建省厦门大学附属科技中学2023-2024学年高一上学期12月月考化学试卷
名校
10 . 2021年,我国科学家利用 为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应:
为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应: ,设
,设 为阿伏加德罗常数,下列有关说法正确的是。
为阿伏加德罗常数,下列有关说法正确的是。
 为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应:
为原料人工合成淀粉,在未来具有极高的经济价值。已知合成淀粉过程中发生反应: ,设
,设 为阿伏加德罗常数,下列有关说法正确的是。
为阿伏加德罗常数,下列有关说法正确的是。A. 中含有过氧键数目为 中含有过氧键数目为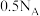 |
B.标况下, 中含有的羟基数为 中含有的羟基数为 |
| C.反应过程中HCHO为还原产物 |
D.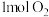 参与反应转移电子数为 参与反应转移电子数为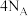 |
您最近一年使用:0次
2022-01-09更新
|
1154次组卷
|
11卷引用:福建省泉州实验中学2022-2023学年高三上学期12月月考化学试题
福建省泉州实验中学2022-2023学年高三上学期12月月考化学试题广东省汕头市2021-2022学年高三上学期期末教学质量监测化学试题黑龙江省大庆铁人中学2021-2022学年高二下学期开学考试化学试题(已下线)一轮巩固卷5-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)(已下线)卷02 阿伏加德罗常数的正误判断-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)查补易混易错点02 阿伏加德罗常数及应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)查补易混易错点02 阿伏加德罗常数及应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)河南省顶级名校2021-2022学年高一下学期5月月考化学试题广东省普宁市华侨中学2021-2022学年高三下学期第二次模拟考化学试题(已下线)化学(广东A卷)-学易金卷:2023年高考第一次模拟考试卷广东省深圳市新安中学2022-2023学年高三上学期周末测试(2022.9.25)化学试题



