19-20高三·江苏苏州·期末
名校
1 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
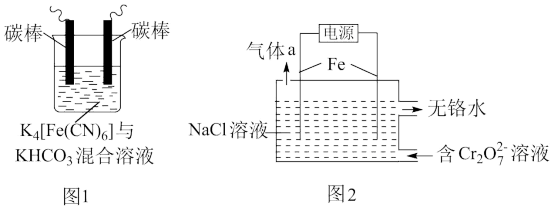
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
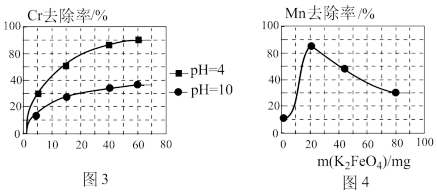
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:【苏州新东方】化学试卷
(已下线)【苏州新东方】化学试卷(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
2 . 制备高铁酸钾[K2FeO4]并用其除去土壤和废水中的有机砷(HAPA)与无机砷[+3价砷表示As(Ⅲ)]的流程如图所示:
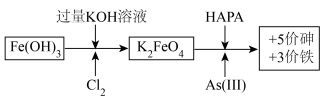
已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为___ 。
(2)K2FeO4去除砷污染时作__ (填“氧化剂”或“还原剂”)。若污染物中的砷全部以Na3AsO3计,则去除全部污染时Na3AsO3与K2FeO4的物质的量之比为__ 。
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。
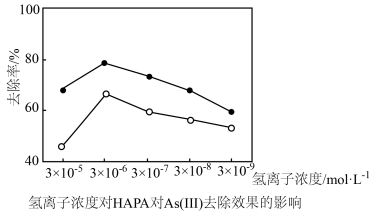
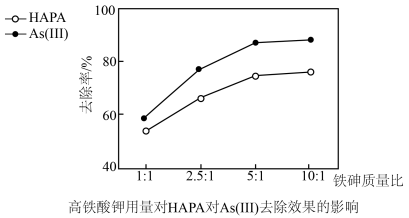
①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)__ 。
②最佳铁砷质量比为___ ,理由是__ 。

已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为
(2)K2FeO4去除砷污染时作
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。


①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)
②最佳铁砷质量比为
您最近一年使用:0次
2021-01-28更新
|
716次组卷
|
4卷引用:山东省潍坊市2020-2021学年高一上学期期末统考化学试题
山东省潍坊市2020-2021学年高一上学期期末统考化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题
3 . 将 通入足量
通入足量 溶液中,完全反应后再加入
溶液中,完全反应后再加入 溶液,发生的两个化学反应为①
溶液,发生的两个化学反应为①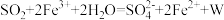 ,②
,②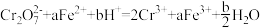 。下列有关说法正确的是
。下列有关说法正确的是
 通入足量
通入足量 溶液中,完全反应后再加入
溶液中,完全反应后再加入 溶液,发生的两个化学反应为①
溶液,发生的两个化学反应为①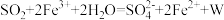 ,②
,②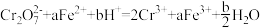 。下列有关说法正确的是
。下列有关说法正确的是A.还原性:  |
B.方程式②中,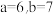 |
C. 能将 能将 氧化成 氧化成 |
D.方程式①中 为 为 |
您最近一年使用:0次
2021-01-11更新
|
581次组卷
|
2卷引用:专题4 本专题复习提升-高中化学苏教2019版必修第一册
名校
4 . 据所学知识完成以下题目:
(1)在下列反应中,HCl做还原剂的是_______ ,HCl做氧化剂的是_______ 。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,_______ 。
②Mn2++ +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,_______ 。
(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,_______ 。
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是____ ;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂_____ mol,有_____ mol电子发生转移,相当于测出含钙元素的质量是_____ g。
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____ 。
(1)在下列反应中,HCl做还原剂的是
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓)
 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O④KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,
②Mn2++
 +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
您最近一年使用:0次
2020-12-24更新
|
1696次组卷
|
5卷引用:福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题
福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题05 氧化还原反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练 (已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)
5 .  、NO是大气污染物。吸收
、NO是大气污染物。吸收 和NO,获得
和NO,获得 和
和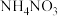 产品的流程图(图1)如下(Ce为铈元素):
产品的流程图(图1)如下(Ce为铈元素):
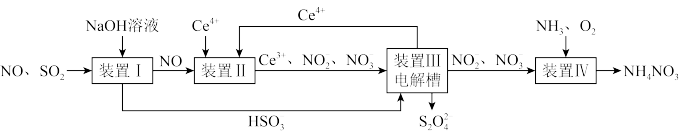
图1
(1)装置Ⅰ中生成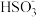 的离子方程式为
的离子方程式为_________________________________________________ 。
(2)各含硫微粒(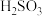 、
、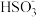 和
和 )存在于
)存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
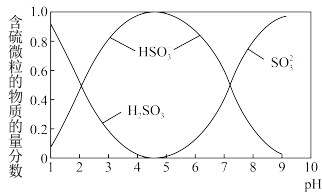
图2
①下列说法正确的是__________ (填序号)。
a. 时,溶液中
时,溶液中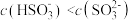
b. 时,溶液中
时,溶液中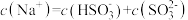
c.为获得尽可能纯的 ,可将溶液的pH控制在4~5
,可将溶液的pH控制在4~5
②向 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:
溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:_____________________________________________ 。
(3)装置Ⅱ中,酸性条件下,NO被 氧化的产物主要是
氧化的产物主要是 、
、 ,写出生成
,写出生成 (无
(无 )的离子方程式:
)的离子方程式:_____________________________________________ 。
(4)已知进入装置Ⅳ的溶液中, 的浓度为
的浓度为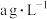 ,要使
,要使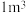 该溶液中的
该溶液中的 完全转化为
完全转化为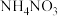 ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的
__________ L。(用含a的代数式表示)
 、NO是大气污染物。吸收
、NO是大气污染物。吸收 和NO,获得
和NO,获得 和
和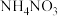 产品的流程图(图1)如下(Ce为铈元素):
产品的流程图(图1)如下(Ce为铈元素):
图1
(1)装置Ⅰ中生成
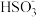 的离子方程式为
的离子方程式为(2)各含硫微粒(
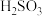 、
、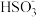 和
和 )存在于
)存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
图2
①下列说法正确的是
a.
 时,溶液中
时,溶液中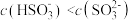
b.
 时,溶液中
时,溶液中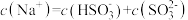
c.为获得尽可能纯的
 ,可将溶液的pH控制在4~5
,可将溶液的pH控制在4~5②向
 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:
溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:(3)装置Ⅱ中,酸性条件下,NO被
 氧化的产物主要是
氧化的产物主要是 、
、 ,写出生成
,写出生成 (无
(无 )的离子方程式:
)的离子方程式:(4)已知进入装置Ⅳ的溶液中,
 的浓度为
的浓度为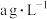 ,要使
,要使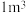 该溶液中的
该溶液中的 完全转化为
完全转化为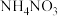 ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的
您最近一年使用:0次
2020-10-12更新
|
530次组卷
|
3卷引用:鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过模拟 2年模拟精编精练
6 . A、B、C、D是原子序数依次递增的四种短周期元素。基态A原子所含的电子只有一种运动状态;基态B原子中有三个未成对电子。A、B、C、D四种元素共同组成化合物M,M可发生如下反应:
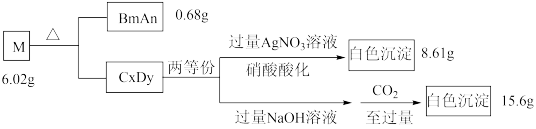
回答下列问题:
(1)B原子的价电子排布式为_______ 。实验室制备BmAn的化学方程式是_________ 。
(2)A、C、D三种元素的原子半径由大到小的顺序为_________ (用元素符号表示)。
(3)B元素的第一电离能比同周期相邻两种元素的都高;原因是____________ 。
(4) D元素的一种氧化物D2O为淡棕黄色气体,可由新制的HgO和D2发生歧化反应(氧化剂和还原剂为同一种物质的反应)制得。上述制备D2O的化学方程式为_________ 。
(5)D元素的另一种氧化物DO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaDO2、NaHSO4、NaHCO3的泡腾片,能快速溶于水,溢出大量气泡,得到DO2溶液。上述过程中,生成DO2的反应属于歧化反应,每生成1 mol DO2消耗NaDO2的量为_____ mol;若产生的“气泡”与DO2的物质的量相等,则反应过程中消耗NaDO2、NaHSO4、NaHCO3的物质的量之比为____________ 。
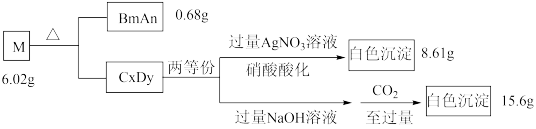
回答下列问题:
(1)B原子的价电子排布式为
(2)A、C、D三种元素的原子半径由大到小的顺序为
(3)B元素的第一电离能比同周期相邻两种元素的都高;原因是
(4) D元素的一种氧化物D2O为淡棕黄色气体,可由新制的HgO和D2发生歧化反应(氧化剂和还原剂为同一种物质的反应)制得。上述制备D2O的化学方程式为
(5)D元素的另一种氧化物DO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaDO2、NaHSO4、NaHCO3的泡腾片,能快速溶于水,溢出大量气泡,得到DO2溶液。上述过程中,生成DO2的反应属于歧化反应,每生成1 mol DO2消耗NaDO2的量为
您最近一年使用:0次
7 . 某离子反应涉及H2O、ClO-、 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
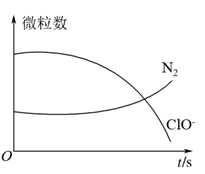
 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
| A.该反应中Cl-为氧化产物 |
| B.消耗1个还原剂微粒,转移6e- |
C. 被ClO-氧化成N2 被ClO-氧化成N2 |
| D.反应后溶液的酸性减弱 |
您最近一年使用:0次
2020-10-02更新
|
1131次组卷
|
8卷引用:山东省济南外国语学校2018届高三12月考试化学试题
8 . 写出下列反应的离子方程式(已知还原性: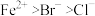 ):
):
(1)向 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 ):
):_________ ;
(2)向 溶液中通入足量
溶液中通入足量 :
:______ ;
(3)向 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:______ 。
 ):
):(1)向
 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 ):
):(2)向
 溶液中通入足量
溶液中通入足量 :
:(3)向
 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:
您最近一年使用:0次
2020-10-01更新
|
1459次组卷
|
3卷引用:人教版(2019)高一必修第一册 第一章 物质及其变化 章末总结
解题方法
9 . 化学实验中,如使某步反应中的有害产物作为另一步反应的反应物,形成一个循环,就可不再向环境排放该种有害物质。如图所示。
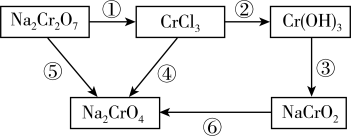
(1)配平反应方程式并回答问题,用单线桥标出两个反应的电子转移的方向和数目。
反应①: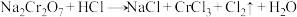 ,
,__________ ,氧化剂为__________ (填化学式,后同),氧化产物为__________ 。
反应⑥: ,
,__________ ,还原剂为__________ ,还原产物为__________ 。
(2)在上述有编号的步骤中,除了①⑥外,还需用到氧化剂的步骤是__________ (填编号)。

(1)配平反应方程式并回答问题,用单线桥标出两个反应的电子转移的方向和数目。
反应①:
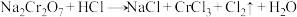 ,
,反应⑥:
 ,
,(2)在上述有编号的步骤中,除了①⑥外,还需用到氧化剂的步骤是
您最近一年使用:0次
2020-09-23更新
|
1586次组卷
|
5卷引用:高一必修第一册(鲁科2019)第2章 章末综合检测卷
高一必修第一册(鲁科2019)第2章 章末综合检测卷人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 方法帮高一必修第一册(苏教2019)专题4 第二单元 硫及其化合物的相互转化1(已下线)第05讲 氧化还原反应(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)第05讲 氧化还原反应(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )
解题方法
10 . 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选。正极材料的选择决定了锂离子电池的性能。磷酸亚铁锂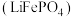 以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
(1)高温固相法是生产磷酸亚铁锂的主要方法。通常以亚铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛中先经过较低温预分解,再经高温焙烧,最后研磨粉碎制成。请回答下列问题:
①补充完整该反应的化学方程式: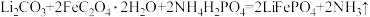
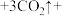
_____ 
______ 。
②理论上,反应中每转移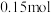 电子,会生成
电子,会生成
_____ g。
③反应需在惰性气氛中进行,其原因是____________ 。
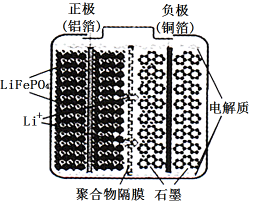
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型 通过黏合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
通过黏合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
电池工作时的总反应为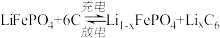 ,则放电时,正极的电极反应式为
,则放电时,正极的电极反应式为________ ,充电时,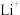 迁移方向为
迁移方向为_____ (填“由左向右”或“由右向左”),图中聚合物隔膜应为_____ (填“阳”或“阴”)离子交换膜。
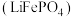 以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。(1)高温固相法是生产磷酸亚铁锂的主要方法。通常以亚铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛中先经过较低温预分解,再经高温焙烧,最后研磨粉碎制成。请回答下列问题:
①补充完整该反应的化学方程式:
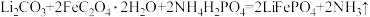
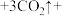

②理论上,反应中每转移
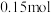 电子,会生成
电子,会生成
③反应需在惰性气氛中进行,其原因是
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型
 通过黏合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
通过黏合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
电池工作时的总反应为
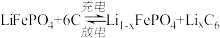 ,则放电时,正极的电极反应式为
,则放电时,正极的电极反应式为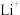 迁移方向为
迁移方向为
您最近一年使用:0次
2020-09-19更新
|
802次组卷
|
3卷引用:鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第2节 化学能转化为电能——电池
鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第2节 化学能转化为电能——电池山东省青岛通济实验学校学校2021届高三上学期10月月考化学试题(已下线)练习8 原电池 化学电源-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)



