名校
解题方法
1 . 红矾钠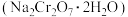 可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。

已知:i. 溶液中存在以下平衡:
溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
(1)Ⅰ中, 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:_______ 。
(2)Ⅱ中,加入NaOH调节pH至_______ (填字母序号)。
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中, 氧化
氧化 沉淀的化学方程式为
沉淀的化学方程式为_______ 。
(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高, 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是_______ 。
(5)Ⅳ中,加入 的作用是
的作用是_______ (结合平衡移动原理解释)。
(6)为了测定获得红矾钠( )的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至
)的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为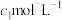 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗 。(已知:
。(已知: 。)
。)
①滴定终点的现象为_______ 。
②所得 (摩尔质量为
(摩尔质量为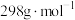 )的纯度的表达式为
)的纯度的表达式为_______ (用质量分数表示)。
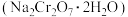 可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
已知:i.
 溶液中存在以下平衡:
溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 4.3 | 5.6 |
 | 7.1 | 9.2 |
 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:(2)Ⅱ中,加入NaOH调节pH至
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中,
 氧化
氧化 沉淀的化学方程式为
沉淀的化学方程式为(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高,
 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是(5)Ⅳ中,加入
 的作用是
的作用是(6)为了测定获得红矾钠(
 )的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至
)的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为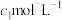 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗 。(已知:
。(已知: 。)
。)①滴定终点的现象为
②所得
 (摩尔质量为
(摩尔质量为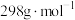 )的纯度的表达式为
)的纯度的表达式为
您最近一年使用:0次
2023-01-06更新
|
921次组卷
|
9卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题福建师范大学附属中学2022-2023学年高二下学期开学考试(期末考)化学试卷北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十一中学2022-2023学年高二上学期期末考试化学试题北京一七一中学2023-2024学年高二上学期12月阶段性诊断化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题
名校
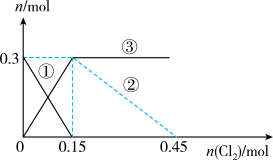
2 . 向100mL
 溶液中逐渐通入
溶液中逐渐通入 ,其中
,其中 、
、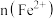 、
、 随通入
随通入 的物质的量
的物质的量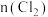 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是

 溶液中逐渐通入
溶液中逐渐通入 ,其中
,其中 、
、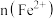 、
、 随通入
随通入 的物质的量
的物质的量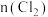 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是
A.②代表 ,③代表 ,③代表 |
B.还原性强弱: |
C. 时,溶液中 时,溶液中 |
D.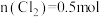 时,总的离子方程式为: 时,总的离子方程式为: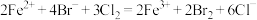 |
您最近一年使用:0次
2023-01-04更新
|
399次组卷
|
2卷引用:湖北省荆州市八县市2022-2023学年高一上学期期末联考化学试题
名校
解题方法
3 . 为保证家中所用器具与居住环境的洁净卫生,往往需使用各种各样的消毒剂,其中含氯消毒剂是目前广泛使用的一类消毒剂。
(1)用下列两种方法制取氯气:①用含有146 g HCl的浓盐酸与足量的 反应;②用87 g
反应;②用87 g  与足量的浓盐酸反应,所得氯气_______(填标号)。
与足量的浓盐酸反应,所得氯气_______(填标号)。
(2)氯气通入淀粉-KI溶液后可观察到溶液变蓝,可得氧化性:
_______ (填“>”或“<”) ,已知氧化性
,已知氧化性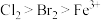 ,若将71g
,若将71g 通入含1 mol
通入含1 mol  的溶液中,写出反应的离子方程式:
的溶液中,写出反应的离子方程式:_______ 。
(3) 是新型消毒剂,已知在酸性条件下
是新型消毒剂,已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。NaOH溶液吸收 ,生成物质的量之比为1:1的两种盐,其中一种为
,生成物质的量之比为1:1的两种盐,其中一种为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(4)漂白粉的有效成分为_______ (填化学式,下同),露置于空气中一段时间的漂白粉,加稀盐酸后产生的气体除了可能有 和HCl外,还可能含有
和HCl外,还可能含有_______ 。在制备漂白粉的过程中,若温度控制不当,易生成 ,若向
,若向 溶液中通入一定量的
溶液中通入一定量的 ,制得的混合物中
,制得的混合物中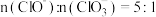 ,则反应中被氧化和被还原的Cl的物质的量之比为
,则反应中被氧化和被还原的Cl的物质的量之比为_______ 。
(1)用下列两种方法制取氯气:①用含有146 g HCl的浓盐酸与足量的
 反应;②用87 g
反应;②用87 g  与足量的浓盐酸反应,所得氯气_______(填标号)。
与足量的浓盐酸反应,所得氯气_______(填标号)。| A.②比①多 | B.①比②多 | C.一样多 | D.无法比较 |

 ,已知氧化性
,已知氧化性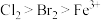 ,若将71g
,若将71g 通入含1 mol
通入含1 mol  的溶液中,写出反应的离子方程式:
的溶液中,写出反应的离子方程式:(3)
 是新型消毒剂,已知在酸性条件下
是新型消毒剂,已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为 ,生成物质的量之比为1:1的两种盐,其中一种为
,生成物质的量之比为1:1的两种盐,其中一种为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)漂白粉的有效成分为
 和HCl外,还可能含有
和HCl外,还可能含有 ,若向
,若向 溶液中通入一定量的
溶液中通入一定量的 ,制得的混合物中
,制得的混合物中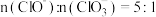 ,则反应中被氧化和被还原的Cl的物质的量之比为
,则反应中被氧化和被还原的Cl的物质的量之比为
您最近一年使用:0次
2022-11-29更新
|
269次组卷
|
3卷引用:河北省保定市唐县第一中学2022-2023学年高一上学期第三次考试化学试题
4 .  、
、 、NO是有害气体,有多种方法处理有害气体的工艺。
、NO是有害气体,有多种方法处理有害气体的工艺。
Ⅰ.一种脱除 回收硫碘工艺的两个阶段主要反应分别如下:
回收硫碘工艺的两个阶段主要反应分别如下:
第一阶段:
第二阶段:
(1)该工艺需控制第一阶段与第二阶段参加反应的 的物质的量之比
的物质的量之比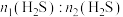 约为1:2.若过大,会导致
约为1:2.若过大,会导致_______ 。
(2) 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为_______ 。

Ⅱ.有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示。
作用下的脱硝反应机理如图所示。
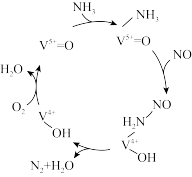
(3)根据如图机理,等物质的量的NO、 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是_______ 。
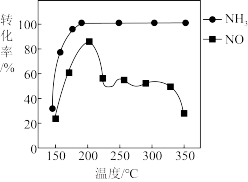
(4)按上述图中 、NO和
、NO和 的比例进行催化脱硝反应。相同反应时间,
的比例进行催化脱硝反应。相同反应时间, 和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是_______ 。
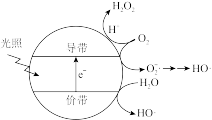
(5)羟基自由基(HO·)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成HO·;光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为HO·;描述产生HO·的另一种过程:
直接转化为HO·;描述产生HO·的另一种过程:_______ 。
 、
、 、NO是有害气体,有多种方法处理有害气体的工艺。
、NO是有害气体,有多种方法处理有害气体的工艺。Ⅰ.一种脱除
 回收硫碘工艺的两个阶段主要反应分别如下:
回收硫碘工艺的两个阶段主要反应分别如下:第一阶段:

第二阶段:

(1)该工艺需控制第一阶段与第二阶段参加反应的
 的物质的量之比
的物质的量之比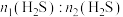 约为1:2.若过大,会导致
约为1:2.若过大,会导致(2)
 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为
Ⅱ.有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示。
作用下的脱硝反应机理如图所示。
(3)根据如图机理,等物质的量的NO、
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(4)按上述图中
 、NO和
、NO和 的比例进行催化脱硝反应。相同反应时间,
的比例进行催化脱硝反应。相同反应时间, 和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
(5)羟基自由基(HO·)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成HO·;光照时,价带失去电子产生有强氧化性的空穴,价带上
 直接转化为HO·;描述产生HO·的另一种过程:
直接转化为HO·;描述产生HO·的另一种过程:
您最近一年使用:0次
2022-05-28更新
|
709次组卷
|
5卷引用:江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题
江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题湖南省2022-2023学年第十五届中学生数理化生综合实践活动高一化学应用知识展示A卷(已下线)期末模拟预测卷B-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试B卷】
名校
5 . 铁与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图所示,下列说法错误的是
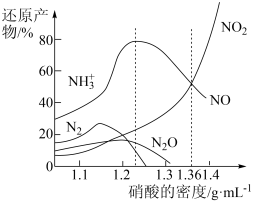
| A.其他条件相同,铁与足量密度为1.23g/mL的硝酸反应,还原产物主要为NO |
| B.一定量的铁粉与足量密度为1.36g/mL的HNO3反应,得到气体2.24L(标准状况),则参加反应的硝酸的物质的量为0.3mol |
| C.足量铁与一定量密度为1.36g/mL的硝酸反应,反应的化学方程式始终为:2Fe+6HNO3=2Fe(NO3)2+NO↑+NO2↑+3H2O |
| D.硝酸的密度越大,其还原产物中高价态的成分所占比例越多 |
您最近一年使用:0次
2022-04-21更新
|
1055次组卷
|
7卷引用:湖北省武汉市部分重点中学2021-2022学年高一下学期期中联考化学试题
解题方法
6 . 含砷废水常见于采矿、半导体等工业,部分砷的化合物有毒,因此需除去废水中的砷。
Ⅰ.天然水体中砷元素主要以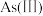 和
和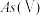 存在。在
存在。在 水溶液中,各种微粒的物质的量分数与溶液
水溶液中,各种微粒的物质的量分数与溶液 的关系如图1所示。
的关系如图1所示。
(1)当天然水体的 为4时,水体中所含
为4时,水体中所含 的主要微粒是
的主要微粒是_______ 。
(2)将 溶液滴入
溶液滴入 溶液中,当
溶液中,当 达到8时,所发生反应的离子方程式为
达到8时,所发生反应的离子方程式为_______ 。此时,溶液中含砷离子浓度由大到小的顺序为_______ 。
(3) 时,向
时,向 溶液中加入
溶液中加入 溶液至中性,此时溶液中
溶液至中性,此时溶液中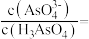
_______ 。
Ⅱ.利用高铁酸盐处理含砷废水。在一定 范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同
范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同 对
对 除砷影响如图2所示。
除砷影响如图2所示。
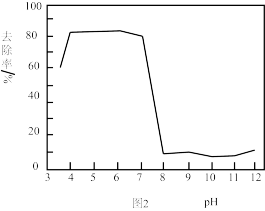
已知:溶液的 对胶体粒子表面所带电荷有影响。
对胶体粒子表面所带电荷有影响。 时,胶体粒子表面带正电荷,
时,胶体粒子表面带正电荷, 越低,表面所带正电荷越多。
越低,表面所带正电荷越多。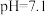 时,胶体粒子表面不带电荷;
时,胶体粒子表面不带电荷;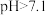 时,胶体粒子表面带负电荷,
时,胶体粒子表面带负电荷, 越高,表面所带负电荷越多。
越高,表面所带负电荷越多。
(4)结合图1和图2分析,除砷过程中控制废水 约为
约为_______ 适宜, 过低或过高,砷的去除率都会下降。
过低或过高,砷的去除率都会下降。 过低,主要以
过低,主要以 形式存在,不易形成
形式存在,不易形成 胶体。
胶体。 过高,一是
过高,一是 氧化性减弱,产生
氧化性减弱,产生 胶体的量少;二是
胶体的量少;二是_______ ;三是 过高,生成
过高,生成 沉淀而不是
沉淀而不是 胶体。
胶体。
(5)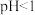 时,
时, 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
Ⅰ.天然水体中砷元素主要以
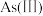 和
和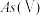 存在。在
存在。在 水溶液中,各种微粒的物质的量分数与溶液
水溶液中,各种微粒的物质的量分数与溶液 的关系如图1所示。
的关系如图1所示。
(1)当天然水体的
 为4时,水体中所含
为4时,水体中所含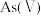 的主要微粒是
的主要微粒是(2)将
 溶液滴入
溶液滴入 溶液中,当
溶液中,当 达到8时,所发生反应的离子方程式为
达到8时,所发生反应的离子方程式为(3)
 时,向
时,向 溶液中加入
溶液中加入 溶液至中性,此时溶液中
溶液至中性,此时溶液中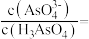
Ⅱ.利用高铁酸盐处理含砷废水。在一定
 范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同
范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同 对
对 除砷影响如图2所示。
除砷影响如图2所示。
已知:溶液的
 对胶体粒子表面所带电荷有影响。
对胶体粒子表面所带电荷有影响。 时,胶体粒子表面带正电荷,
时,胶体粒子表面带正电荷, 越低,表面所带正电荷越多。
越低,表面所带正电荷越多。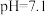 时,胶体粒子表面不带电荷;
时,胶体粒子表面不带电荷;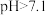 时,胶体粒子表面带负电荷,
时,胶体粒子表面带负电荷, 越高,表面所带负电荷越多。
越高,表面所带负电荷越多。(4)结合图1和图2分析,除砷过程中控制废水
 约为
约为 过低或过高,砷的去除率都会下降。
过低或过高,砷的去除率都会下降。 过低,主要以
过低,主要以 形式存在,不易形成
形式存在,不易形成 胶体。
胶体。 过高,一是
过高,一是 氧化性减弱,产生
氧化性减弱,产生 胶体的量少;二是
胶体的量少;二是 过高,生成
过高,生成 沉淀而不是
沉淀而不是 胶体。
胶体。(5)
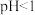 时,
时, 氧化
氧化 的离子方程式为
的离子方程式为
您最近一年使用:0次
2022-01-25更新
|
217次组卷
|
2卷引用:山东省威海市2021-2022学年高二上学期期末考试化学试题
名校
7 . 二氧化氯( )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: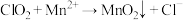 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: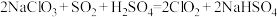 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
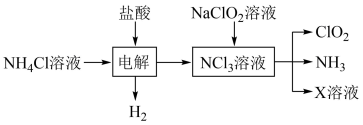
已知: 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法不 正确的是
 )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: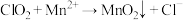 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: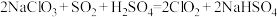 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
已知:
 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法A. 的空间构型为三角锥形 的空间构型为三角锥形 |
B.电解池中总反应的化学方程式为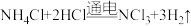 |
C.X溶液中主要存在的离子有: 、 、 、 、 |
D.饮用水制备过程中残留的 可用适量 可用适量 溶液去除 溶液去除 |
您最近一年使用:0次
2021-11-19更新
|
1315次组卷
|
4卷引用:江苏省无锡市2021-2022学年高三上学期期中教学质量调研测试化学试题
8 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是___________ 。
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___________ 。
(3)根据上述反应可推知___________。
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方向和数目:  。
。___________
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为
(3)根据上述反应可推知___________。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
 。
。
您最近一年使用:0次
名校
9 . 电视剧《西游记》中仙境美仑美奂,这些神话仙境中所需的烟雾是 和
和 粉按质量比
粉按质量比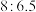 混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有
混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有 和水生成。有关的说法中正确的是
和水生成。有关的说法中正确的是
①水起着溶解 ,发生吸热现象以启动反应的发生的作用;②每还原
,发生吸热现象以启动反应的发生的作用;②每还原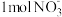 需氧化
需氧化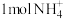 和
和 ;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由
;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由 反应放热而蒸出。
反应放热而蒸出。
 和
和 粉按质量比
粉按质量比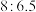 混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有
混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有 和水生成。有关的说法中正确的是
和水生成。有关的说法中正确的是①水起着溶解
 ,发生吸热现象以启动反应的发生的作用;②每还原
,发生吸热现象以启动反应的发生的作用;②每还原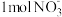 需氧化
需氧化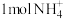 和
和 ;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由
;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由 反应放热而蒸出。
反应放热而蒸出。| A.①② | B.②③ | C.③④ | D.①④ |
您最近一年使用:0次
2021-04-17更新
|
535次组卷
|
3卷引用:江苏省天一中学2020-2021学年高一下学期期中考试(强化班)化学试题
江苏省天一中学2020-2021学年高一下学期期中考试(强化班)化学试题河北沧州泊头一中2020-2021学年高一下学期第二次月考化学试卷(已下线)第二章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
名校
解题方法
10 . 含有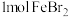 的溶液中,通入
的溶液中,通入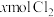 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是
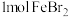 的溶液中,通入
的溶液中,通入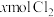 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是A.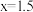 , ,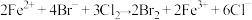 |
B.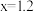 , ,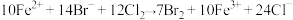 |
C. , ,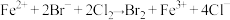 |
D. , ,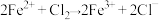 |
您最近一年使用:0次
2021-04-08更新
|
648次组卷
|
4卷引用:上海市金山区2021届高三二模化学试题
上海市金山区2021届高三二模化学试题宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题



